Đề kiểm tra giữa học kì 1 Hóa học 10 có đáp án- Đề 2
-
733 lượt thi
-
31 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Nội dung thuộc đối tượng nghiên cứu của hóa học là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Hóa học nghiên cứu về thành phần, cấu trúc, tính chất, sự biến đổi của các chất và các hiện tượng kèm theo.
Câu 2:
Một loại nguyên tử hydrogen có cấu tạo đơn giản nhất, chỉ tạo nên từ 1 electron và 1 proton (không chứa neutron). Phát biểu nào sau đây là đúng khi nói về nguyên tử hydrogen này?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tử hydrogen này có:
Khối lượng hạt nhân = khối lượng hạt proton ≈ 1 amu
Khối lượng lớp vỏ = khối lượng hạt electron ≈ 0,00055 amu
⇒ Khối lượng hạt nhân nguyên tử lớn hơn khối lượng lớp vỏ là ≈ 1818 lần.
Phát biểu A sai vì: Khối lượng nguyên tử xấp xỉ 1 amu, là nguyên tử nhẹ nhất trong số các nguyên tử được biết cho đến nay.
Phát biểu B sai vì: Khối lượng nguyên tử xấp xỉ 1 amu.
Phát biểu D sai vì: Kích thước của hạt nhân rất nhỏ so với kích thước của nguyên tử.
Câu 3:
Nguyên tử gồm
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tử gồm hạt nhân chứa proton, neutron và vỏ nguyên tử chứa electron.
Câu 4:
Hạt nhân nguyên tử X có chứa 15 proton và 16 neutron. Số khối của hạt nhân nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Số khối của hạt nhân nguyên tử X là: A = Z + N = 15 + 16 = 31.
Câu 5:
Cho các nguyên tử sau: A (Z = 8, A = 16), B (Z = 9, A = 19), C (Z = 8, A = 17), D (Z = 7, A = 17). Trong các nguyên tử trên, các nguyên tử thuộc cùng một nguyên tố hóa học là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Các nguyên tử thuộc cùng một nguyên tử hóa học khi có cùng số đơn vị điện tích hạt nhân (Z) ⇒ Các nguyên tử A và C thuộc cùng một nguyên tố hóa học (đều có Z = 8).
Câu 6:
Nguyên tử nitrogen có 7 electron. Điện tích hạt nhân của nguyên tử này là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tử nitrogen có số proton = số electron = 7.
Điện tích hạt nhân nguyên tử là: +7.
Câu 7:
Một nguyên tử có chứa 11 electron và 12 neutron. Kí hiệu nguyên tử này là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Số hiệu nguyên tử (Z) = số proton = số electron = 11.
Số khối (A) = Z + N = 11 + 12 = 23.
Vậy kí hiệu của nguyên tử X là .
Câu 8:
Trong tự nhiên, lithium có 2 đồng vị là 7Li và 6Li. Nguyên tử khối trung bình của Li là 6,93. Phần trăm số nguyên tử của đồng vị 7Li là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Gọi phần trăm số nguyên tử của đồng vị 7Li là x% ⇒ phần trăm số nguyên tử của đồng vị 6Li là (100 − x)%
Ta có: ⇒ x = 93
Phần trăm số nguyên tử của đồng vị 7Li là 93%.
Câu 9:
Hình ảnh dưới đây chỉ hình dạng của orbital nào?
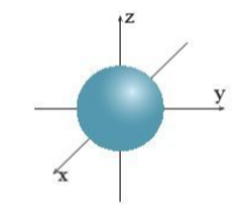
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
AO s là orbital có dạng hình cầu.
Câu 10:
Sự phân bố electron vào các lớp và phân lớp căn cứ vào
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Sự phân bố electron vào các lớp và phân lớp căn cứ vào mức năng lượng electron.
Câu 11:
Lớp M chứa số electron tối đa là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Lớp M (n = 3) chứa số electron tối đa là: 2.32 =18 electron.
Câu 12:
Lớp electron thứ 4 còn được gọi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số thứ tự lớp và tên gọi là các chữ cái in hoa như bảng sau:
|
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Tên lớp |
K |
L |
M |
N |
O |
P |
Q |
Câu 13:
Cấu hình electron của nguyên tử sulfur (Z = 16) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tử sulfur có Z = 16 nên nguyên tử có 16 electron.
⇒ Cấu hình electron là 1s22s22p63s23p4.
Câu 14:
Ở trạng thái cơ bản, nguyên tử của nguyên tố phosphorus (Z = 15) có số electron độc thân là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình electron nguyên tử P (Z = 15): 1s22s22p63s23p3.
Sự phân bố các electron vào AO:
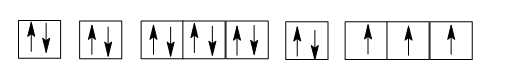
Nguyên tử của nguyên tố phosphorus (Z = 15) có số electron độc thân là 3.
Câu 15:
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu nguyên tử của nguyên tố X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron của X là: 1s22s22p63s2.
Vậy số hiệu nguyên tử X = số electron = 12.
Câu 16:
Số hiệu nguyên tử của nguyên tố hoá học bằng
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số hiệu nguyên tử của nguyên tố hoá học bằng số thứ tự của ô nguyên tố.
Câu 17:
Cấu hình electron của nguyên tử oxygen là 1s22s22p4. Vị trí của oxygen trong bảng tuần hoàn là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Oxygen có 8 electron nên số hiệu nguyên tử là 8, oxygen ở ô số 8 trong bảng tuần hoàn.
Oxygen ở chu kì 2 (do có 2 lớp electron); nhóm VIA (do 6 electron hóa trị, nguyên tố p).
Câu 18:
Nguyên tố aluminium (Al) có số hiệu nguyên tử là 13. Al thuộc khối nguyên tố
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron nguyên tử của Al là: 1s22s22p63s23p1 ⇒ Al thuộc khối nguyên tố p.
Câu 19:
Nguyên tử của nguyên tố nào sau đây có tính phi kim mạnh nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Trong bảng tuần hoàn, fluorine có độ âm điện lớn nhất nên có tính phi kim mạnh nhất.
Câu 20:
Phát biểu nào sau đây là đúng về xu hướng biến đổi tính kim loại trong bảng tuần hoàn các nguyên tố hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tính kim loại giảm dần theo chiều từ trái sang phải trong một chu kì và tăng dần từ trên xuống dưới trong một nhóm.
Câu 21:
Độ âm điện là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Độ âm điện là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố khi tạo thành liên kết hóa học.
Câu 22:
Sulfur là nguyên tố hóa học thuộc nhóm VIA của bảng tuần hoàn. Công thức oxide cao nhất của sulfur là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Sulfur là nguyên tố nhóm VIA nên có hóa trị cao nhất trong hợp chất là VI.
Công thức oxide cao nhất của sulfur là SO3.
Câu 23:
Oxide nào sau đây có tính base mạnh nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Na, Cl, S, Mg đều thuộc chu kì 3 trong bảng tuần hoàn. Na thuộc nhóm IA (hay kim loại ở đầu chu kì 3) nên Na2O có tính base mạnh nhất trong số các oxide đề bài cho.
Câu 24:
Trong các chất dưới đây, chất nào có tính acid yếu nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
|
Nhóm |
IVA |
VA |
VIA |
VIIA |
|
Nguyên tố |
Si |
P |
S |
Cl |
|
Công thức hydroxide |
H2SiO3 |
H3PO4 |
H2SO4 |
HClO4 |
Theo quy luật biến đổi tính chất trong một chu kì ta có acid H2SiO3 có tính acid yếu nhất.
Câu 25:
Các nguyên tố kim loại thuộc nhóm IA còn được gọi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các nguyên tố kim loại thuộc nhóm IA còn được gọi là nhóm kim loại kiềm.
Câu 26:
Nguyên tố M thuộc chu kì 3, nhóm VA của bảng tuần hoàn. Số hiệu nguyên tử của nguyên tố M là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tố M thuộc chu kì 3, nhóm VA.
Cấu hình electron của nguyên tố M là: 1s22s22p63s23p3
Vậy số hiệu nguyên tử của nguyên tố M là: Z = 15.
Câu 27:
Cấu hình eletron lớp ngoài cùng của nguyên tố X là 3s1. Oxide cao nhất của X có tính chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cấu hình eletron lớp ngoài cùng của nguyên tố X là 3s1 suy ra X ở nhóm IA trong bảng tuần hoàn.
Oxide cao nhất của X là Na2O, có tính base mạnh.
Câu 28:
Sắp xếp tính base của NaOH, Mg(OH)2, Al(OH)3 theo chiều giảm dần là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Na, Mg, Al cùng thuộc chu kì 3 trong bảng tuần hoàn, theo chiều tăng dần của điện tích hạt nhân, tính base của hydroxide có xu hướng giảm dần theo thứ tự NaOH, Mg(OH)2, Al(OH)3.
Câu 29:
Hai nguyên tố A, B đứng kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn và có tổng số đơn vị điện tích hạt nhân là 25. Xác định vị trí (ô, chu kì, nhóm) của hai nguyên tố A và B trong bảng tuần hoàn (có giải thích ngắn gọn cách xác định).
 Xem đáp án
Xem đáp án
a) Gọi số đơn vị điện tích hạt nhân nguyên tử của nguyên tố A là Z.
Hai nguyên tố A, B đứng kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn nên số đơn vị điện tích hạt nhân của nguyên tố B là Z + 1.
Theo bài: Z + (Z + 1) = 25 ⇒ Z = 12
⇒ Nguyên tử A có 12 electron, nguyên tử B có 13 electron.
+ Cấu hình electron của A là 1s22s22p63s2.
Nguyên tố A thuộc ô số 12 (do Z = 12), chu kì 3 (do có 3 lớp electron), nhóm IIA (do 2 electron hóa trị, nguyên tố s).
+ Cấu hình electron của B là 1s22s22p63s23p1.
Nguyên tố B thuộc ô số 13 (do Z =13), chu kì 3 (do có 3 lớp electron), nhóm IIIA (do 3 electron hóa trị, nguyên tố p).
Câu 30:
Nguyên tử của nguyên tố X có tổng số hạt (proton, electron, neutron) là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12.
Tính số hạt mỗi loại (proton, electron, neutron) trong nguyên tử X.
 Xem đáp án
Xem đáp án
Gọi số hạt proton, neutron và electron trong X lần lượt là P, N và E.
Nguyên tử trung hòa về điện nên P = E.
Theo bài ra ta có hệ phương trình:
Giải hệ phương trình được:
P = E = 13 và N = 14.
Câu 31:
Cho các nguyên tố sau: Li (Z = 3), O (Z = 8), F (Z = 9), Na (Z = 11).
Sắp xếp các nguyên tố trên theo chiều tăng dần bán kính nguyên tử, có giải thích ngắn gọn cách sắp xếp.
 Xem đáp án
Xem đáp án
Ta có:
+ Li, O, F cùng thuộc chu kì 2 trong bảng tuần hoàn. Trong một chu kì theo chiều tăng dần điện tích hạt nhân nguyên tử, bán kính nguyên tử giảm dần ⇒ bán kính nguyên tử:
F < O < Li (1)
+ Li và Na cùng thuộc nhóm IA. Trong một nhóm, theo chiều tăng dần điện tích hạt nhân nguyên tử, bán kính nguyên tử tăng dần ⇒ bán kính nguyên tử: Li < Na (2)
Vậy dãy gồm các nguyên tố được sắp xếp theo chiều tăng dần bán kính nguyên tử là:
F, O, Li, Na.
