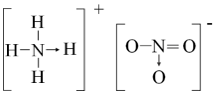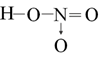Đề kiểm tra Học kì 1 Hóa 10 - Bộ sách Cánh diều có đáp án (Đề 2)
-
1114 lượt thi
-
32 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phát biểu A không đúng do hạt nhân của hầu hết nguyên tử được cấu tạo nên bởi các hạt proton và neutron.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Số đơn vị điện tích hạt nhân = số hiệu nguyên tử (Z) = 11.
Câu 3:
Cho các kí hiệu nguyên tử: và các phát biểu sau:
(1) X và Y là 2 đồng vị của nhau
(2) X với Y có cùng số khối.
(3) Có ba nguyên tố hóa học.
(4) Z và T thuộc cùng nguyên tố hóa học.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phát biểu đúng là (2); (3); (4)
Phát biểu (1) sai vì X và Y không phải đồng vị của nhau do khác nhau số proton.
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình electron nguyên tử Ca: 1s22s22p63s23p64s2.
Vậy cấu hình electron lớp ngoài cùng là: 4s2.
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
A sai vì khí hiếm He chỉ có 2 electron ở lớp ngoài cùng.
B và C sai do He có 2 electron lớp ngoài cùng nhưng là khí hiếm; H có 1 electron lớp ngoài cùng nhưng là phi kim …
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Câu 7:
Lớp N có số phân lớp là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Lớp N (n = 4) có 4 phân lớp 4s, 4p, 4d, 4f.
Câu 8:
Ion X2+ có cấu hình electron ở trạng thái cơ bản 1s22s22p6. Nguyên tố X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
X → X2+ + 2e
Þ Cấu hình electron của X là: 1s22s22p63s2.
Vậy X là Mg (Z = 12).Câu 9:
Các nguyên tố trong bảng tuần hoàn hiện tại được sắp xếp không tuân theo nguyên tắc nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Bảng tuần hoàn hiện nay được sắp xếp theo các quy tắc sau:
- Các nguyên tố hóa học được sắp xếp từ trái sang phải và từ trên xuống dưới theo chiều tăng dần điện tích hạt nhân nguyên tử.
- Các nguyên tố mà nguyên tử có cùng số lớp electron được xếp vào cùng một hàng.
- Các nguyên tố mà nguyên tử có cùng số electron hóa trị như nhau được xếp vào cùng một cột.
Câu 10:
Nguyên tố X thuộc chu kì 4. Nguyên tử X có số lớp electron là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Nguyên tố X có số lớp electron = số thứ tự chu kì = 4.
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nhóm A bao gồm các nguyên tố s và nguyên tố p.
Câu 12:
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron nguyên tử Na (Z = 11): 1s22s22p63s1.
Câu 13:
Nguyên tố R thuộc nhóm VIA. Công thức oxide cao nhất của R là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nguyên tố R thuộc nhóm VIA nên R có hóa trị cao nhất là VI. Công thức oxide cao nhất của R là RO3.
Câu 14:
Nguyên tử X có phân lớp electron ngoài cùng là 3p4. Nhận định nào dưới đây không đúng trong các câu sau khi nói về nguyên tử X?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phát biểu C sai vì hạt nhân nguyên tử không chứa electron.
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Ô nguyên tố không cho biết số khối của hạt nhân.
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
X ở chu kì 3 nên có 3 lớp electron, nhóm IIIA nên có 3 electron lớp ngoài cùng.
Cấu hình electron của nguyên tử nguyên tố X là 1s²2s²2p63s²3p¹.
Câu 17:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Liên kết hydrogen là liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tử hydrogen có 1 electron ở lớp ngoài cùng, có xu hướng đạt cấu hình electron bền vững của khí hiếm helium khi tham gia hình thành liên kết hóa học.
Câu 19:
Cho sơ đồ liên kết giữa hai phân tử acid CH3COOH:
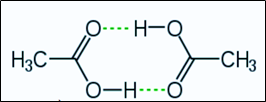
Trong sơ đồ trên, đường nét đứt đại diện cho
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Trong sơ đồ trên, đường nét đứt đại diện cho liên kết hydrogen.Câu 20:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung là liên kết cộng hoá trị.
Câu 21:
Chỉ ra nội dung không đúng khi xét phân tử CO2?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phân tử CO2 có cấu tạo thẳng.
Câu 22:
Nguyên tử X có 11 electron p, còn nguyên tử Y có 5 electron s. Liên kết giữa X và Y là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron nguyên tử X: 1s22s22p63s23p5 Þ X là phi kim điển hình (nhóm VIIA).
Cấu hình electron nguyên tử Y: 1s22s22p63s1 Þ Y là kim loại điển hình (nhóm IA).
Vậy liên kết giữa X với Y là liên kết ion.
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron nguyên tử Ca: [Ar]4s2.
Nguyên tử Ca có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron để đạt cấu hình electron bền vững giống khí hiếm.
Ca → Ca2+ + 2e
Câu 24:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Hợp chất cộng hóa trị không phân cực là: N2.
Câu 25:
Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p – p?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Ta có:
H (Z = 1): 1s1
Cl (Z = 17): 1s22s22p63s23p5
N (Z = 7): 1s22s22p3
Vậy liên kết trong phân tử Cl2 được hình thành bởi sự xen phủ orbital p – p.
Câu 26:
Số hợp chất ion được tạo thành từ các ion F–, K+, O2–, Ca2+ là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các hợp chất ion có thể được tạo thành là: KF; K2O; CaF2; CaO.
Câu 28:
Cho công thức Lewis của các phân tử sau:
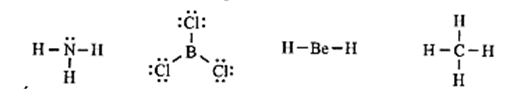
Số phân tử mà nguyên tử trung tâm không thoả mãn quy tắc octet là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Có hai phân tử mà nguyên tử trung tâm không thỏa mãn quy tắc octet là BCl3 và BeH2.
Câu 29:
Nêu nội dung quy tắc octet? Trong liên kết hóa học, quy tắc octet giúp giải thích điều gì?
 Xem đáp án
Xem đáp án
- Quy tắc octet: Trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như khí hiếm.
- Quy tắc octet giúp giải thích một cách định tính (dự đoán) sự hình thành các loại liên kết trong phân tử, đặc biệt là cách viết công thức cấu tạo trong các hợp chất thông thường.
Câu 31:
 Xem đáp án
Xem đáp án
Quá trình hình thành liên kết ion diễn ra như sau:
- Hình thành các ion trái dấu từ các quá trình nguyên tử kim loại nhường electron và nguyên tử phi kim nhận electron theo quy tắc octet.
K → K+ + 1e
Số electron trên các lớp: 2, 8, 8, 1 2, 8, 8
Cấu hình electron: [Ar]4s1 [Ar]
F + 1e → F-
Số electron trên các lớp: 2, 7 2, 8
Cấu hình electron: [He]2s22p5 [Ne]
- Các ion trái dấu hút nhau bằng lực hút tĩnh điện tạo nên hợp chất ion.
K+ + F- → KF
Câu 32:
Cho các khí hiếm sau: He (Z = 2), Ne (Z = 10), Ar (Z = 18), Kr (Z = 36), Xe (Z = 54). Khí hiếm nào có nhiệt độ nóng chảy cao nhất. Giải thích.
 Xem đáp án
Xem đáp án
Theo chiều tăng dần của điện tích hạt nhân nguyên tử trong nhóm VIIIA (nhóm khí hiếm), bán kính nguyên tử tăng đồng thời khối lượng nguyên tử tăng.
⇒ Tương tác van der Waals tăng ⇒ Nhiệt độ nóng chảy tăng.
⇒ Khí hiếm có nhiệt độ nóng chảy cao nhất trong dãy là Xe.