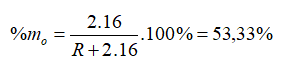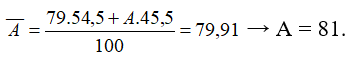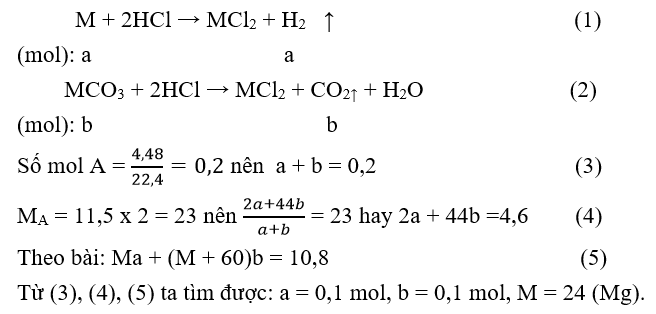Đề thi giữa kì 1 Hóa 10 có đáp án (Bài số 2 - Đề 1)
-
3428 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Nguyên tử X và Y có hiệu số nguyên tử lần lượt là 19 và 15. Nhận xét nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn C
Cấu hình electron nguyên tử X là: → X có 1electron lớp ngoài cùng, vậy X là kim loại.
Cấu hình electron nguyên tử của Y là: → Y có 5electron lớp ngoài cùng, vậy Y là phi kim.
Câu 3:
Liên kết trong phân tử là
 Xem đáp án
Xem đáp án
Chọn D
Liên kết hình thành giữa 2 nguyên tử phi kim giống nhau là liên kết cộng hóa trị không phân cực.
Câu 4:
Cho cấu hình electron của các nguyên tử sau:
(X)
(Y)
(Z)
(T)
Dãy các cấu hình electron của các nguyên tử kim loại là
 Xem đáp án
Xem đáp án
Chọn B
X có 5 electron lớp ngoài cùng nên là phi kim → loại các đáp án A, C và D.
Câu 5:
Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử, số oxi hóa cao nhất của các nguyên tố nhóm A trong oxit biến đổi như thế nào?
 Xem đáp án
Xem đáp án
Chọn D
Trong 1 chu kì, theo chiều tăng dần của điện tích hạt nhân nguyên tử, số oxi hóa cao nhất của các nguyên tố nhóm A trong oxit tăng dần.
Câu 6:
Liên kết trong phân tử KCl là liên kết nào?
 Xem đáp án
Xem đáp án
Chọn C
Liên kết hình thành giữa kim loại điển hình và phi kim điển hình là liên kết ion.
Câu 7:
Nguyên tố R có Z = 35, vị trí của R trong bảng tuần hoàn là
 Xem đáp án
Xem đáp án
Chọn A
Cấu hình electtron của R là
R có 4 lớp electron vậy R ở chu kỳ 4.
R có 7 electron lớp ngoài cùng, nguyên tố p, vậy R thuộc nhóm VIIA.
Câu 8:
Chu kỳ là tập hợp các nguyên tố, mà nguyên tử của chúng có cùng?
 Xem đáp án
Xem đáp án
Chọn C
Các nguyên tố có cùng số lớp electron được xếp thành 1 chu kỳ.
Câu 9:
Trong bảng tuần hoàn các nguyên tố, số chu kỳ nhỏ và chu kì lớn là
 Xem đáp án
Xem đáp án
Chọn C
Bảng tuần hoàn các nguyên tố hóa học gồm 3 chu kì nhỏ và 4 chu kì lớn
Câu 10:
Nguyên tố X thuộc chu kỳ 3, nhóm IIA trong bảng tuần hoàn. Ở trạng thái cơ bản, số lớp electron của X là?
 Xem đáp án
Xem đáp án
Chọn B
Số lớp electron của X bằng số thứ tự chu kỳ và bằng 3.
Câu 11:
Hợp chất khí với Hiđro của một nguyên tố là RH4. Oxit cao nhất của nó có chứa 53,33% oxi về khối lượng. Nguyên tố đó là
 Xem đáp án
Xem đáp án
Chọn B
Hợp chất khí với Hiđro của một nguyên tố là => R có hóa trị IV trong hợp chất khí với H. Hóa trị của R trong hợp chất oxit cao nhất là VIII - IV = IV => Oxit cao nhất là
→ R = 28
Vậy R là Si (Silic).
Câu 13:
Độ âm điện là
 Xem đáp án
Xem đáp án
Chọn D
Độ âm điện là đại lượng đặc trương cho khả năng hút electron của nguyên tử nguyên tử nguyên tố đó khi hình thành liên kết hóa học.
Câu 14:
Cấu hình electron của nguyên tử nguyên tố X là Số hiệu nguyên tử của X là?
 Xem đáp án
Xem đáp án
Chọn C
Số electron của X là 16 → Số hiệu nguyên tử X là 16.
Câu 15:
Nguyên tử khối trung bình của nguyên tố R là 79,91. R có 2 đồng vị. Biết chiếm 54,5%. Nguyên tử khối của đồng vị còn lại có giá trị là
 Xem đáp án
Xem đáp án
Chọn C
- Phần trăm của đồng vị còn lại là 100% - 54,5% = 45,5%
- Công thức tính nguyên tử khối trung bình:
Câu 16:
Nguyên tố hóa học là gì?
 Xem đáp án
Xem đáp án
Chọn B
Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
Câu 17:
Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là
 Xem đáp án
Xem đáp án
Chọn A
Gọi số proton, nơtron và electron trong X lần lượt là p, n và e.
Trong đó số p = số e.
-Tổng số hạt trong X bằng 40 nên 2p + n = 40 (1)
-Số hạt mang điện (p,e) nhiều hơn số hạt không mang điện (n) là 12 nên 2p –n =12 (2)
- Giải (1) và (2) thu được p =13 và n =14
Số khối A=13+14=27.
Câu 19:
Cation R+ có cấu hình e phân lớp ngoài cùng là . Liên kết giữa nguyên tử nguyên tố R với oxi thuộc loại liên kết gì?
 Xem đáp án
Xem đáp án
Chọn B
Cấu hình electron của R là → R là kim loại điển hình nhóm IA.
Liên kết hình thành giữa R (kim loại điển hình) và Oxi (phi kim điển hình) là liên kết ion.
Câu 20:
Nguyên tử các nguyên tố halogen được sắp xếp theo chiều bán kính nguyên tử giảm dần (từ trái sang phải) là
 Xem đáp án
Xem đáp án
Chọn D
Chiều giảm dần bán kính nguyên tử: I, Br, Cl, F.
Câu 21:
Phát biểu nào sau đây là không đúng?
 Xem đáp án
Xem đáp án
Chọn C
Oxit cao nhất của một nguyên tố ở nhóm VIIA luôn có công thức
Câu 25:
M là kim loại thuộc nhóm IIA. Hòa tan hết 10,8 gam hỗn hợp kim loại và muối cacbonat của nó trong dung dịch HCl, thu được 4,48 lít hỗn hợp khí A (đktc). Tỷ khối của A so với khí hiđro là 11,5. Kim loại M là
 Xem đáp án
Xem đáp án
Chọn B
Gọi số mol các chất trong hỗn hợp đầu: M = a mol;
Câu 27:
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là
 Xem đáp án
Xem đáp án
Chọn D
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8
→ X có 6 electron ở phân lớp 2p và 2 electron ở phân lớp 3p