Đề kiểm tra giữa học kì 1 Hóa học 10 có đáp án- Đề 1
-
791 lượt thi
-
33 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Nội dung nào dưới đây thuộc đối tượng nghiên cứu của Hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hóa học nghiên cứu về thành phần, cấu trúc, tính chất và sự biến đổi của chất cũng như ứng dụng của chúng.
⇒ Sự chuyển hóa thức ăn trong hệ tiêu hóa thuộc đối tượng nghiên cứu của Hóa học.
Câu 2:
Trong các hiện tượng sau đây hiện tượng nào là hiện tượng vật lí?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hòa tan đường vào nước, thu được dung dịch nước đường là hiện tượng vật lí vì không có sự tạo thành chất mới.
Câu 3:
Khi nghiên cứu thành phần hóa học và bước đầu ứng dụng tinh dầu tràm trà trong sản xuất nước súc miệng, các nhà nghiên cứu đã đặt ra giả thuyết: “Tinh dầu tràm trà có khả năng kháng khuẩn”. Bước đặt giả thuyết này ứng với bước nào trong phương pháp nghiên cứu hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Bước đặt giả thuyết: “Tinh dầu tràm trà có khả năng kháng khuẩn” ứng với bước nêu giả thuyết khoa học trong phương pháp nghiên cứu hóa học.
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phương pháp nghiên cứu thực nghiệm là nghiên cứu vấn đề dựa trên kết quả thí nghiệm, khảo sát, thu thập số liệu, phân tích, định lượng …
Câu 5:
Hạt mang điện trong hạt nhân nguyên tử là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hạt nhân nguyên tử gồm hai loại hạt là proton và neutron. Trong đó, proton mang điện tích dương còn neutron không mang điện.
Câu 6:
Nhận định nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phát biểu D không đúng, do nguyên tử hydrogen không có neutron trong hạt nhân.
Câu 7:
Hạt nhân của nguyên tử X có điện tích là +30,438.10-19 coulomb. Vậy nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Số proton có trong hạt nhân nguyên tử X là:
(hạt)
Vậy X là K (potassium).
Câu 8:
Nguyên tử alminium (kí hiệu: Al) có số hạt mang điện tích dương là 13, số hạt không mang điện là 14. Số hạt electron trong Al là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hạt mang điện tích dương trong nguyên tử là hạt proton.
Nguyên tử Al có số electron = số proton = 13 (hạt).
Câu 9:
Nếu hạt nhân nguyên tử có Z hạt proton thì
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phát biểu A sai vì số đơn vị điện tích hạt nhân là Z.
Phát biểu B sai vì điện tích hạt nhân là +Z.
Phát biểu C sai vì số hạt neutron N = A – Z.
Phát biểu D đúng vì số hạt mang điện trong nguyên tử là P + E = 2Z.
Câu 10:
Nguyên tử trung hòa về điện vì
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tử trung hòa về điện vì có tổng số hạt proton bằng tổng số hạt electron hay số đơn vị điện tích dương của hạt nhân bằng số đơn vị điện tích âm của các electron trong nguyên tử.
Câu 11:
Đặc điểm của hạt electron là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hạt electron mang điện tích âm và có khối lượng.
Câu 12:
Nguyên tố hóa học là tập hợp các nguyên tử có cùng
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tố hóa học là tập hợp các nguyên tử có cùng điện tích hạt nhân.
Câu 13:
Nguyên tử có
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Dựa vào kí hiệu nguyên tử Al ta có:
+ Số proton = số electron = số hiệu nguyên tử (Z) = 13.
+ Số neutron = số khối (A) – số hiệu nguyên tử (Z) = 27 – 13 = 14 (hạt).
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các nguyên tử thuộc cùng một nguyên tố hoá học do có cùng số đơn vị điện tích hạt nhân là 8.
Câu 15:
Nhận định nào không đúng? Hai nguyên tử và
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tử có số neutron là: 63 – 29 = 34.
Nguyên tử có số neutron là: 65 – 29 = 36.
Câu 16:
Trong tự nhiên, bromine có hai đồng vị bền là chiếm 50,69% số nguyên tử và chiếm 49,31% số nguyên tử. Nguyên tử khối trung bình của bromine là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 17:
Hình ảnh dưới đây là hình dạng của những loại orbital nguyên tử nào?
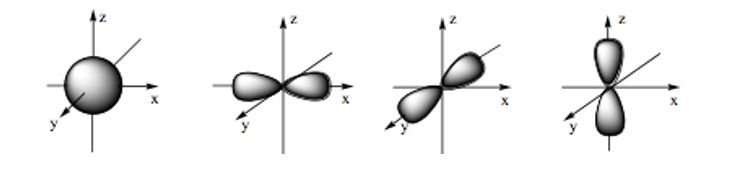
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
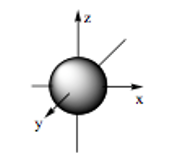
- Orbital s có dạng hình cầu:
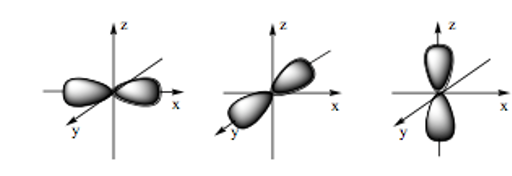
- Orbital p có dạng hình số tám nổi:
Câu 18:
Số electron tối đa ở lớp thứ n (n ≤ 4) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số electron tối đa trong lớp n là 2n2 (n ≤ 4).
Câu 19:
Electron thuộc lớp nào sau đây liên kết chặt chẽ nhất với hạt nhân?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Lớp K gần hạt nhân nhất, liên kết chặt chẽ với hạt nhân nhất.
Câu 20:
Nguyên tử nào sau đây có 3 electron ở lớp ngoài cùng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
N (Z = 7): 1s22s22p3 ⇒ N có 5 electron ở lớp ngoài cùng.
Na (Z = 11): [Ne]3s1 ⇒ Na có 1 electron ở lớp ngoài cùng.
Al (Z = 13): [Ne]3s23p1 ⇒ Al có 3 electron ở lớp ngoài cùng.
C (Z = 6): 1s22s22p2 ⇒ C có 4 electron ở lớp ngoài cùng.
Câu 21:
Sự phân bố electron theo ô orbital nào dưới đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trường hợp A và D sai do 2 electron trong cùng một AO phải có chiều tự quay ngược nhau.
Trường hợp C sai do trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa.
Câu 22:
Trong bảng tuần hoàn hiện nay, các nguyên tố được sắp xếp không theo nguyên tắc nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn hiện nay:
+ Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một chu kì.
+ Các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau được xếp cùng một nhóm.
Câu 23:
Một nguyên tố hóa học X ở chu kì 3, nhóm IVA. Cấu hình electron của nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
X ở chu kì 3 nên có 3 lớp electron; X thuộc nhóm IVA nên có 4 electron ở lớp ngoài cùng.
Cấu hình electron nguyên tử X: 1s22s22p63s23p2.
Câu 24:
Hầu hết các chu kì trong bảng tuần hoàn các nguyên tố hóa học đều bắt đầu bằng
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hầu hết các chu kì trong bảng tuần hoàn các nguyên tố hóa học đều bắt đầu bằng kim loại kiềm (trừ chu kì 1).
Câu 25:
Bảng tuần hoàn hiện nay có số cột là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Bảng tuần hoàn hiện nay gồm có 18 cột, chia thành 8 nhóm A và 8 nhóm B (riêng nhóm VIIIB có 3 cột).
Câu 26:
Các nguyên tố thuộc cùng một nhóm A trong bảng tuần hoàn sẽ có cùng
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các nguyên tố thuộc cùng một nhóm A trong bảng tuần hoàn sẽ có cùng số electron hóa trị.
Câu 27:
Cho biết cấu hình electron nguyên tử của các nguyên tố X: 1s22s22p63s2; Y: 1s22s22p63s23p64s1; Z: 1s22s22p63s23p5. Nguyên tố nào là kim loại?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
X: 1s22s22p63s2 là kim loại do có 2 electron ở lớp ngoài cùng.
Y: 1s22s22p63s23p64s1 là kim loại do có 1 electron ở lớp ngoài cùng.
Z: 1s22s22p63s23p5 là phi kim do có 7 electron ở lớp ngoài cùng.
Câu 28:
Nguyên tử nguyên tố X có tổng các electron trên phân lớp p là 9. Vậy X thuộc loại nguyên tố nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
X có tổng các electron trên phân lớp p là 9 nên cấu hình electron của X như sau:
1s22s22p63s23p3.
Vậy X thuộc nguyên tố p.
Câu 29:
Iron (hay sắt, kí hiệu Fe) là kim loại được sử dụng phổ biến trong các ngành xây dựng hoặc sản xuất đồ gia dụng. Hạt nhân của nguyên tử iron có điện tích bằng +26 và số khối bằng 56.
a) Tính số proton, số neutron và số electron có trong nguyên tử iron.
 Xem đáp án
Xem đáp án
a) Hạt nhân của nguyên tử iron có điện tích bằng +26 và số khối bằng 56 ⇒ Nguyên tử iron có:
+ Số proton = số electron = 26.
+ Số neutron = 56 – 26 = 30.
Câu 31:
Viết cấu hình electron nguyên tử của các nguyên tố: aluminium (Z = 13); phosphorus (Z = 15) và biểu diễn cấu hình electron của chúng theo ô orbital. Từ đó, xác định số electron độc thân của mỗi nguyên tử này.
 Xem đáp án
Xem đáp án
+ Cấu hình electron nguyên tử aluminium (Al): 1s22s22p63s23p1
Cấu hình electron aluminium theo ô orbital:
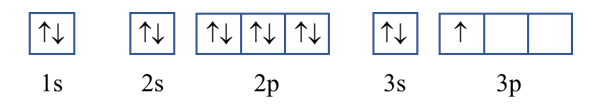
Số electron độc thân của nguyên tử Al: 1 electron.
+ Cấu hình electron nguyên tử phosphorus (P):1s22s22p63s23p3
Cấu hình electron phosphorus theo ô orbital:
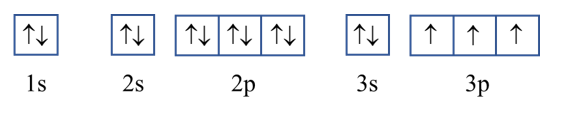
Số electron độc thân của nguyên tử P: 3 electron.
Câu 32:
Phosphorus (P) được dùng vào mục đích quân sự như sản xuất bom, đạn cháy, đạn khói. Biết tổng số hạt trong nguyên tử P là 46, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14 hạt.
a) Xác định vị trí phosphorus trong bảng tuần hoàn (có giải thích ngắn gọn cách xác định).
 Xem đáp án
Xem đáp án
a) Gọi số proton, neutron và electron có trong nguyên tử P lần lượt là: P, N và E.
(Trong đó: P = E)
Theo bài ra ta có hệ phương trình:
⇒ Số hiệu nguyên tử P (Z) = số proton = số electron = 15.
Cấu hình electron nguyên tử P: 1s22s22p63s23p3, vậy P ở:
+ Số thứ tự ô 15 (do Z = 15);
+ Chu kì 3 (do có 3 lớp electron);
+ Nhóm VA (do có 5 electron hóa trị, nguyên tố p).
Câu 33:
b) Phân loại nguyên tố P dựa vào cấu hình electron và tính chất hóa học.
 Xem đáp án
Xem đáp án
b) Dựa vào cấu hình electron xác định được P là nguyên tố p, có tính phi kim (do cấu hình electron lớp ngoài cùng 3s23p3).
