Đề kiểm tra giữa học kì 1 Hóa học 10 có đáp án- Đề 2
-
784 lượt thi
-
32 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Nội dung nào dưới đây thuộc không đối tượng nghiên cứu của Hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hóa học nghiên cứu về thành phần, cấu trúc, tính chất và sự biến đổi của chất cũng như ứng dụng của chúng.
Vậy sự vận chuyển của máu trong hệ tuần hoàn không thuộc đối tượng nghiên cứu của hóa học.
Câu 2:
Một loại nến được làm bằng paraffin, khi đốt nến, xảy ra các quá trình sau:
(1) Paraffin nóng chảy;
(2) Paraffin lỏng chuyển thành hơi;
(3) Hơi paraffin cháy biến đổi thành khí CO2 và hơi nước.
Quá trình nào có sự biến đổi hoá học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Quá trình (3) có sự biến đổi hóa học do có sự tạo thành chất mới là CO2 và nước.
Câu 3:
Khi nghiên cứu thành phần hóa học và bước đầu ứng dụng tinh dầu tràm trà trong sản xuất nước súc miệng, các nhà nghiên cứu đã tiến hành: “Nghiên cứu thành phần hóa học, ứng dụng của tinh dầu tràm trà làm nước súc miệng qua các công trình khoa học trên các tạp chí đã được xuất bản”. Bước làm này ứng với bước nào trong phương pháp nghiên cứu hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Bước “nghiên cứu thành phần hóa học, ứng dụng của tinh dầu tràm trà làm nước súc miệng qua các công trình khoa học trên các tạp chí đã được xuất bản” ứng với bước xác định vấn đề nghiên cứu trong phương pháp nghiên cứu hóa học.
Câu 4:
Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hạt nhân của hầu hết các nguyên tử được cấu tạo nên bởi các hạt proton và neutron.
Câu 5:
Trong nguyên tử, loại hạt có khối lượng và mang điện tích âm là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Trong nguyên tử tồn tại một loại hạt có khối lượng và mang điện tích âm là electron.
Câu 6:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phát biểu C không đúng vì tất cả các nguyên tử đều có proton trong hạt nhân.
Câu 7:
Nguyên tử fluorine (kí hiệu là: F) có 9 proton, 9 electron và 10 neutron. Điện tích hạt nhân nguyên tử F là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nguyên tử fluorine (kí hiệu là: F) có 9 proton nên điện tích hạt nhân nguyên tử fluorine là +9.
Câu 8:
Hạt nhân nguyên tử X có điện tích là +17,622.10-19 coulomb. Vậy nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số proton có trong nguyên tử X là:
X có số hiệu nguyên tử = số proton = 11. Vậy X là Na.
Câu 9:
Thành phần nào bị lệch hướng trong trường điện?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Electron mang điện tích âm nên bị lệch hướng trong trường điện.
Câu 10:
Nguyên tử X có 26 proton trong hạt nhân. Cho các phát biểu sau về X:
(1) X có 26 neutron trong hạt nhân.
(2) X có 26 electron ở vỏ nguyên tử.
(3) X có điện tích hạt nhân là + 26.
(4) Khối lượng nguyên tử X là 26 amu.
Trong các phát biểu trên, số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các phát biểu (2), (3) đúng.
Phát biểu (1) sai vì chỉ dựa vào số proton chưa thể xác định được số neutron.
Phát biểu (4) sai vì khối lượng nguyên tử xấp xỉ số khối A = Z + N > 26 amu.
Câu 11:
Số hiệu nguyên tử cho biết
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Số hiệu nguyên tử (Z) = số proton = số electron = số đơn vị điện tích hạt nhân nguyên tử.
Câu 12:
Một nguyên tử X gồm 16 proton, 16 electron và 16 neutron. Nguyên tử X có kí hiệu là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tử X có:
+ Số hiệu nguyên tử (Z) = số proton = 16.
+ Số khối (A) = số proton + số neutron = 16 + 16 = 32.
Kí hiệu nguyên tử là: .
Câu 13:
Số hạt mang điện trong nguyên tử là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Li có:
+ Số hiệu nguyên tử (Z) = 3 = số proton = số electron.
+ Số hạt mang điện = số proton + số electron = 2Z = 6.
Câu 14:
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số neutron.
Câu 15:
Thông tin nào sau đây không đúng về ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Dựa vào kí hiệu nguyên tử xác định được, Pb có:
+ Số đơn vị điện tích hạt nhân = số proton = số electron = số hiệu nguyên tử (Z) = 82.
+ Số khối (A) = 206.
+ Số neutron = A – Z = 206 – 82 = 124.
Câu 16:
Nguyên tử khối trung bình của nguyên tố X là 35,48. Biết trong tự nhiên, X có hai đồng vị, trong đó đồng vị 35X chiếm 75,77% số nguyên tử. Số khối của đồng vị còn lại là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Gọi số khối của đồng vị thứ 2 là A, áp dụng công thức ta có:
Câu 17:
Orbital nguyên tử là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt (xác suất tìm thấy) electron khoảng 90% gọi là orbital nguyên tử.
Câu 19:
Số electron tối đa trong phân lớp 3p là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Số electron tối đa trong phân lớp 3p là 6.
Câu 20:
Cấu hình electron nguyên tử nitrogen (Z = 7) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron nguyên tử nitrogen (Z = 7): 1s22s22p3.
Câu 21:
Cho cấu hình electron nguyên tử của các nguyên tố sau:
X: 1s22s22p63s2;
Y: 1s22s22p63s23p64s1;
Z: 1s22s22p63s23p3;
T: 1s22s22p63s23p63d84s2.
Các nguyên tử của nguyên tố kim loại là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
+ X và T có 2 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố kim loại.
+ Y có 1 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố kim loại.
+ Z có 5 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố phi kim.
Câu 22:
Lớp M có số electron tối đa bằng
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Lớp M (n = 3) có số electron tối đa là 2.32 = 18.
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Mendeleev đã xây dựng bảng tuần hoàn bằng cách sắp xếp các nguyên tố theo chiều tăng dần của khối lượng nguyên tử.

Câu 24:
Trong bảng hệ thống tuần hoàn, chu kì là dãy các nguyên tố mà
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là chu kì.
Câu 25:
Trong bảng hệ thống tuần hoàn các nguyên tố hóa học hiện nay, số chu kì nhỏ và chu kì lớn là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Bảng tuần hoàn hiện nay gồm có 7 chu kì:
+ Các chu kì 1, 2 và 3 là các chu kì nhỏ;
+ Các chu kì 4, 5, 6 và 7 là các chu kì lớn.
Câu 26:
Chu kì 3 của bảng hệ thống tuần hoàn có
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Chu kì 3 của bảng tuần hoàn có 8 nguyên tố.
Câu 27:
Nguyên tố X có cấu hình electron 1s22s22p63s23p64s1 thuộc
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Dựa vào cấu hình electron xác định được nguyên tố X ở ô thứ 19 (do số hiệu nguyên tử = số electron = 19), chu kì 4 (do có 4 lớp electron), nhóm IA (do 1 electron hóa trị, nguyên tố s).
Câu 28:
Trong bảng tuần hoàn, nguyên tố chlorine (kí hiệu: Cl) nằm ở chu kì 3, nhóm VIIA. Cấu hình electron của Cl là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nguyên tử Cl nằm ở chu kì 3 nên có số lớp e = số thứ tự chu kì = 3.
Nguyên tử Cl thuộc nhóm VIIA nên có cấu hình electron lớp ngoài cùng là ns2np5 (có 7 electron lớp ngoài cùng).
Vậy cấu hình electron của Cl là 1s22s22p63s23p5.
Câu 29:
Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt.
a) Xác định thành phần cấu tạo của nguyên tử X.
 Xem đáp án
Xem đáp án
a) Gọi P, N và E lần lượt là số proton, neutron và electron của X. Trong đó P = E.
Theo bài ra, ta có hệ phương trình:
Vậy trong X có 17 proton; 17 electron và 18 neutron.
Câu 30:
b) Viết cấu tạo nguyên tử X.
 Xem đáp án
Xem đáp án
b) X có:
+ Số hiệu nguyên tử (Z) = số proton = 17.
+ Số khối (A) = số proton + số neutron = 17 + 18 = 35.
Vậy kí hiệu nguyên tử X là:
Câu 31:
Viết cấu hình electron dưới dạng ô lượng tử của các nguyên tử và . Hãy cho biết các nguyên tố này là kim loại, phi kim hay khí hiếm.
 Xem đáp án
Xem đáp án
+ :
Dựa vào kí hiệu nguyên tử xác định được số hiệu nguyên tử Mg là 12.
Cấu hình electron nguyên tử Mg: 1s22s22p63s2.
Cấu hình electron Mg theo ô orbital:
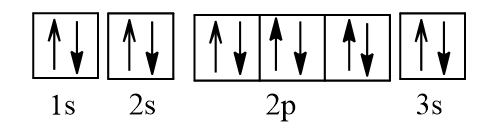
Mg là kim loại do có 2 electron ở lớp ngoài cùng.
+ :
Dựa vào kí hiệu nguyên tử xác định được số hiệu nguyên tử Ca là 20.
Cấu hình electron nguyên tử Ca: 1s22s22p63s23p64s2.
Cấu hình electron Ca theo ô orbital:
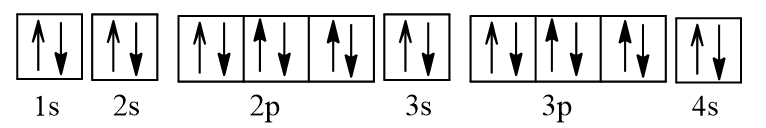
Ca là kim loại do có 2 electron ở lớp ngoài cùng.
Câu 32:
Hai nguyên tố X và Y đứng kế tiếp nhau trong cùng một chu kì, có tổng số điện tích hạt nhân bằng 25. Biết ZX < ZY, xác định vị trí của X, Y trong bảng tuần hoàn, có giải thích ngắn gọn cách xác định.
 Xem đáp án
Xem đáp án
X và Y đứng kế tiếp nhau trong cùng một chu kì nên số đơn vị điện tích hạt nhân của chúng chỉ khác nhau 1 đơn vị.
Do ZX < ZY, ta có ZY = ZX + 1 (1)
Theo bài ra, tổng số điện tích hạt nhân của X và Y là 25 nên:
ZX + ZY = 25 (2)
Từ (1) và (2) giải hệ phương trình có ZX = 12 và ZY = 13.
+ Cấu hình electron của X là: 1s22s22p63s2.
Vậy X ở ô thứ 12 (do Z = 12); chu kì 3 (do có 3 lớp electron); nhóm IIA (do nguyên tố s, 2 electron hóa trị).
+ Cấu hình electron của Y là: 1s22s22p63s23p1.
Vậy Y ở ô thứ 13 (do Z = 13); chu kì 3 (do có 3 lớp electron); nhóm IIIA (do nguyên tố p, 3 electron hóa trị).
