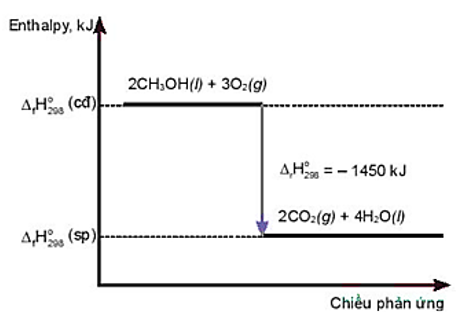
Đề kiểm tra Giữa học kì 2 Hóa 10 Chân trời sáng tạo có đáp án- Đề 1
-
1633 lượt thi
-
32 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Phản ứng hoá học xảy ra trong thí nghiệm nào sau đây là phản ứng oxi hoá – khử?
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 6:
Cho các hợp chất sau: FeO; FeCl2; Fe(OH)3; Fe2O3; FeSO4. Số hợp chất trong đó sắt có số oxi hoá +2 là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 7:
Cho phương trình hoá học sau: 2H2S + 3O2 → 2SO2 + 2H2O. Chất khử trong phương trình hoá học là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 9:
Copper(II) oxide (CuO) bị khử bởi ammonia (NH3) theo phản ứng sau:
Tổng hệ số cân bằng (tối giản) của phản ứng là?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 10:
Nguyên tử carbon trong trường hợp nào sau đây vừa thể hiện tính khử, vừa thể hiện tính oxi hoá khi tham gia phản ứng hoá học?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 11:
Cho các phản ứng sau:
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O.
(b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O.
(d) 2HCl + Zn → ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 2. B. 3.
C. 1. D. 4.
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 12:
Cho 6,4 gram Cu tác dụng hết với lượng dư dung dịch H2SO4 đặc, nóng thu được V lít khí SO2 ở điều kiện chuẩn. Giá trị của V là
 Xem đáp án
Xem đáp án
Cu + 2H2SO4 (đặc) CuSO4 + SO2 + 2H2O
Theo PTHH có:
Vậy V = 0,1 × 24,79 = 2,479 (lít).
Câu 13:
Cho đinh sắt vào ống nghiệm chứa 3 ml HCl, sắt phản ứng với HCl theo phương trình hoá học sau: Fe + 2HCl → FeCl2 + H2. Nhận xét nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 14:
Cho phương trình hóa học: aAl + bH2SO4 → cAl2(SO4)3 + dSO2 + eH2O.
Tỉ lệ a : b là
 Xem đáp án
Xem đáp án
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Vậy tỉ lệ a : b = 2 : 6 = 1 : 3.
Câu 15:
Cho các phản ứng sau:
(a) Phản ứng nhiệt phân Cu(OH)2 tạo thành CuO.
(b) Phản ứng trung hoà (acid tác dụng với base).
(c) Phản ứng nung clinker xi măng.
(d) Phản ứng oxi hoá glucose trong cơ thể.
Số phản ứng thu nhiệt là
 Xem đáp án
Xem đáp án
Phản ứng toả nhiệt: (b) và (d).
Câu 16:
Cho phản ứng sau:
2H2(g) + O2(g) → 2H2O(g)
Enthalpy tạo thành chuẩn của H2O(g) là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 17:
Cho các phản ứng sau:
(a) C(s) + O2(g) → CO2(g)
(b)
(c) CH4(g) + H2O(l) → CO(g) + 3H2(g)
(d) H2(g) + Cl2(g) → 2HCl(g)
Số phản ứng toả nhiệt là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 19:
Nhiệt kèm theo (nhiệt lượng toả ra hay thu vào) của một phản ứng hoá học ở áp suất không đổi (và thường ở một nhiệt độ xác định) gọi là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 20:
Cho phản ứng hoá học sau: 2Na(s) + Cl2(g) → 2NaCl(s). Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 21:
Cho phản ứng sau: CaCO3(s) → CaO(s) + CO2(g).
Ở điều kiện chuẩn, biến thiên enthalpy của phản ứng là (Biết nhiệt tạo thành (kJ/mol) của CaCO3, CaO và CO2 lần lượt là -1 207, -635 và -393,5)
 Xem đáp án
Xem đáp án
CaCO3(s) → CaO(g) + CO2(g)
= (CaO) + (CO2) - (CaCO3)
= (-635) + (-393,5) – (-1207) = +178,5 (kJ).
Câu 22:
Cho các phát biểu sau:
(a). Tất cả các phản ứng cháy đều toả nhiệt.
(b). Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(c). Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều toả nhiệt.
(d). Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
(e). Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng.
(g). Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,...) là những ví dụ về phản ứng thu nhiệt vì cần phải khơi mào.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Phát biểu đúng là: (a), (b), (d).
Câu 24:
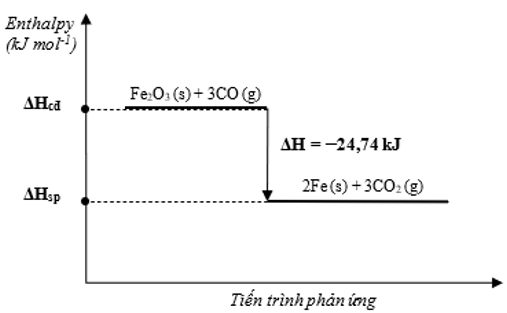
Phản ứng luyện gang trong lò cao xảy ra theo sơ đồ sau:
Fe2O3(s) + CO(g) Fe(s) + CO2(g)
Từ 1 mol Fe2O3 và 1 mol CO, giả sử chỉ xảy ra phản ứng theo sơ đồ trên với hiệu suất 100% thì giải phóng một lượng nhiệt là (Biết nhiệt tạo thành chuẩn của Fe2O3; CO; Fe; CO2 (kJ/ mol) lần lượt là -824,2; -110,5; 0 và -393,5)
 Xem đáp án
Xem đáp án
Phương trình hóa học: Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Biến thiên enthalpy chuẩn của phản ứng:
Theo phương trình hóa học ta có CO hết, Fe2O3 dư, tính toán theo mol CO.
Từ 1 mol Fe2O3 và 1 mol CO, giả sử chỉ xảy ra phản ứng (1) với hiệu suất 100% thì giải phóng một lượng nhiệt là
Câu 25:
Cho phản ứng hóa học sau: CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g). Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 26:
Cho phản ứng sau: H2(g) + Cl2(g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng là
Biết: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/ mol.
 Xem đáp án
Xem đáp án
Biến thiên enthalpy chuẩn của phản ứng là:
Câu 29:
Trong phòng thí nghiệm, khí chlorine có thể được điều chế bằng cách cho MnO2 tác dụng với HCl đặc, đun nóng. Phản ứng hoá học xảy ra theo sơ đồ sau:
MnO2 + HCl MnCl2 + Cl2 + H2O
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron và chỉ rõ chất khử, chất oxi hoá.
 Xem đáp án
Xem đáp án
a)
Chất khử: HCl; chất oxi hoá: MnO2.
Ta có các quá trình:
Phương trình hoá học:
MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
Câu 30:
b) Giả sử hiệu suất phản ứng đạt 100%. Tính khối lượng MnO2 cần dùng để thu được 2,479 lít khí Cl2 ở điều kiện chuẩn.
 Xem đáp án
Xem đáp án
b) Theo phương trình hoá học ta có:
Khối lượng MnO2 cần dùng là: 0,1.87 = 8,7 (gam).
Câu 32:
Cho phản ứng sau: CH≡CH(g) + H2(g) → CH3-CH3(g)
Biết năng lượng liên kết (kJ/ mol) ở điều kiện chuẩn của H-H là 436, của C-C là 347, của C-H là 414 và của C≡C là 839. Hãy cho biết ở điều kiện chuẩn phản ứng thu nhiệt hay tỏa nhiệt?
 Xem đáp án
Xem đáp án
= 2E(C-H) + E(C≡C) + 2E(H-H) – 6E(C-H) – E(C-C)
= (2.414) + 839 + (2.436) – (6.414) – 347 = -292 (kJ/mol) < 0
⇒ Phản ứng tỏa nhiệt.