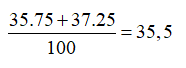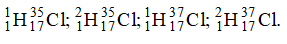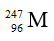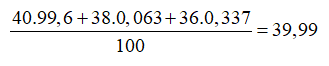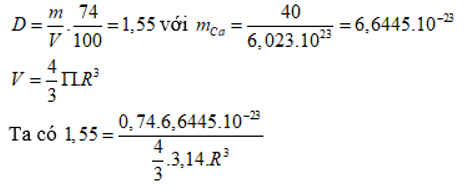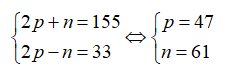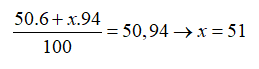Đề thi giữa kì 1 Hóa 10 có đáp án (Bài số 1 - Đề 2)
-
6883 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Cho nguyên tố X, nguyên tử của nó có cấu hình electron là: X thuộc nguyên tố
 Xem đáp án
Xem đáp án
Chọn C
Theo trật tự phân mức năng lượng, electron cuối cùng được điền vào phân lớp d.
X thuộc nguyên tố d.
Câu 3:
Trong tự nhiên, Clo có 2 đồng vị và , trong đó đồng vị chiếm 75% về số đồng vị. Nguyên tử khối trung bình của Cl là
 Xem đáp án
Xem đáp án
Chọn B
Nguyên tử khối trung bình của Cl là :
Câu 4:
Có các đồng vị sau . Có thể tạo ra số phân tử hiđroclorua HCl là
 Xem đáp án
Xem đáp án
Chọn C
Có thể tạo ra các phân tử là:
Câu 5:
Các electron của nguyên tử nguyên tố R được phân bố trên 4 lớp, lớp ngoài cùng có 2 electron, số phân lớp có chứa electron của R là 6. Số đơn vị điện tích hạt nhân nguyên tử của nguyên tố R có thể là giá trị nào
 Xem đáp án
Xem đáp án
Chọn D
Cấu hình electron của R là:
→ Số đơn vị điện tích hạt nhân của R bằng số electron = 20.
Câu 6:
Nguyên tử của nguyên tố A có tổng số electron ở các phân lớp p là 9. Nguyên tố A là
 Xem đáp án
Xem đáp án
Chọn A
Cấu hình electron nguyên tử A là: → A là P.
Câu 7:
Một nguyên tử M có 96 proton, 151 nơtron. Kí hiệu nguyên tử M là
 Xem đáp án
Xem đáp án
Chọn A
Số khối của M là A = 96 + 151 = 247.
Số hiệu nguyên tử M là z = số p = 96.
Kí hiệu nguyên tử M là:
Câu 8:
Cho 3 nguyên tử: . Các nguyên tử nào là đồng vị của nhau?
 Xem đáp án
Xem đáp án
Chọn B
Y và Z có cùng số p là 12 nên là đồng vị của nhau.
Câu 9:
Argon tách ra từ không khí là hỗn hợp của 3 đồng vị: (99,6%); (0,063%); (0,337%). Nguyên tử khối trung bình của Ar là
 Xem đáp án
Xem đáp án
Chọn A
Nguyên tử khối trung bình của Ar là:
Câu 10:
Tổng số khối của 2 đồng vị X, Y là 72 trong đó có 38 hạt không mang điện. X, Y là các đồng vị của nguyên tố
 Xem đáp án
Xem đáp án
Chọn A
Gọi số proton và nơtron của X là và ; proton và nơtron của Y là và .
Trong đó
Theo bài ra ta có:
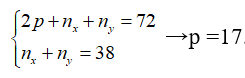
Vậy X và Y là đồng vị của Cl.
Câu 13:
Cation có cấu hình electron ở phân lớp ngoài cùng là . Kết luận sai là
 Xem đáp án
Xem đáp án
Chọn C
Cấu hình electron của ion X+ là
→ Cấu hình electron của X là:
X có 1 electron lớp ngoài cùng nên là nguyên tử của nguyên tố kim loại.
Câu 14:
Nguyên tử M có 7 electron ở phân lớp 3d. Số hạt mang điện của nguyên tử M là
 Xem đáp án
Xem đáp án
Chọn B
Cấu hình electron nguyên tử M là:
→Trong M, Số electron = số proton = 27.
Số hạt mang điện của M là 27.2 = 54.
Câu 15:
Các phân lớp có trong lớp M là
 Xem đáp án
Xem đáp án
Chọn A
Lớp M là lớp thứ 3. Các phân lớp có trong lớp thứ 3 là: 3s; 3p; 3d.
Câu 16:
Khối lượng riêng của kim loại canxi là . Khối lượng mol của nguyên tử canxi là 40 g/mol. Trong tinh thể canxi, các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính nguyên tử canxi tính theo lí thuyết là
 Xem đáp án
Xem đáp án
Chọn A
→ R = 1,96.10-8 (cm) = 0,196nm.
Câu 18:
Tổng số hạt của nguyên tử X là 155. Số hạt mang điện nhiều hơn số hạt không mang điện là 33. Số khối của nguyên tử X là
 Xem đáp án
Xem đáp án
Chọn D
Gọi số hạt proton, nơtron và electron trong X lần lượt là: p, n và e.
Theo bài ra ta có:
Số khối của X là 47 + 61 = 108.
Câu 19:
Trong nguyên tử có số hạt mang điện nhiều hơn số hạt không mang điện là
 Xem đáp án
Xem đáp án
Chọn D
Số hạt mang điện trong Al = số p + số e = 2z = 13.2 =26.
Số hạt không mang điện trong Al = số nơtron = A – z = 27 – 13 = 14.
Số hạt mang điện nhiều hơn số hạt không mang điện là 26 – 14 = 12.
Câu 20:
Nguyên tử photpho có 15 proton, 16 nơtron và 15 electron, khối lượng của 1 nguyên tử photpho là
 Xem đáp án
Xem đáp án
Chọn A
Khối lượng P là 15u + 16u + 15. 0,00055u = 31u.
Câu 21:
Cho nguyên tử . Trong nguyên tử Ca có:
 Xem đáp án
Xem đáp án
Chọn D
Số p = số e = z = 20.
Số n = A – z = 40 – 20 = 20.
Câu 22:
Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
 Xem đáp án
Xem đáp án
Chọn D
Câu 23:
Cấu hình electron nào sau đây là của nguyên tố kim loại
 Xem đáp án
Xem đáp án
Chọn A
Nguyên tử có 1,2,3 electron lớp ngoài cùng là nguyên tử của nguyên tố kim loại trừ H, He, Bo.
A. → 2 e lớp ngoài cùng → là kim loại.
C. → 2 e lớp ngoài cùng, chu kỳ 1 → là khí hiếm He.
Câu 25:
Y là nguyên tố d có 4 lớp electron và có 3 electron ở mức năng lượng cao nhất. Số hiệu nguyên tử của nguyên tố Y là
 Xem đáp án
Xem đáp án
Chọn C
Cấu hình electron của Y là
→ Số electron của Y là 23 → Số hiệu nguyên tử Y là 23.
Câu 26:
Nguyên tử khối trung bình của Vanadi (V) là 50,94. V có hai đồng vị, trong đó chiếm 6%. Số khối đồng vị thứ hai là
 Xem đáp án
Xem đáp án
Chọn B
Gọi số khối của đồng vị thứ 2 là x. Ta có:
Câu 27:
Số electron tối đa trong lớp 2 là
 Xem đáp án
Xem đáp án
Chọn A
Số electron tối đa trong lớp thứ 2 là 2.22 = 8.
Câu 28:
Cho kí hiệu nguyên tử . Phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn C
Từ kí hiệu nguyên tử xác đinh được số khối A = 39, số p = số e = z = 19.
A sai vì số hạt mang điện trong hạt nhân = số p = 19.
B sai vì số hiệu nguyên tử = 19.
C đúng vì cấu hình electron của là → có 3 lớp e.
D sai vì số n = 39 – 19 = 20 hơn số proton là 1.
Câu 29:
Trong các cấu hình electron dưới đây cấu hình không đúng là
 Xem đáp án
Xem đáp án
Chọn C
Phân lớp 3p chưa bão hòa.
Câu 30:
Một ion có 18 electron và 19 protron mang điện tích là
 Xem đáp án
Xem đáp án
Chọn B
Ion có số proton lớn hơn số electron nên mang điện tích dương.
Số đơn vị điện tích của ion là 19 – 18 = 1.
Vậy điện tích của ion là 1+.