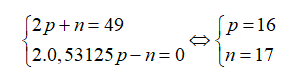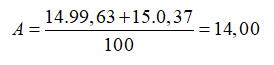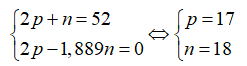Đề thi Hóa học 10 Giữa học kì 1 biên soạn (Đề 3)
-
3154 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 3:
Nguyên tử có số e là 13 thì cấu hình lớp ngoài cùng là
 Xem đáp án
Xem đáp án
Đáp án D
Cấu hình electron của nguyên tử đó là: [Ne].
→ Cấu hình electron lớp ngoài cùng là: 3s23p1.
Câu 4:
Trong nguyên tử X các e được phân bố trên 3 lớp, lớp thứ 3 có 8e. Điện tích hạt nhân của nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án C
Cấu hình electron của X là:
Số hiệu nguyên tử X = số electron = 18.
Điện tích hạt nhân X là 18+.
Câu 6:
Có bao nhiêu electron trong ion ?
 Xem đáp án
Xem đáp án
Đáp án A
Crom có p = e = 24 hạt, có e = 21 (do Cr3+ đã nhường 3 e).
Câu 7:
Nguyên tử M có cấu hình ở phân mức năng lượng cao nhất là . Tổng số e trong nguyên tử M là
 Xem đáp án
Xem đáp án
Đáp án B
Cấu hình electron của M là:
→ Tổng số electron của nguyên tử M là 27.
Câu 9:
Kí hiệu nào trong số các kí hiệu của các phân lớp sau là sai?
 Xem đáp án
Xem đáp án
Đáp án A
Không có phân lớp 2d.
Câu 10:
A có điện tích hạt nhân là 25. Vậy A là?
 Xem đáp án
Xem đáp án
Đáp án A
Trật tự phân mức năng lượng:
Electron cuối cùng được điền vào phân lớp d theo trật tự phân mức năng lượng. Vậy A là nguyên tố d.
Câu 11:
Trong tự nhiên H có 3 đồng vị: . Oxi có 3 đồng vị . Hỏi có bao nhiêu loại phân tử được tạo thành từ các loại đồng vị trên?
 Xem đáp án
Xem đáp án
Đáp án C
- Với có thể tạo nên các phân tử nước với 3 đồng vị của H là:
; ; ; ; ; .
- Với có thể tạo nên các phân tử nước với 3 đồng vị của H là:
; ; ; ; ; .
- Với có thể tạo nên các phân tử nước với 3 đồng vị của H là:
; ; ; ; ; .
Câu 12:
Cho số hiệu nguyên tử của cacbon, nitơ, oxi và flo lần lượt là 6, 7, 8, 9 và số khối của chúng lần lượt là 12, 14, 16, 19. Xét kí hiệu nào sau đây viết sai?
 Xem đáp án
Xem đáp án
Đáp án D
Kí hiệu đúng là .
Câu 14:
Cho 2 kí hiệu nguyên tử: và , chọn câu trả lời đúng
 Xem đáp án
Xem đáp án
Đáp án D
A sai vì điện tích của hạt nhân A là , điện tích của hạt nhân B là .
B sai vì A có 11 electron và B có 12 electron.
C sai vì A và B có số proton khác nhau nên không là đồng vị của nhau.
Câu 16:
Nguyên tử của nguyên tố A có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố B có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của A là 8. Số đơn vị điện tích hạt nhân của A và B là
 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình electron của A là
→ Số đơn vị điện tích hạt nhân của A là 13.
Số hạt mang điện trong A là 13.2 = 26 → Số hạt mang điện trong B là 26 + 8 = 34.
→ Số đơn vị điện tích hạt nhân của B là 34 : 2 = 17.
Câu 17:
Nguyên tử của nguyên tố X có tổng số hạt cơ bản là 49, trong đó số hạt không mang điện bằng 0,53125 số hạt mang điện. Điện tích hạt nhân của X là
 Xem đáp án
Xem đáp án
Đáp án D
Gọi số hạt proton, nơtron và electron trong X lần lượt là p, n và e.
Theo bài ra ta có:
Điện tích hạt nhân nguyên tử X là .
Câu 18:
Trong nguyên tử một nguyên tố A có tổng số các loại hạt là 58. Biết số hạt proton ít hơn số hạt nơtron là 1 hạt. Kí hiệu của A là
 Xem đáp án
Xem đáp án
Đáp án B
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố A là 58:
p + e + n = 58 hay 2p + n = 58 (do p = e) (1)
Số hạt p ít hơn số hạt n là 1 hạt:
n - p =1 (2)
Giải (1), (2) ta có p = e = 19, n = 20
Vậy A có số hiệu nguyên tử = số p = 19; Số khối của A là 19 + 20 = 39.
→ Kí hiệu nguyên tử A là:
Câu 21:
Dựa vào thứ tự mức năng lượng, xét xem sự xắp xếp các phân lớp nào sau đây sai?
 Xem đáp án
Xem đáp án
Đáp án A
Mức năng lượng ở phân lớp 3d > 4s.
Câu 22:
Tổng số hạt cơ bản trong một nguyên tử là
 Xem đáp án
Xem đáp án
Đáp án C
Tổng số hạt cơ bản trong Cr = p + n + e = A + e = 52 + 24 = 76.
Câu 23:
Nitơ trong thiên nhiên là hỗn hợp gồm hai đồng vị có % về số nguyên tử tương ứng là (99,63%) và (0,37%). Nguyên tử khối trung bình của nitơ là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 25:
Tổng số hạt n, p, e trong một nguyên tử X là 52, trong đó số hạt mang điện bằng 1,889 lần số hạt không mang điện. Kết luận nào không đúng?
 Xem đáp án
Xem đáp án
Đáp án D
Theo bài ra ta có hệ phương trình:
Cấu hình electron của X là [Ne] → X có 7e lớp ngoài cùng nên là phi kim.
Số khối của X là: 18 + 17 = 35.
Điện tích hạt nhân X là .
Câu 27:
Một nguyên tố hoá học có thể có nhiều nguyên tử có khối lượng khác nhau vì lí do nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 28:
Cho hai nguyên tố M và N có số hiệu nguyên tử lần lượt là 11 và 13. Cấu hình electron của M và N lần lượt là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 29:
Ở nhiệt độ 20oC, khối lượng riêng của kim loại X bằng 10,48 g/ và bán kính nguyên tử X là 1,446. cm. Giả thiết trong tinh thể các nguyên tử X có dạng hình cầu và có độ rỗng là 26%. Biết số Avogađro NA = 6,022.1023. Kim loại X là
 Xem đáp án
Xem đáp án
Đáp án C
Thể tích 1 nguyên tử X là:
Thể tích nguyên tử (phần đặc) trong tinh thể là: 1.(100%-26%) = 0,74
tinh thể có số nguyên tử là: 0,74 : (1,27.) = 5,85.nguyên tử.
Khối lượng 1 nguyên tử: 10,48 : (5,85.) = 1,79. (g)
Khối lượng 1 mol nguyên tử: 1,79. .6,. = 108 g/mol
→ X là Ag.