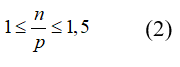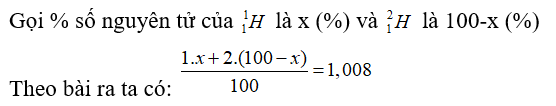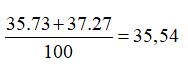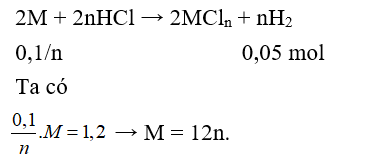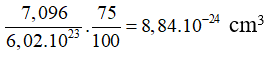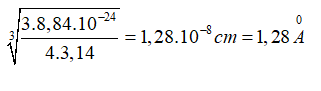Đề thi Hóa học 10 Giữa học kì 1 biên soạn (Đề 4)
-
3113 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Nguyên tố M có 7 electron hóa trị, biết M là phi kim thuộc chu kì 4. Cấu hình electron của nguyên tử M là
 Xem đáp án
Xem đáp án
Đáp án A
M có 7 electron hóa trị, lại là phi kim nên M thuộc nhóm VIIA, có 7electron lớp ngoài cùng.
M thuộc chu kỳ 4 nên có 4 lớp electron.
Cấu hình electron của M là: .
Câu 2:
Chọn câu trả lời đúng trong các câu sau: Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử
 Xem đáp án
Xem đáp án
Đáp án D
Câu 4:
Anion X- có cấu hình electron của phân lớp ngoài cùng là . Vị trí của X trong bảng tuần hoàn là
 Xem đáp án
Xem đáp án
Đáp án C
Ta có: X + 1e → X-
Cấu hình electron của X là [Ne]. Vậy X ở chu kỳ 3, nhóm VIIA.
Câu 5:
A, B là 2 nguyên tố thuộc cùng nhóm A và ở 2 chu kì 2 và 3 trong bảng tuần hoàn. Số đơn vị điện tích hạt nhân của A và B chênh lệch nhau là
 Xem đáp án
Xem đáp án
Đáp án C
Chu kỳ 2 và 3 mỗi chu kỳ gồm 8 nguyên tố.
Câu 6:
Oxit cao nhất của nguyên tố R là , trong hợp chất với hiđro R chiếm 82,35% về khối lượng. Nguyên tố R là
 Xem đáp án
Xem đáp án
Đáp án D
Hợp chất khí với H của R có dạng:
Ta có:
![]()
![]()
Câu 7:
Nguyên tố R có công thức oxit cao nhất là . Công thức hợp chất khí của R với hiđro là
 Xem đáp án
Xem đáp án
Đáp án C
R thuộc nhóm VIA, công thức hợp chất khí của R là .
Câu 8:
Nguyên tử A có cấu hình electron: . Ion có cấu hình electron là
 Xem đáp án
Xem đáp án
Đáp án D
Ta có: A +3e →
Vậy cấu hình electron của ion là: .
Câu 9:
Nguyên tố có Z = 19 thuộc chu kì
 Xem đáp án
Xem đáp án
Đáp án D
Ta có cấu hình electron: [Ar]. Vậy nguyên tố này thuộc chu kỳ 4.
Câu 11:
Nguyên tố X có Z = 18 thuộc loại nguyên tố nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án C
Ta có cấu hình electron nguyên tử X: .
X có 8 electron lớp ngoài cùng nên là khí hiếm.
Câu 13:
Số electron lớp ngoài cùng của nguyên tử S (Z = 16) là
 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình electron nguyên tử S là: [Ne]. Vậy S có 6 electron lớp ngoài cùng.
Câu 14:
Nguyên tử X có cấu hình electron của phân lớp có năng lượng cao nhất là . Hãy chỉ ra câu sai khi nói về nguyên tử X?
 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình electron nguyên tử X là: [Ne]. Vậy X ở nhóm VIA.
Câu 15:
Trong các mệnh đề sau, mệnh đề nào sai?
 Xem đáp án
Xem đáp án
Đáp án D
Bảng tuần hoàn gồm 18 cột, chia thành 8 nhóm A và 8 nhóm B. Riêng nhóm VIIIB gồm 3 cột.
Câu 16:
Nguyên tố X có số hiệu nguyên tử là 23 có vị trí trong bảng tuần hoàn là
 Xem đáp án
Xem đáp án
Đáp án A
Cấu hình electron của X là: [Ar]
Vậy X ở chu kỳ 4 do có 4 lớp electron, nhóm VB do 5 electron hóa trị, nguyên tố d.
Câu 17:
Nguyên tố X có tổng số proton, nơtron, electron là 13. Vậy X thuộc
 Xem đáp án
Xem đáp án
Đáp án C
Gọi số số proton, nơtron, electron trong X lần lượt là p, n và e.
Trong đó p = e.
Tổng số hạt trong nguyên tử X là 13 vậy 2p + n = 13 (1)
Từ (1) và (2) có: 3,7 ≤ p ≤ 4,3
Vậy p = 4 thỏa mãn → số e của X là 4.
Cấu hình electron của X là . Vậy X ở chu kỳ 2, nhóm IIA.
Câu 18:
Hai nguyên tố X và Y kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn có tổng số điện tích hạt nhân là 39. X và Y là (biết X đứng trước Y)
 Xem đáp án
Xem đáp án
Đáp án D
Gọi và lần lượt là số hiệu nguyên tử của X và Y. Theo bài ra ta có:
+ = 39 (1)
Lại có X và Y thuộc cùng chu kỳ, X đứng trước Y nên + 1 = (2)
Từ (1) và (2) ta có: ZX = 19 và = 20. Vậy X và Y là K và Ca.
Câu 19:
Trong tự nhiên Hiđro có hai đồng vị bền là và , nguyên tử khối trung bình của H là 1,008. % số nguyên tử của và lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
Giải phương trình được x = 99,2%.
Câu 20:
Trong tự nhiên X có hai đồng vị là và (trong đó chiếm 73% số nguyên tử). Biết có số khối là 35, hơn là 2 nơtron. Nguyên tử khối trung bình của X là
 Xem đáp án
Xem đáp án
Đáp án A
% số nguyên tử của đồng vị là 100 – 73 = 27%
Số khối = 35 + 2 = 37.
Nguyên tử khối trung bình của X là:
Câu 21:
Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro (R có số oxi hóa thấp nhất) và trong oxit cao nhất tương ứng là a% và b%, với a : b = 15 : 8, biết R có cấu hình electron ở lớp ngoài cùng là . Giá trị a là
 Xem đáp án
Xem đáp án
Đáp án B
R có 4 electron lớp ngoài cùng, e cuối cùng điền vào phân lớp np → R thuộc nhóm IVA
→ Hợp chất khí với hiđro và oxit cao nhất của R lần lượt là .
Ta có:
![]()
![]()
Câu 22:
Cho 1,2 gam kim loại M khi tan hết trong dung dịch HCl giải phóng 1,12 lít khí ở đktc. Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án B
Vậy n = 2, M = 24, kim loại là Mg thỏa mãn.
Câu 23:
Nguyên tử Fe ở có khối lượng riêng là 7,87g/, với giả thiết trong tinh thể nguyên tử sắt là những hình cầu chiếm 75% thể tích tinh thể, phần còn lại là khe rỗng giữa các quả cầu. Cho khối lượng nguyên tử của Fe là 55,847. Bán kính gần đúng của nguyên tử Fe là
 Xem đáp án
Xem đáp án
Đáp án A
Thể tích của 1 mol Fe là: 55,847 : 7,87 = 7,096
Thể tích của một nguyên tử Fe là:
Bán kính gần đúng của nguyên tử Fe là:
Câu 26:
Trong tự nhiên oxi có 3 đồng vị bền: còn cacbon có 2 đồng vị bền . Số lượng phân tử tạo thành từ các đồng vị trên là
 Xem đáp án
Xem đáp án
Đáp án B
Với lần lượt có các phân tử là: ; ; ; ; ;.
Tương tự với cũng có 6 phân tử được lập thành.
Câu 27:
Trong tự nhiên Cu có hai đồng vị: . Khối lượng nguyên tử trung bình của là 63,54. Thành phần % về khối lượng của trong là giá trị nào dưới đây? Biết MBr = 80
 Xem đáp án
Xem đáp án
Đáp án A
Gọi phần trăm đồng vị = x, thì % đồng vị = 100 - x
Ta có
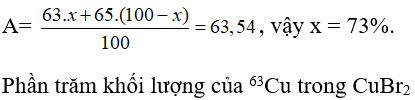
![]()
Câu 28:
Cặp nguyên tố nào sau đây có tính chất tương tự nhau nhất?
 Xem đáp án
Xem đáp án
Đáp án D
Cl và Br thuộc cùng nhóm VIIA, nên có tính chất hóa học tương tự nhau.
Câu 30:
Nguyên tố X có Z = 15. Số electron lớp ngoài cùng của X là
 Xem đáp án
Xem đáp án
Đáp án B
Cấu hình electron nguyên tử X là [Ne]. Vậy X có 5electron lớp ngoài cùng.