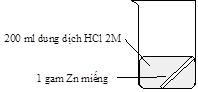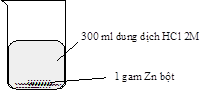Đề kiểm tra kì 2 Hóa học 10 Cánh diều có đáp án - Đề 1
-
1952 lượt thi
-
31 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 2:
 Xem đáp án
Xem đáp án
Câu 3:
Cho các phát biểu sau:
(a). Sự oxi hoá là sự nhường electron hay sự làm tăng số oxi hoá.
(b). Trong quá trình oxi hoá, chất khử nhận electron.
(c). Sự khử là sự nhận electron hay là sự làm giảm số oxi hoá.
(d). Trong quá trình khử, chất oxi hoá nhường electron.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Câu 4:
 Xem đáp án
Xem đáp án
Câu 5:
Cho các phản ứng hoá học sau:
(1) Phản ứng đốt cháy hydrogen: 2H2(g) + O2(g) → 2H2O(l).
(2) Phản ứng nung vôi: CaCO3(s) → CaO(s) + CO2(g).
Nhận xét nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Câu 7:
Cho các phát biểu sau:
(a). Biến thiên enthalpy chuẩn của một phản ứng hoá học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và 25 oC.
(b). Nhiệt (toả ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó.
(c). Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
(d). Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Câu 8:
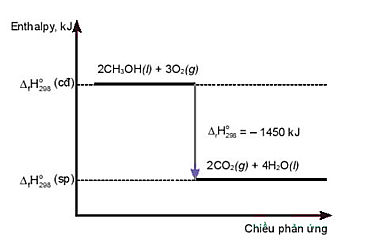
Cho phản ứng sau:
2H2(g) + O2(g) → 2H2O(g) \[{\Delta _r}H_{298}^0 = - 483,64\,kJ.\]
Enthalpy tạo thành chuẩn của H2O(g) là
 Xem đáp án
Xem đáp án
Đáp án: A
Enthalpy tạo thành chuẩn của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn.
Þ Enthalpy tạo thành chuẩn của H2O(g) là: \[\frac{{ - 483,64}}{2}\, = - 241,82kJ.\]
Câu 10:
Cho phản ứng sau: H2(g) + Cl2(g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng là
Biết: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/ mol.
 Xem đáp án
Xem đáp án
Đáp án: D
Biến thiên enthalpy chuẩn của phản ứng là:
\[\begin{array}{l}{\Delta _r}H_{298}^0 = {E_b}_{(H - H)} + {E_{b(Cl - Cl)}} - 2{E_{b(H - Cl)}}\\ = 436 + 243 - 2.432 = - 185(kJ).\end{array}\]
Câu 11:
 Xem đáp án
Xem đáp án
Câu 12:
Cho phản ứng tổng quát sau:
aA + bB → mM + nN
Tốc độ trung bình của phản ứng tính theo chất A là
 Xem đáp án
Xem đáp án
Đáp án: D
Câu 13:
Cho phản ứng: 2CO(g) + O2(g) ⟶ 2CO2(g).
Tốc độ phản ứng thay đổi như thế nào nếu tăng nồng độ CO gấp 3 lần, các chất khác giữ nguyên nồng độ?
 Xem đáp án
Xem đáp án
Đáp án: C
Theo định luật tác dụng khối lượng, tốc độ của phản ứng là: \(v\) = \(kC_{CO}^2C_{{O_2}}^{}\)
Nếu tăng nồng độ CO gấp 3 lần, ta có: \(v'\) = \(k{\left( {3.C_{CO}^{}} \right)^2}C_{{O_2}}^{}\) = \(9.kC_{CO}^2C_{{O_2}}^{}\) = \(9v\)
Vậy tốc độ phản ứng tăng gấp 9 lần.
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án: D
\[\frac{{{v_2}}}{{{v_1}}}\] = \({\gamma ^{\left( {\frac{{{T_2} - {T_1}}}{{10}}} \right)}}\) ⇒ \[\frac{{{v_2}}}{{{v_1}}}\] = \({2^{\left( {\frac{{70 - 30}}{{10}}} \right)}}\) = 16
⇒ Tốc độ phản ứng tăng gấp 16 lần.
Câu 16:
 Xem đáp án
Xem đáp án
Câu 17:
 Xem đáp án
Xem đáp án
Câu 18:
Thí nghiệm nghiên cứu tốc độ phản ứng giữa kẽm (zinc) với dung dịch hydrochloric acid của hai nhóm học sinh được mô tả bằng hình sau:
|
Thí nghiệm nhóm thứ nhất |
Thí nghiệm nhóm thứ hai |
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do
 Xem đáp án
Xem đáp án
Đáp án: B
Câu 19:
Cho các phát biểu sau về nguyên tử các nguyên tố nhóm VIIA:
(a). Có 7 electron hóa trị.
(b). Theo chiều tăng dần của điện tích hạt nhân nguyên tử thì độ âm điện giảm.
(c). Theo chiều tăng dần điện tích hạt nhân nguyên tử thì khả năng hút cặp electron liên kết giảm.
(d). Theo chiều tăng dần điện tích hạt nhân nguyên tử thì bán kính nguyên tử giảm.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án: B
Câu 20:
 Xem đáp án
Xem đáp án
Câu 22:
 Xem đáp án
Xem đáp án
Câu 24:
Cho các phát biểu sau về ion halide X-:
(a). Dùng dung dịch silver nitrate sẽ phân biệt được các ion F-, Cl-, Br-, I-.
(b). Với sulfuric acid đặc, các ion Cl-, Br-, I- thể hiện tính khử, ion F- không thể hiện tính khử.
(c). Tính khử của các ion halide tăng theo dãy: Cl-, Br-, I-.
(d). Ion Cl- kết hợp ion Ag+ tạo AgCl là chất không tan, màu vàng.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án: B
Câu 25:
 Xem đáp án
Xem đáp án
Câu 26:
 Xem đáp án
Xem đáp án
Đáp án: B
\[{n_{Mg}} = \frac{{0,48}}{{24}} = 0,02\,(mol)\]
Phương trình hóa học:
Mg + 2HCl → MgCl2 + H2
Theo phương trình hóa học có:
\[\begin{array}{l}{n_{{H_2}}} = {n_{Mg}} = 0,02\,mol\\ \Rightarrow {V_{{H_2}}} = 0,02.24,79 = 0,4958(L)\end{array}\]
Câu 29:
Cho potassium iodide (KI) tác dụng với potassium permanganate (KMnO4) trong dung dịch sulfuric acid (H2SO4), thu được 3,02 g manganese(II) sulfate (MnSO4), I2 và K2SO4.
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Tính khối lượng potassium iodide (KI) đã tham gia phản ứng.
 Xem đáp án
Xem đáp án
Đáp án:
a) \[K\mathop I\limits^{ - 1} \,\,\, + \,\,K\mathop {Mn}\limits^{ + 7} {O_4}\,\,\, + \,\,\,{H_2}S{O_4}\,\,\, \to \,\,\,{\mathop I\limits^0 _2}\,\,\, + \,\,\,\mathop {Mn}\limits^{ + 2} S{O_4}\,\,\, + {K_2}S{O_4} + {H_2}O\]
Chất khử: KI.
Chất oxi hoá: KMnO4.
Quá trình khử: \[\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} \].
Quá trình oxi hoá: \[2\mathop I\limits^{ - 1} \to {\mathop I\limits^0 _2} + 2e\]
Þ Phương trình hoá học được cân bằng:
\[10KI\,\,\, + \,\,\,2KMn{O_4}\,\,\, + \,\,\,8{H_2}S{O_4}\,\,\, \to \,\,\,5{I_2}\,\,\, + \,\,\,2MnS{O_4}\,\,\, + 6{K_2}S{O_4} + 8{H_2}O\]
b) Ta có số mol manganese(II) sulfate = 0,02 mol
\[\begin{array}{l}10KI\,\,\, + \,\,\,2KMn{O_4}\,\,\, + \,\,\,8{H_2}S{O_4}\,\,\, \to \,\,\,5{I_2}\,\,\, + \,\,\,2MnS{O_4}\,\,\, + 6{K_2}S{O_4} + 8{H_2}O\\0,1 & & & & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,05\,{\rm{ }}\,\,\,\,\,\,\,0,02{\rm{ }} & & & & mol\end{array}\]
Khối lượng potassium iodide đã tham gia phản ứng: 0,1.166 = 16,6 g.
Câu 30:
 Xem đáp án
Xem đáp án
Đáp án:
Cl2 + 2KX → 2KCl + X2
\[{n_{KX}} = {\rm{ }}{n_{KCl}} = \frac{{4,47}}{{74,5}} = 0,06\,\,(mol)\]
\[{M_{KX}} = \frac{{7,14}}{{0,06}} = 119\]
Vậy MX = 119 – 39 = 80 nên KX là KBr.
Câu 31:
 Xem đáp án
Xem đáp án
Đáp án:
Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím làm thuốc thử.
+ Nếu quỳ tím chuyển sang màu đỏ → HBr.
+ Nếu quỳ tím không đổi màu → NaI; KCl (nhóm I).
- Phân biệt nhóm I bằng AgNO3.
+ Nếu có kết tủa trắng → KCl.
KCl + AgNO3 → AgCl + KNO3.
+ Nếu có kết tủa vàng → NaI.
NaI + AgNO3 → AgI + NaNO3.