100 câu trắc nghiệm Nguyên tử nâng cao (P2)
-
15399 lượt thi
-
20 câu hỏi
-
20 phút
Danh sách câu hỏi
Câu 1:
Cho biết: 8O và 15P. Xác định số hạt mang điện có trong P2O5 ?
 Xem đáp án
Xem đáp án
Đáp án C
Số hạt mang điện trong P2O5 bằng 2.2.15 + 2.5.8 = 140 hạt
Câu 2:
Tổng số hạt mang điện dương trong phân tử CO2 (cho 6C và 8O)
 Xem đáp án
Xem đáp án
Đáp án C.
Số hạt mang điện dương = pC + pO.2 = 6 + 8.2 = 22 hạt
Câu 3:
Nguyên tố X có 2 đồng vị X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng % các đồng vị bằng nhau và các loại hạt trong X1 cũng bằng nhau. Nguyên tử khối trung bình của X là:
 Xem đáp án
Xem đáp án
Đáp án D.
X1 có tổng các loại hạt bằng = 18 và các hạt trong X1 bằng nhau
Ta có p + e + = 18 mặt khác p = e =
=> p = e = =6
X2 có số hạt proton bằng số hạt proton trong X1 do cùng là đồng vị:
2p + =20 => = 8
Ta có số khối của X1 = 12, X2 = 14 và %X1 = %X2 = 50%.
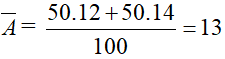
Câu 4:
Cho 5,85 gam muối NaX tác dụng với dd AgNO3 dư ta thu được 14,35 gam kết tủa trắng. Nguyên tố X có hai đồng vị (x1%) và (x2%). Vậy giá trị của x1% và x2% lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án B
Ta có NaX + AgNO3 → NaNO3 + AgX
M tăng = 108-23 = 85, m tăng = 8,5 gam
nAgX = 0,1; MAgX = 143,5 => X: 35,5 (Cl)
Ta có
Câu 5:
Nguyên tử X có điện tích hạt nhân là +2,7234.10-18C. Trong nguyên tử X số hạt mang điện nhiều hơn số hạt không mang điện là 16. Kí hiệu nguyên tử của X là
 Xem đáp án
Xem đáp án
Đáp án D
1 hạt proton có điện tích là +1,602.10-19C.
=> Số hạt proton trong X = 17
Trong X số hạt mang điện nhiều hơn số hạt không mang điện là 16:
2p – n = 16 => n = 18
Số khối của X = p + n = 35
Câu 6:
Tổng điện tích lớp vỏ của nguyên tử R có điện tích bằng -32.10‑19C. Nguyên tố R là
 Xem đáp án
Xem đáp án
Đáp án B.
1 hạt electron có điện tích là -1,602.10-19C.
Số hạt electron trong X = = 20.
Câu 7:
Nguyên tố X có tổng số hạt p, n, e là 28 hạt. Kí hiệu nguyên tử của X là
 Xem đáp án
Xem đáp án
Đáp án B.
Giả sử X có số hiệu nguyên tử là Z.
Ta có: 2Z + N = 28
Với các nguyên tử bền:
• TH1: Z = 8 → A = Z + N = 20 → Kí hiệu nguyên tử của X là
• TH2: Z = 9 → A = Z + N = 19 → Kí hiệu nguyên tử của X là 199X
Câu 8:
Hợp chất vô cơ T có công thức phân tử XY2. Tổng số các hạt trong phân tử T là 66, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của Y nhiều hơn X là 4. Số hạt trong Y nhiều hơn số hạt trong X là 6 hạt. Công thức phân tử của T là:
 Xem đáp án
Xem đáp án
Đáp án D.
Gọi tổng số hạt proton, nơtron và electron của nguyên tử X là: pX, nX, eX và y là pY, nY, eY.
Tổng số hạt proton, nơtron và electron của nguyên tử XY2 là 66
px + nx + ex + 2.(py + ny + ey)= 66 hay 2px + nx + 4py +2ny = 66 (1)
px = ex và py = ey.
Số hạt mang điện nhiều hơn số hạt không mang điện là 22 nên:
px + ex + 2py + 2ey – nx - 2ny = 22 => 2px + 4py - nx - 2ny = 22 (2)
Số khối của Y nhiều hơn X là 4
Số hạt trong Y nhiều hơn số hạt trong X là 6 hạt
py + ny + ey – (Px + nx + ex) = 6 hay 2py + ny – (2px + nx) = 6 (4)
Từ (1), (2), (3), (4) ta có : px = 6 (C) và py = 8 (O).
Câu 9:
Tổng số hạt electron trong ion NH4+, biết N (Z=7) và H (Z=1)
 Xem đáp án
Xem đáp án
Đáp án C
Số hạt electron trong ion là: pN + pH.4 – 1 = 10 hạt
Câu 10:
Tổng số hạt cơ bản trong ion X3- là 49, trong đó tổng số hạt mang điện nhiều hơn không mang điện là 17, X là
 Xem đáp án
Xem đáp án
Đáp án B
Gọi các hạt proton, nơtron và electron trong X lần lượt là p, n và e
Tổng số các loại hạt proton, nơtron và electron của X3- là 49
p+ n + e +3 = 49 hay 2p + n = 46 (1)
Tổng số hạt mang điện nhiều hơn hạt không mang điện là 17
p + e + 3 – n = 17 hay 2p -n = 14 (2)
Từ (1), (2) ta có p = e = 15, n =16
Vậy X là photpho.
Câu 11:
Nguyên tử S (Z=16) nhận thêm 2e thì cấu hình e tương ứng của nó là
 Xem đáp án
Xem đáp án
Đáp án D.
Cấu hình của S 1s2 2s2 2p6 3s2 3p4
=> cấu hình của S2- (nhận thêm 2 e): 1s2 2s2 2p6 3s2 3p6
Câu 12:
Nguyên tử của nguyên tố X có 3 lớp e, lớp ngoài cùng có 5e. Vậy số hiệu nguyên tử của nguyên tố X là
 Xem đáp án
Xem đáp án
Đáp án B
Cấu hình của X là 1s22s22p63s23p3
Câu 13:
Nguyên tử M2+ có cấu hình electron của phân lớp ngoài cùng là 3d7. Tổng số electron của nguyên tử M là:
 Xem đáp án
Xem đáp án
Đáp án C
Cấu hình đầy đủ của M là:
Cấu hình của R là 1s22s22p63s23p63d74s2
Câu 14:
Số electron trong các ion sau: NO3-, NH4+ , HCO3-, H+ , SO42- theo thứ tự là
 Xem đáp án
Xem đáp án
Đáp án D.
Số hạt e trong các nguyên tử N (e = 7), H (e = 1), O (e = 8), S (e = 16), C( e = 6).
NO3-: số e = eN + eO.3 + 1 =32
NH4+: số e = eN + eH .4 -1 = 10
HCO3-: số e = eH + eC + eO.3 + 1 = 32
H+: số e = 0
SO42-: eS + eO.4 + 2 = 50
Câu 15:
Chọn câu phát biểu đúng:
1.Trong một nguyên tử luôn luôn có số proton = số nơtron = số đơn vị điện tích hạt nhân
2.Tổng số proton và số nơtron trong một hạt nhân gọi là số khối
3.Số khối A là khối lượng tuyệt đối của nguyên tử
4.Số proton cho biết số đơn vị điện tích hạt nhân.
5.Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau về số electron
 Xem đáp án
Xem đáp án
Đáp án D
Câu 18:
Trong tự nhiên Cu có hai đồng vị: , . Khối lượng nguyên tử trung bình của Cu là 63,54. Thành phần % về khối lượng của trong CuCl2 là giá trị nào dưới đây? Biết MCl = 35,5.
 Xem đáp án
Xem đáp án
Đáp án D.
Phần trăm đồng vị 63Cu = x, thì % đồng vị 65Cu = 100 - x
Ta có:

Câu 19:
Phân tử XY3 có tổng số hạt proton, nơtron và electron bằng 196, trong đó hạt mang điện nhiều hơn số hạt không mang điện là 60. Tổng số hạt trong Y- nhiều hơn trong X3+ là 16. Công thức của XY3 là:
 Xem đáp án
Xem đáp án
Đáp án C.
Gọi tổng số hạt proton, nơtron và electron của nguyên tử X là : pX, nX, eX và y là pY, nY, eY.
Tổng số hạt proton, nơtron và electron của nguyên tử XY3 là 196
px + nx + ex + 3.(py + ny + ey)= 196 hay 2px + nx + 6py + 3ny = 196 (1)
px = ex và py = ey.
Số hạt mang điện nhiều hơn số hạt không mang điện là 60 nên :
px + ex + 3py + 3ey – nx - 3ny = 22 => 2px + 6py - nx - 3ny = 60 (2)
Tổng số hạt trong Y- nhiều hơn trong X3+ là 16
2py + ny + 1 – (2px + nx – 3) = 16 hay 2py – 2px + ny –nx = 12
Giải ra ta có px = 13 (Al), py = 17 (Cl).
Câu 20:
Trong phân tử XY2 có 30 proton. Trong nguyên tử X cũng như Y có số proton bằng số nơtron. X và Y lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án C.
Gọi tổng số hạt proton, nơtron và electron của nguyên tử X là : pX, nX, eX và y là pY, nY, eY.
Tổng số hạt proton của nguyên tử XY2 là 30
px + 2py = 30, py < 15 , dựa vào đáp án => Y là O (p=8), vậy px = 14 (Si)