100 câu trắc nghiệm Nguyên tử nâng cao (P4)
-
15431 lượt thi
-
20 câu hỏi
-
20 phút
Danh sách câu hỏi
Câu 1:
Nguyên tử X có tổng số hạt p, n, e là 28 hạt. Kí hiệu nguyên tử của X là
 Xem đáp án
Xem đáp án
Đáp án A.
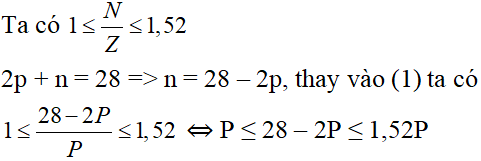
Vậy p = 9, n = 10, thỏa mãn
Câu 2:
Theo định nghĩa, số Avogađro là một số bằng số nguyên tử đồng vị 12C có trong 12 gam đồng vị 12C. Số Avogađro được kí hiệu là N, N có giá trị là 6,022.1023. Khối lượng của một nguyên tử 12C là bao nhiêu gam
 Xem đáp án
Xem đáp án
Đáp án D.
Khối lượng của một nguyên tử cacbon 12
Câu 3:
Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau:
Nguyên tử khối trung bình của Mg là
 Xem đáp án
Xem đáp án
Đáp án B.
Do electron có khối lượng rất nhỏ nên nguyên tử khối trung bình của Mg xấp xỉ bằng số khối trung bình của nó:
Câu 4:
Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau:
Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg, thì số nguyên tử tương ứng của hai đồng vị 24, 26 lần lượt là bao nhiêu?
 Xem đáp án
Xem đáp án
Đáp án C.
Ta có:
Giả sử trong hỗn hợp nói trên có 50 nguyên tử 25Mg, thì số nguyên tử tương ứng của 2 đồng vị còn lại là:
Câu 5:
Cấu hình electron biểu diễn theo ô lượng tử nào dưới đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án A.
Các electron phải phân bố sao cho số electron độc thân là lớn nhất (Quy tắc Hun).
Câu 6:
Nguyên tử của nguyên tố A và B đều có phân lớp ngoài cùng là 2p. Tổng số e ở hai phân lớp ngoài cùng hai nguyên tử này là 3. Vậy số hiệu nguyên tử của A và B lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án B
Cấu hình của A và B là:
1s22s22px và 1s22s22py
x+y = 3 => x = 1 , y =2 => PA = 5, PB = 6
Câu 7:
Trong nước, hiđro tồn tại hai đồng vị 1H và 2H. Biết nguyên tử khối trung bình của hiđro là 1,008; của oxi là 16. Số nguyên tử đồng vị của 2H có trong 1 ml nước nguyên chất (d = 1 gam/ml) là bao nhiêu?
 Xem đáp án
Xem đáp án
Đáp án B
Áp dụng sơ đồ đường chéo ta có:
![]()
Vậy phần trăm về số nguyên tử của các đồng vị H là:
% 1H = 99,2% ; % 2H = 0,8%
Câu 8:
Trong tự nhiên kali có hai đồng vị và . Tính thành phần phần trăm về khối lượng của có trong KClO4. (cho nguyên tử khối trung bình của K, Cl và O lần lượt là 39,13; 35,5 và 16)
 Xem đáp án
Xem đáp án
Đáp án C.
Gọi phần trăm về số nguyên tử đồng vị của 39K và 41K là x1 và x2 ta có:
Giả sử có 1 mol KClO4 thì tổng số mol các đồng vị của K là 1 mol, trong đó số mol 39K là 1.0,935 =0,935 mol.
Vậy thành phần phần trăm về khối lượng của 39K có trong KClO4 là:
Câu 9:
Nguyên tử của một nguyên tố có bốn lớp electron, theo thứ tự từ phía gần hạt nhân là : K, L, M, N. Trong nguyên tử đã cho, electron thuộc lớp nào có mức năng lượng trung bình cao nhất ?
 Xem đáp án
Xem đáp án
Đáp án D.
Càng xa hạt nhân, electron càng có mức năng lượng cao.
Câu 10:
Cho biết cấu hình electron của X : 1s22s22p63s23p3 của Y là 1s22s22p63s23p64s1. Nhận xét nào sau đây là đúng ?
 Xem đáp án
Xem đáp án
Đáp án D.
X có 5 electron lớp ngoài cùng nên X là phi kim.
Y có 1 electron lớp ngoài cùng nên Y là kim loại.
Câu 11:
Cấu hình electron của 4 nguyên tố:
9X : 1s22s22p5
11Y : 1s22s22p63s1
13Z : 1s22s22p63s23p1
8T : 1s22s22p4
Ion của 4 nguyên tố trên là:
 Xem đáp án
Xem đáp án
Đáp án B
X có xu hướng nhận 1e → X-
Y có xu hướng nhường 1 e →Y+
Z có xu hướng nhường 3e →Z3+
T có xu hướng nhận 2 e →T2-
Câu 12:
Một nguyên tử X của một nguyên tố có điện tích của hạt nhân là 27,2.10-19 Culông. Cho các nhận định sau về X:
(1) Ion tương ứng của X sẽ có cấu hình electron là: 1s22s22p63s23p6.
(2) X có tổng số obitan chứa electron là: 10.
(3) Ở trạng thái cơ bản X có 1 electron độc thân.
(4) X là một kim loại.
Có bao nhiêu nhận định không đúng trong các nhận định cho ở trên ?
 Xem đáp án
Xem đáp án
Đáp án B.
Nhận định không đúng: 2,4
Hạt proton có điện tích bằng = +1,602.10-19
Số hạt proton trong X bằng: 27,2.10-19 : (1,602.10-19) = 17.
Cấu hình X là 1s22s22p63s23p5
Vậy X là phi kim, ở trạng thái cơ bản X có 1 electron độc thân.
Câu 13:
Hình vẽ nào sau đây vi phạm nguyên lí Pauli khi điền electron vào AO?
 Xem đáp án
Xem đáp án
Đáp án D.
Theo nguyên lý Pau-li: trên 1 obitan có thể có nhiều nhất là 2 lectron và 2 electron này có chiều quay ngược nhau.
Câu 14:
Cấu hình nào sau đây vi phạm nguyên lí Pauli:
 Xem đáp án
Xem đáp án
Đáp án C.
Số electron tối đa trên phân lớp s chỉ có tối đa 2 e.
Câu 15:
Nguyên tử Al có bán kính 1,43 Å và có nguyên tử khối là 27u. Khối lượng riêng của Al bằng bao nhiêu, biết rằng trong tinh thể nhôm các nguyên tử chỉ chiếm 74% thể tích, còn lại là các khe trống?
 Xem đáp án
Xem đáp án
Đáp án B.
Mặt khác:
Suy ra: D = 2,7 gam/cm3
Câu 16:
Trong nguyên tử X, giữa bán kính hạt nhân (r) và số khối của hạt nhân (A) có mối quan hệ như sau: r = 1,5.10-13.A1/3 cm. Tính khối lượng riêng (tấn/cm3) của hạt nhân nguyên tử X.
 Xem đáp án
Xem đáp án
Đáp án C
Coi hạt nhân nguyên tử có dạng hình cầu, thì giữa thể tích hạt nhân và bán kính hạt nhân có mối liên hệ như sau: (1)
Thay r = 1,5.10-13.A1/3 cm vào (1) ta có :
Trong nguyên tử, khối lượng của electron rất nhỏ nên khối lượng nguyên tử chủ yếu tập trung ở hạt nhân.
Do đó khối lượng (gam) của 1 mol nguyên tử (M) có giá trị xấp xỉ bằng số khối (A).
Khối lượng của 1 nguyên tử xấp xỉ bằng khối lượng của hạt nhân bằng:
Khối lượng riêng của hạt nhân
Câu 17:
Một hợp chất có công thức XY2 trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số nơtron. Tổng số proton trong phân tử XY2 là 32. Viết cấu hình electron của X.
 Xem đáp án
Xem đáp án
Đáp án A.
Gọi số hạt proton, nơtron, electron của nguyên tử X là p, n, e và của Y là p’, n’, e’.
Theo bài : p = n = e và p’ = n’ = e’.
Trong hợp chất XY2, X chiếm 50% về khối lượng nên:
Tổng số proton trong phân tử XY2 là 32 nên p + 2p’ = 32.
Từ đây tìm được: p = 16 (S) và p’ = 8 (O). Hợp chất cần tìm là SO2.
Cấu hình electron của S: 1s22s22p63s23p4
Câu 18:
Một loại khí X có chứa 2 đồng vị . Cho X2 tác dụng với H2 rồi lấy sản phẩm hoà tan vào nước thu được dung dịch Y. Chia dung dịch Y thành hai phần bằng nhau:
- Phần thứ nhất cho tác dụng vừa đủ với 125 ml dung dịch Ba(OH)2 0,88M.
- Phần thứ hai cho tác dụng với AgNO3 vừa đủ ta thu được 31,57 gam kết tủa.
Thành phần % số nguyên tử của mỗi đồng vị là bao nhiêu?
 Xem đáp án
Xem đáp án
Đáp án D
Gọi phần trăm số nguyên tử của là x, là (100 – x).
Vậy thành phần phần trăm mỗi loại đồng vị của clo là : (75% ) ; (25%).
