100 câu trắc nghiệm Nguyên tử nâng cao (P3)
-
15403 lượt thi
-
20 câu hỏi
-
20 phút
Danh sách câu hỏi
Câu 1:
Tổng số hạt mang điện trong hợp chất XY2 bằng 44. Số hạt mang điện của nguyên tử Y nhiều hơn số hạt mang điện của nguyên tử X là 4. Số hiệu nguyên tử của X và Y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án D.
Gọi tổng số hạt proton, nơtron và electron của nguyên tử X là : pX, nX, eX và y là pY, nY, eY.
Tổng số hạt proton, electron của nguyên tử là 44
px + ex + 2.(py + ey)= 44 hay 2px + 4py = 44 (1)
px = ex và py = ey.
Số hạt mang điện của nguyên tử Y nhiều hơn số hạt mang điện của nguyên tử X là 4
2py – 2px = 4
Giải ra ta có px = 6 (C) và py= 8 (O)
Câu 2:
Hợp chất Y có công thức M4X3. Biết:
− Tổng số hạt trong phân tử Y là 214 hạt.
− Ion M3+ có số electron bằng số electron của ion X4 −
− Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố M nhiều hơn tổng số hạt của nguyên tử nguyên tố X trong Y là 106. Y là chất nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án C.
Tổng số hạt trong phân tử Y là 214 hạt.
4(2pM + nM) + 3(2pX + nX) = 214 (1)
Ion M3+ có số electron bằng số electron của ion X4 −
pM - 3 = pX + 4 => pX = pM - 7 (2)
Tổng số hạt proton, nơtron, electron của nguyên tử nguyên tố M nhiều hơn tổng số hạt của nguyên tử nguyên tố X trong Y là 106
4(2pM + nM) - 3(2pX + nX) = 106 (3)
(1), (3) => 2pM + nM = 40 (4) và 2pX + nX = 18 (5)
(5),(2),(4) => pX = 6 ; pM = 13 => X là C (Carbon) và M là Al (Nhôm)
Y là Al4C3 (Nhôm cacbua)
Câu 3:
Phát biểu nào dưới đây là đúng với nguyên tử X có số hiệu nguyên tử là 9?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 4:
Tổng số electron ở các phân lớp 3p và 3d của ion 26Fe3+ là
 Xem đáp án
Xem đáp án
Đáp án B.
Cấu hình e của Fe:1s22s22p63s23p63d64s2
: 1s22s22p63s23p63d5
Phân lớp 3p có 6e, phân lớp 3d có 5e
Câu 5:
Một ion M3+ có tổng số hạt proton, nơtron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Cấu hình electron của nguyên tử M là
 Xem đáp án
Xem đáp án
Đáp án B
Gọi số hạt proton, nơtron và electron trong M lần lượt là p, n và e.
Tổng số các loại hạt proton, nơtron và electron của ion M3+ là 79
p + n + e -3 = 79 => 2p + n = 82 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 19
p + e – 3 – n = 19 hay 2p – n = 22 (2)
Từ (1), (2) ta có p = e = 26, n =30
Cấu hình e của M: [Ar]3d64s2
Câu 6:
Nguyên tử khối trung bình của clo là 35,5. Clo trong tự nhiên có 2 đồng vị là 35Cl và 37Cl. Phần trăm về khối lượng của chứa trong HClO4 (với hiđro là đồng vị , oxi là đồng vị ) là giá trị nào sau đây
 Xem đáp án
Xem đáp án
Đáp án D.
Phần trăm đồng vị 35Cl = x, thì % đồng vị 37Cl = 100 - x
Ta có:
![]() , vậy x = 75%.
, vậy x = 75%.
Phần trăm khối lượng của 37Cl trong HClO4= 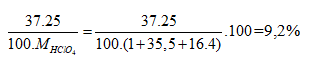
Câu 7:
Nguyên tử của nguyên tố X có tổng số hạt electron trong các phân lớp p là 7. Số hạt mang điện của một nguyên tử Y nhiều hơn số hạt mang điện của một nguyên tử X là 8 hạt. Các nguyên tố X và Y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án C.
Cấu hình electron của X: 1s22s22p63s23p1 (Al)
Số hạt mang điện của X = 12.2=26
Số hạt mang điện của Y = 26+8 = 34 , py = 17 (Cl)
Câu 8:
Hạt nhân của ion X+ có điện tích là 30,4.10-19 culông. Xác định nguyên tử X.
 Xem đáp án
Xem đáp án
Đáp án B.
Theo giả thiết : Hạt nhân của ion X+ có điện tích là 30,4.10-19 C nên nguyên tử X cũng có điện tích hạt nhân là 30,4.10-19 C. Mặt khác mỗi hạt proton có điện tích là 1,6.10-19 C nên suy ra số prton trong hạt nhân của X là:
Vậy nguyên tử X là Kali (K).
Câu 9:
Hiđro có ba đồng vị 1H,2H,3H. Oxi có ba đồng vị 16O ,17O ,18O. Trong nước tự nhiên, loại phân tử nước có khối lượng nhỏ nhất là?
 Xem đáp án
Xem đáp án
Đáp án A.
Đồng vị H2O nhỏ nhất sẽ được tạo thành bởi đồng vị H và đồng vị O có khối lượng nhỏ nhất là 1H1H16O.
Câu 10:
Nguyên tố M có các đồng vị sau: , , , . Đồng vị phù hợp với tỷ lệ số proton/số nơtron = 13/15 là
 Xem đáp án
Xem đáp án
Đáp án B.
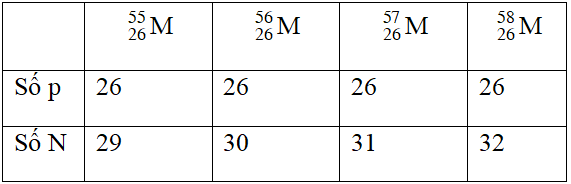
Đồng vị phù hợp với tỷ lệ số proton/số nơtron = 13/15 là 5626M
Câu 12:
Trong tự nhiên Clo có 2 đồng vị 35Cl và 37Cl. Nguyên tử khối trung bình của Clo là 35,5. Phần trăm về khối lượng của 35Cl trong HClO là (biết
 Xem đáp án
Xem đáp án
Đáp án A.
Phần trăm đồng vị 35Cl = x, thì % đồng vị 37Cl = 100 - x
Ta có:
Câu 13:
Một nguyên tử X có tổng số electron ở các phân lớp s là 6 và tổng số electron lớp ngoài cùng là 6. Cho biết X thuộc về nguyên tố hoá học nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
Cấu hình đầy đủ của X: 1s22s22p63s23p4
Câu 14:
Một nguyên tử X có tổng số e ở các phân lớp p là 11. Hãy cho biết X thuộc về nguyên tố hoá học nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B.
Cấu hình của X là 1s22s22p63s23p5
Câu 15:
Nguyên tử nguyên tố X có electron cuối cùng được phân bổ vào phân lớp 3p1. Nguyên tử nguyên tố Y có electron cuối cùng được phân bổ vào phân lớp 3p3. Số proton của X, Y lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án A.
Cấu hình electron đầy đủ của X: 1s22s22p63s23p1 Số p= 13
Cấu hình electron đầy đủ của Y: 1s22s22p63s23p3 số p = 15
Câu 16:
Trong các cấu hình electron dưới đây, cấu hình nào không tuân theo nguyên lý Pauli?
 Xem đáp án
Xem đáp án
Đáp án D
Phân lớp p chỉ được chứa tối đa 6e
Câu 17:
Nguyên tử nguyên tố X tạo ion X-. Tổng số hạt (p, n, e) trong X- bằng 116. X là nguyên tử nguyên tố nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án D.
X− có tổng số hạt bằng = 116, vậy X có tổng số hạt = 115.
Vậy P = 35, X là Br thỏa mãn.
Câu 18:
Tổng số hạt p, n và e trong nguyên tử của 1 nguyên tố là 21. Nguyên tố đó là:
 Xem đáp án
Xem đáp án
Đáp án C
Với các nguyên tử bền:
Vậy p = 7, nguyên tử là N (thỏa mãn)
Câu 19:
Tổng số hạt cơ bản trong M2+ là 90, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. M là
 Xem đáp án
Xem đáp án
Đáp án B
Gọi các hạt proton, nơtron và electron trong M lần lượt là p, n và e.
Tổng số các loại hạt proton, nơtron và electron của M2+ là 90
p + n + e -2 = 90 hay 2p + n = 92 (1)
Tổng số hạt mang điện gấp nhiều hơn số hạt không mang điện là 22
(p + e -2) – n = 22 hay 2p – n = 24 (2)
Từ (1), (2) ta có p = e = 29 , n =34
Câu 20:
Nguyên tử Cu có 35 electron ở vỏ nguyên tử. Điện tích hạt nhân của nguyên tử đồng (theo đơn vị C) là
 Xem đáp án
Xem đáp án
Đáp án D.
Có p=e=35
Điện tích hạt nhân của nguyên tử đồng là: qp= 35+= 35.1,602.10-19
= 5,607.10-18
