Trắc nghiệm Hóa 10 Dạng Dạng 5. Bài tập về đồng vị, nguyên tử khối trung bình có đáp án
-
2323 lượt thi
-
17 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Neon có ba đồng vị bền trong tự nhiên. Tỉ lệ phần trăm số nguyên tử mỗi đồng vị được thể hiện trong bảng sau:
|
Số khối |
A |
21 |
22 |
|
Tỉ lệ (%) |
90,9 |
0,3 |
8,8 |
Biết rằng nguyên tử khối trung bình của Ne là 20,18. Giá trị số khối A của đồng vị đầu tiên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Áp dụng công thức tính nguyên tử khối trung bình có:
Câu 2:
Đồng (copper) có hai đồng vị bền trong tự nhiên là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,55. Phần trăm số nguyên tử của mỗi đồng vị 63Cu và 65Cu lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Gọi % số nguyên tử của mỗi đồng vị 63Cu và 65Cu lần lượt là x và y (%).
Theo bài ra, ta có hệ phương trình:
Vậy phần số nguyên tử của mỗi đồng vị 63Cu và 65Cu lần lượt là 72,5 và 27,5.
Câu 3:
Trong tự nhiên copper (kí hiệu: Cu hay còn gọi là đồng) có hai đồng vị là chiếm 73% và . Nguyên tử khối trung bình của nguyên tố Cu là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Áp dụng công thức tính nguyên tử khối trung bình là có:
Câu 4:
Chlorine có hai đồng vị bền trong tự nhiên, trong đó có một đồng vị là 35Cl chiếm 77,5% số nguyên tử. Biết nguyên tử khối trung bình của chlorine là 35,45. Đồng vị còn lại là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Gọi đồng vị còn lại của chlorine là ACl, chiếm: 100% - 77,5% = 22,5% (số nguyên tử).
Nguyên tử khối trung bình của chlorine là 35,45.
® ® A = 37.
® Đồng vị còn lại là 37Cl.
Câu 5:
Biết rằng khí hiếm argon (kí hiệu Ar) có 3 đồng vị: (0,3%); (0,06%); (99,6%). Nguyên tử khối trung bình của argon là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 6:
Nguyên tố R có hai đồng vị, nguyên tử khối trung bình là 79,91. Một trong hai đồng vị là (chiếm 54,5%). Nguyên tử khối của đồng vị thứ hai là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Một cách gần đúng, coi nguyên tử khối xấp xỉ số khối.
Gọi nguyên tử khối của đồng vị thứ 2 là R2.
Áp dụng công thức tính nguyên tử khối trung bình ta có:Vậy nguyên tử khối của đồng vị thứ hai là 81.
Câu 7:
Trong tự nhiên nguyên tố chlorine (kí hiệu Cl) có 2 đồng vị: và chiếm 75%. Nguyên tử khối trung bình của nguyên tố chlorine là 35,5. Biết rằng . Hai đồng vị của chlorine là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Theo giả thiết ta có hệ phương trình:
Vậy hai đồng vị của chlorine là và .
Câu 8:
Trong tự nhiên iron (kí hiệu Fe hay gọi là sắt) có hai đồng vị là và . Nguyên tử khối trung bình của Fe bằng 55,85. Thành phần phần trăm số nguyên tử của mỗi đồng vị và lần lượt là
 Xem đáp án
Xem đáp án
Gọi x là % số nguyên tử đồng vị , suy ra (100 – x) là % số nguyên tử đồng vị .
Áp dụng công thức tính nguyên tử khối trung bình có:
Vậy x = 15%
% số nguyên tử đồng vị ![]() : 100% – 15% = 85%.
: 100% – 15% = 85%.
Câu 9:
Chlorine là một nguyên tố có trong nhựa Polivinyl chloride (PVC), đây là một loại nhựa nhiệt dẻo được tạo thành từ phản ứng trùng hợp Vinyl chloride (CH2=CHCl). PVC là chất rắn vô định hình, cách điện tốt, khá trơ về mặt hóa học, dùng làm ống dẫn nước, vật liệu cách điện, gạch lát sàn trong xây dựng, ... Nguyên tử khối trung bình của chlorine là 35,5. Điều này cho biết về sự phong phú tương đối của hai đồng vị và có trong tự nhiên của Chlorine. Thành phần trăm số nguyên tử mỗi đồng vị của và lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Gọi phần trăm số nguyên tử của mỗi đồng vị và lần lượt là x và y.
Theo bài ra ta có hệ phương trình:
Câu 10:
Trong tự nhiên nguyên tố hydrogen có 3 đồng vị: . Hỏi có bao nhiêu loại phân tử H2 được tạo thành từ các loại đồng vị trên?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Viết lại phân tử H2 thành 2 nguyên tử H liên kết với nhau để tạo một phân tử H2.
Số cách chọn 2 nguyên tử H là: 6 cách:
Câu 11:
Trong tự nhiên hydrogen có 3 đồng vị: . Oxygen có 3 đồng vị . Hỏi có bao nhiêu loại phân tử H2O được tạo thành từ các loại đồng vị trên?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Viết lại phân tử H2O thành 2 nguyên tử H liên kết với 1 nguyên tử O để tạo nên phân tử nước:
+ Số cách chọn nguyên tử O là 3 cách chọn tương ứng với 3 đồng vị .
+ Số cách chọn 2 nguyên tử H là: 6 cách.
Vậy có 6.3 = 18 phân tử nước được tạo thành.
Câu 12:
Nguyên tố potassium (kí hiệu: K) có các đồng vị: (chiếm 93,258%), (chiếm 0,012%) và (chiếm 6,730%). Nguyên tử khối trung bình của potassium là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nguyên tử khối trung bình của potassium là:
Câu 13:
Nguyên tố chlorine (kí hiệu: Cl) có hai đồng vị bền với tỉ lệ phần trăm số nguyên tử tương ứng là: chiếm 75,77% và chiếm 24,23%. Trong phân tử CaCl2, % khối lượng của là (biết nguyên tử khối trung bình của Ca là 40)
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tử khối trung bình của chlorine là:
Phân tử khối của CaCl2 là: 40 + 35,4846.2 = 110,9692
Vậy
Câu 14:
Trong tự nhiên nguyên tố copper (kí hiệu: Cu) có 2 đồng vị là và , trong đó đồng vị chiếm 27% về số nguyên tử. Phần trăm khối lượng của trong phân tử Cu2O là (biết rằng nguyên tử khối của O bằng 16)
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nguyên tử khối trung bình của copper là:
Phân tử khối của Cu2O là: 2.63,54 + 16 = 143,08.
Phần trăm khối lượng của trong phân tử Cu2O là:
Câu 15:
Trong tự nhiên, zirconium (kí hiệu Zr) khi phân tích phổ khối lượng như biểu đồ và bảng sau:
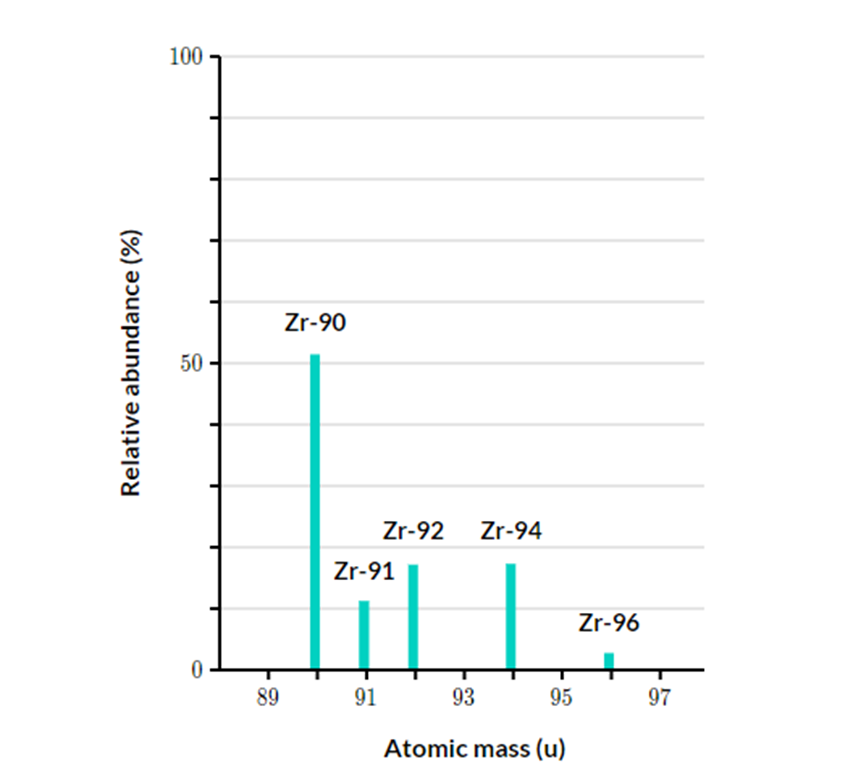
|
Khối lượng nguyên tử (m) |
90 |
91 |
92 |
94 |
96 |
|
% đồng vị |
51,45 |
11,22 |
17,15 |
17,38 |
2,8 |
Nguyên tử khối trung bình của zirconium là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tử khối trung bình của zirconium là
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Gọi % số nguyên tử của đồng vị là x (%)
⇒ % số nguyên tử của đồng vị là là (100 - x) %
Áp dụng công thức tính nguyên tử khối trung bình ta có:
Giả sử có 1 mol KClO4 thì tổng số mol các đồng vị của K là 1 mol, trong đó số mol của là mol
Vậy thành phần phần trăm về khối lượng của có trong KClO4 là
Câu 17:
Một nguyên tố X gồm hai đồng vị là X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng % các đồng vị trong X bằng nhau và các loại hạt trong X1 cũng bằng nhau. Nguyên tử khối trung bình của X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Vì các hạt trong đồng vị X1 bằng nhau nên: P = E = N = = 6
⇒ Số khối của đồng vị X1 là: P + N= 12
⇒ Số khối của đồng vị X2 là: 20 – 6 = 14
⇒
