Trắc nghiệm Hóa 10 Dạng Dạng 6. Bài tập xác định cấu hình electron nguyên tử, ion có đáp án
-
2470 lượt thi
-
16 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Cấu hình electron của nguyên tử có Z = 16 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tử có Z = 16 nên nguyên tử có 16 electron.
⇒ Cấu hình electron là 1s22s22p63s23p4.
Câu 2:
Nguyên tố X có số hiệu nguyên tử bằng 14. Electron cuối cùng của nguyên tử nguyên tố X điền vào lớp, phân lớp nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
X có số electron = số hiệu nguyên tử = 14.
⇒ Cấu hình electron nguyên tử X là: 1s22s22p63s23p2
⇒ Electron cuối cùng điền vào lớp M (n = 3), phân lớp p.
Câu 3:
Nguyên tử của nguyên tố M có số hiệu nguyên tử là 8. Số electron độc thân của M là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron nguyên tử M: 1s22s22p4
Cấu hình electron lớp ngoài cùng biểu diễn trên AO là:
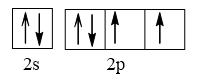
⇒ M có 2 electron độc thân.
Câu 4:
Nguyên tử của nguyên tố M có số hiệu nguyên tử bằng 20. Cấu hình electron của ion M2+ là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron của M (Z = 20) là: 1s22s22p63s23p64s2
Nguyên tử M nhường 2 electron để tạo thành ion M2+
⇒ Cấu hình electron của ion M2+ là 1s22s22p63s23p6
Câu 5:
Anion X2- có cấu hình electron là 1s22s22p6. Cấu hình electron của X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tử X nhận 2 electron để tạo thành anion X2-
⇒ Cấu hình electron của X là 1s22s22p4.
Câu 6:
Nguyên tử của nguyên tố Y có 14 electron ở lớp thứ ba. Cấu hình electron của nguyên tử Y là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các electron được điền vào các lớp và phân lớp theo mức năng lượng như sau:
1s22s22p63s23p64s23d6
⇒ Cấu hình electron nguyên tử Y: 1s22s22p63s23p63d64s2
Câu 7:
Nguyên tử của nguyên tố X có electron cuối cùng điền vào phân lớp 3p1. Nguyên tử của nguyên tố Y có electron cuối cùng điền vào phân lớp 3p3. Số hiệu nguyên tử của X và Y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron của X là: 1s22s22p63s23p1
⇒ Số hiệu nguyên tử X = số electron = 13
Cấu hình electron của Y là: 1s22s22p63s23p3
⇒ Số hiệu nguyên tử Y = số electron = 15.
Câu 8:
Tổng số hạt cơ bản của nguyên tử X là 13. Cấu hình electron của nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Với các nguyên tử bền ta có: (1)
Theo bài ra có:
2Z + N = 13 ⇒ N = 13 – 2Z, thay vào (1) ta có:
⇔ Z ≤ 13 – 2Z ≤ 1,52Z
⇔ 3,69 ≤ Z ≤ 4,33
Mà Z nguyên, dương nên Z = 4 thỏa mãn ⇒ N = 5.
⇒ Cấu hình electron của nguyên tử X là 1s22s2.
Câu 9:
Cho nguyên tử R có tổng số hạt cơ bản là 46, số hạt mang điện nhiều hơn số hạt không mang điện là 14. Cấu hình electron nguyên tử của R là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Gọi số hạt proton, neutron và electron trong R lần lượt là P, N, E.
Tổng số hạt cơ bản trong R là 46 nên ta có:
P + E + N = 46 hay 2P + N = 46 (1)
Trong R, số hạt mang điện nhiều hơn số hạt không mang điện là 14 nên:
P + E – N = 14 hay 2P – N = 14 (2)
Từ (1) và (2) ⇒ P = E = 15, N = 16
Cấu hình electron nguyên tử của R là: [Ne]3s22p3
Câu 10:
Trong các nguyên tử N (Z = 7), O (Z = 8), F (Z = 9) và Ne (Z = 10), nguyên tử có nhiều electron độc thân nhất là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron N theo orbital:
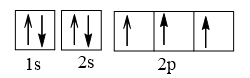
Cấu hình electron O theo orbital:
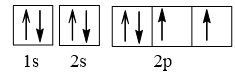
Cấu hình electron F theo orbital:
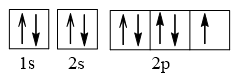
Cấu hình electron Ne theo orbital:
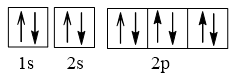
Vậy nguyên tử N có nhiều electron độc thân nhất (3 electron độc thân).
Câu 11:
Nguyên tử của nguyên tố phosphorus (Z = 15) có số electron độc thân là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình electron của P (Z = 15): 1s22s22p63s23p3.
Sự phân bố các electron vào AO:
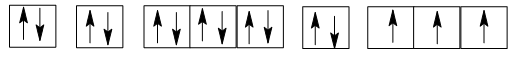
Nguyên tử của nguyên tố phosphorus (Z = 15) có số electron độc thân là 3.
Câu 12:
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y có một electron ở lớp ngoài cùng 4s. Nguyên tử X và Y có số electron hơn kém nhau là 3. Nguyên tử X, Y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Nguyên tử của nguyên tố Y có một electron ở lớp ngoài cùng 4s nên cấu hình electron nguyên tử Y là: 1s22s22p63s23p64s1.
Suy ra, Y là kim loại do có 1 electron ở lớp ngoài cùng.
- Nguyên tử X và Y có số electron hơn kém nhau là 3 nên số electron của X là:
19 – 3 = 16.
Cấu hình electron của X: 1s22s22p63s23p4. X là phi kim do có 6 electron ở lớp ngoài cùng.
Câu 13:
Hợp kim cobalt được sử dụng rộng rãi cho các bộ phận động cơ máy bay vì độ bền nhiệt độ cao là một yếu tố quan trọng. Nguyên tử cobalt có cấu hình electron ngoài cùng là 3d74s2. Số hiệu nguyên tử của cobalt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình electron nguyên tử cobalt: 1s22s22p63s23p63d74s2.
Vậy cobalt có 27 electron, số hiệu nguyên tử là 27.
Câu 14:
Nguyên tử của nguyên tố nào sau đây có 3 electron thuộc lớp ngoài cùng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Cấu hình electron của Na (Z = 11) là 1s2 2s2 2p6 3s1 ⇒ Nguyên tử Na có 1 electron lớp ngoài cùng.
- Cấu hình electron của N (Z = 7) là 1s2 2s2 2p3 ⇒ Nguyên tử N có 5 electron lớp ngoài cùng.
- Cấu hình electron của Al (Z = 13) là 1s2 2s2 2p6 3s2 3p1 ⇒ Nguyên tử Al có 3 electron lớp ngoài cùng.
- Cấu hình electron của C (Z = 6) là 1s2 2s2 2p2 ⇒ Nguyên tử C có 4 electron lớp ngoài cùng.
Câu 15:
Nguyên tử của nguyên tố potassium có 19 electron. Ở trạng thái cơ bản, potassium có số orbital chứa electron là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cấu hình electron của potassium là 1s2 2s2 2p6 3s2 3p6 4s1 có thể được biểu diễn theo ô orbital như sau:
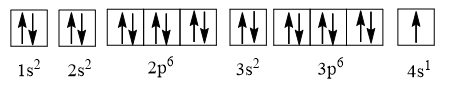
⇒ Potassium có 10 orbital chứa electron.
Câu 16:
Nguyên tử của nguyên tố sodium (Z = 11) có cấu hình electron là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số electron = Z = 11
⇒ Cấu hình electron của nguyên tử là 1s2 2s2 2p6 3s1.
