Trắc nghiệm Hóa 10 Dạng 7. Ảnh hưởng của liên kết hydrogen và tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi các chất có đáp án
-
2059 lượt thi
-
15 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
So với lực kiên kết ion, liên kết cộng hóa trị hay liên kết kim loại thì tương tác giữa các phân tử
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Lực tương tác giữa các phân tử yếu hơn rất nhiều so với lực liên kết ion, liên kết cộng hóa trị hay liên kết kim loại. Một số tương tác điển hình giữa các phân tử là liên kết hydrogen và tương tác van der Waals.
Câu 2:
Liên kết hydrogen là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
Liên kết hydrogen thường được kí hiệu là dấu ba chấm (…), rải đều từ nguyên tử H đến nguyên tử tạo liên kết hydrogen với nó.
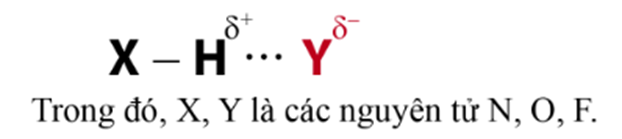
Câu 3:
Liên kết hydrogen thường biểu diễn bằng
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Liên kết hydrogen thường biểu diễn bằng dấu ba chấm (…).
Ví dụ:

Câu 4:
Tương tác van der Waals là một loại liên kết
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
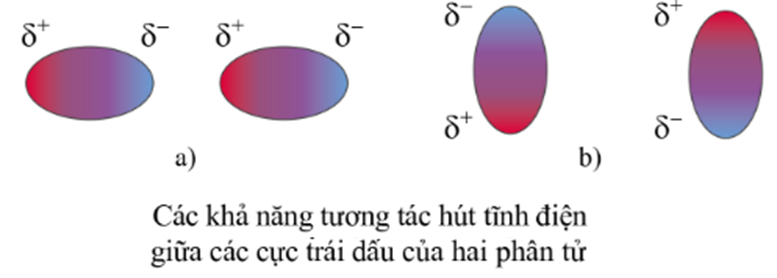
Tương tác van der Waals là một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử.
Câu 5:
Liên kết hydrogen làm
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
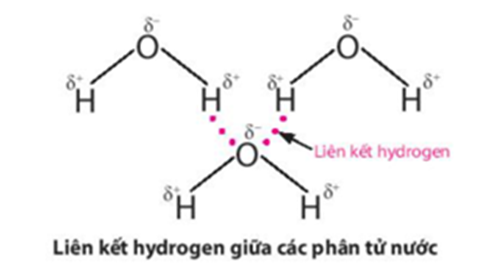
Lực hút tĩnh điện giữa nguyên tử H mang một phần điện tích dương (linh động) của phân tử H2O này với nguyên tử oxygen mang một phần điện tích âm của phân tử H2O khác, tạo thành liên kết yếu giữa các phân tử nước, gọi là liên kết hydrogen:
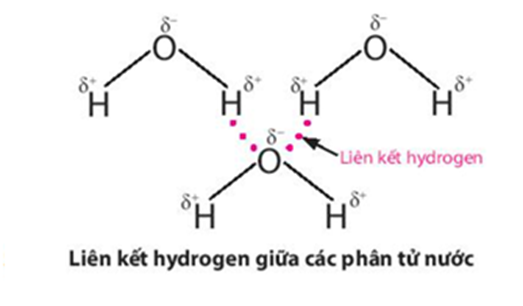
Liên kết hydrogen làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của nước.
Câu 6:
Liên kết hydrogen và tương tác van der Waals ảnh hưởng như thế nào đến nhiệt độ nóng chảy và nhiệt độ sôi của các chất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Liên kết hydrogen và tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Trong đó, liên kết hydrogen có ảnh hưởng mạnh hơn.
Câu 7:
Khi khối lượng phân tử tăng, kích thước phân tử tăng thì
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Tương tác van der Waals là một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử.
Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
Câu 8:
Liên kết hydrogen không được hình thành giữa hai phân tử nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Liên kết hydrogen là liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
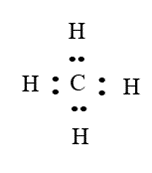
Nguyên tử H của phân tử H2O không tạo được liên kết hydrogen với nguyên tử C của CH4 vì nguyên tử C của phân tử CH4 không còn cặp electron riêng.
Câu 9:
Giải thích vì sao cùng là phân tử phân cực, ở nhiệt độ phòng, fluorine, chlorine là những chất khí còn bromine là chất lỏng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cùng là phân tử phân cực, ở nhiệt độ phòng, fluorine, chlorine là những chất khí còn bromine là chất lỏng. Như vậy, ở trạng thái lỏng, giữa các phân tử bromine tồn tại một tương tác yếu. Tương tác yếu đó gọi là tương tác van der Waals.
Câu 10:
Khí hiếm nào sau đây có nhiệt độ sôi thấp nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
Vậy:
Trong nhóm VIIIA, theo chiều tăng dần của điện tích hạt nhân (từ He đến Rn), khối lượng nguyên tử tăng ® Tương tác van der Waals tăng ® Nhiệt độ nóng chảy và nhiệt độ sôi tăng.
® So sánh nhiệt độ sôi: Ne < Ar < Xn < Kr.
Câu 11:
Giải thích vì sao ở điều kiện thường nước ở thể lỏng, có nhiệt độ sôi cao (100oC).
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nhờ liên kết hydrogen ở điều kiện thường nước ở thể lỏng, có nhiệt độ sôi cao (100oC).
Câu 12:
Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng, đó là do tồn tại
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng. Như vậy, ở nhiệt độ thấp, giữa các nguyên tử khí hiếm tồn tại một tương tác yếu để giữ các nguyên tử khí hiếm lại với nhau trong trạng thái lỏng. Tương tác đó cũng là tương tác van der Waals.
Câu 13:
Giải thích vì sao tính acid của HF yếu hơn rất nhiều so với các acid HCl, HBr, HI.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Do trong các phân tử HF có liên kết hydrogen làm giảm tính acid của HF nên HF là axit yếu.
Sơ đồ liên kết hydrogen giữa các phân tử hydrogen fluoride: …F-H…F-H…
Câu 14:
Nhiệt độ nóng chảy và nhiệt độ sôi của chất
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Để một chất có thể nóng chảy hoặc sôi, cần phải cung cấp năng lượng để phá vỡ liên kết giữa các phân tử và cung cấp động năng để phân tử chuyển động. Nhiệt độ nóng chảy và nhiệt độ sôi của chất phụ thuộc chủ yếu vào hai yếu tố:
(1) Khối lượng phân tử: Khối lượng phân tử càng lớn thì càng cần nhiều động năng để chuyển động nên nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
(2) Liên kết giữa các phân tử: Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì càng cần nhiều năng lượng để phá vỡ liên kết giữa chúng. Khi đó, nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng cao.
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Liên kết cộng hóa trị có cực là nguyên nhân dẫn đến sự phân cực ở các phân tử HCl, SO2.
