Đề thi Học kì 2 Hóa 10 cực hay có đáp án (Đề 1)
-
8926 lượt thi
-
20 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Cấu hình electron lớp ngoài cùng tổng quát của nguyên tử các nguyên tố nhóm VIA là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các nguyên tố nhóm VIA có cấu hình electron lớp ngoài cùng là ns2np4.
Câu 2:
Clorua vôi có ứng dụng nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Một lượng lớn clorua vôi được dùng để tinh chế dầu mỏ.
Câu 3:
Cấu hình electron nguyên tử của Cl (Z = 17) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình electron nguyên tử của Cl (Z = 17) là 1s22s22p63s23p5.
Câu 4:
Khí SO2 đóng vai trò là chất oxi hóa trong phản ứng nào sau đây ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Vậy trong phản ứng này SO2 thể hiện tính oxi hóa.
Câu 5:
Axit nào sau đây có khả năng ăn mòn thủy tinh ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- HF (axit flohiđric) là axit yếu nhưng có tính chất đặc biệt là ăn mòn các đồ vật bằng thuỷ tinh.
4HF + SiO2 ® SiF4 + 2H2O
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
tấn
FeS2 → 2H2SO4
120 196
mlí thuyết ← 98 tấn
⇒ tấn
Mà H = 90% → tấn
Mà quặng pirit chứa 96% FeS2
→ mquặng = tấn
Câu 7:
Cho 5 gam kẽm viên vào cốc đựng 50 ml dung dịch H2SO4 4M ở nhiệt độ thường (25oC). Trường hợp nào sau đây tốc độ phản ứng không đổi?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Các yếu tố ảnh hưởng đến tốc độ của phản ứng là:
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
- Khi tăng áp suất, nồng độ chất khí tăng theo, nên tốc độ phản ứng tăng.
- Khi tăng nhiệt độ tốc độ phản ứng tăng.
- Khi tăng diện tích tiếp xúc của các chất phản ứng, tốc độ phản ứng tăng.
- Chất xúc tác làm tăng tốc độ phản ứng.
Vậy :
- Đáp án A loại vì kẽm bột sẽ tiếp xúc với H2SO4 nhiều hơn nên tốc độ phản ứng tăng.
- Đáp án B loại vì tăng nhiệt độ thì tốc độ phản ứng tăng.
- Đáp án C: Dùng gấp đôi H2SO4 nhưng nồng độ không thay đổi thì sẽ không làm thay đổi tốc độ phản ứng (Chọn)
- Đáp án D loại vì thay bằng H2SO4 có nồng độ thấp hơn thì phản ứng sẽ xảy ra chậm hơn.
Câu 8:
Cho cân bằng hóa học: PCl5 (k) PCl3 (k) + Cl2 (k) ; ∆H > 0
Cân bằng chuyển dịch theo chiều thuận khi
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Đáp án A thêm PCl3 vào hệ phản ứng thì cân bằng chuyển dịch theo chiều giảm nồng độ PCl3⇒ cân bằng chuyển dịch theo chiều nghịch. (loại)
- Đáp án B tăng nhiệt độ của hệ phản ứng thì cân bằng sẽ chuyển dịch theo chiều phản ứng thu nhiệt ⇒ cân bằng chuyển dịch theo chiều thuận.
- Đáp án C khi tăng áp suất của hệ phản ứng thì cân bằng sẽ chuyển dịch theo chiều giảm áp suất, tức là cân bằng chuyển dịch theo chiều nghịch. (loại)
- Đáp án D thêm Cl2 vào hệ phản ứng thì cân bằng chuyển dịch theo chiều giảm nồng độ Cl2⇒ cân bằng chuyển dịch theo chiều nghịch. (loại)
Câu 9:
Cho cân bằng hóa học (trong bình kín):
CO (k) + H2O (k) CO2 (k) + H2 (k) ; ∆H < 0
Trong các yếu tố: (1) tăng nhiệt độ; (2) thêm một lượng hơi nước; (3) thêm một lượng H2; (4) tăng áp suất chung của hệ; (5) dùng chất xúc tác.
Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Vì tổng số mol khí ở hai vế là bằng nhau, do đó khi thay đổi áp suất chung của hệ, không làm chuyển dịch cân bằng. (loại 4)
- Chất xúc tác không làm chuyển dịch cân bằng. (loại 5)
- Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là (1), (2), (3)
Câu 10:
Số oxi hóa của Cl trong hợp chất HClO là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Số oxi hóa của Cl trong hợp chất HClO là +1
Câu 11:
Dãy axit nào sau đây được sắp xếp đúng theo thứ tự lực axit tăng dần ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Dãy các axit HX từ HF đến HI thì tính axit tăng dần
Câu 12:
Phản ứng của cặp chất nào sau đây xảy ra ở điều kiện thường là phản ứng thuận nghịch ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cl2 + H2O HCl + HClO
Câu 13:
Dùng không khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào ảnh hưởng đến tốc độ phản ứng ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Không khí trước khi thổi vào lò luyện gang được nén lại để làm tăng áp suất, và được thổi qua bề mặt nóng của than cốc. Nên yếu tố ảnh hưởng đến tốc độ phản ứng là nhiệt độ và áp suất.
Câu 14:
Dãy nào sau đây được sắp xếp đúng theo thứ tự giảm dần tính oxi hóa của các đơn chất halogen ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Đi từ Flo đến Iot tính oxi hoá giảm dần
Câu 15:
Cho cân bằng sau trong bình kín:
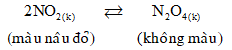
Biết khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần (NO2 mất bớt năng lượng). Phản ứng thuận có
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Khi hạ nhiệt độ của bình thì màu nâu đỏ nhạt dần, tức là cân bằng chuyển dịch theo chiều thuận.
- Khi hạ nhiệt độ thì cân bằng chuyển dịch theo phản ứng tỏa nhiệt.
⇒ Phản ứng thuận là phản ứng tỏa nhiệt, ΔH < 0
Câu 16:
Hòa tan hoàn toàn 7,8 gam hỗn hợp Mg và Al bằng dung dịch HCl dư. Sau phản ứng thấy khối lượng dung dịch tăng thêm 7,0 gam so với ban đầu. Khối lượng Al và Mg trong hỗn hợp đầu lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Kim loại + HCl → muối + H2↑
Gọi số mol của Mg và Al lần lượt là x (mol) và y (mol)
mdung dịch tăng = mkim loại – mH2
Theo bài ra ta có hệ phương trình:
Câu 17:
Dãy chất gồm những chất vừa thể hiện tính oxi hóa, vừa thể hiện tính khử là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Đáp án A loại vì H2SO4 chỉ có tính oxi hoá không có tính khử.
- Đáp án B loại vì SO3 không có tính khử.
- Đáp án C loại vì F2 chỉ có tính oxi hoá.
Câu 18:
Cho 20,8 gam hỗn hợp gồm Cu và CuO tác dụng với dung dịch H2SO4 đặc nóng dư thì thu được 4,48 lít một khí không màu, mùi hắc (sản phẩm khử duy nhất, ở đktc). Thành phần phần trăm khối lượng CuO trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Khí không màu, mùi hắc là SO2.
CuO + H2SO4 đặc, nóng → CuSO4 + H2O
Cu + 2H2SO4 đặc, nóng → CuSO4 + H2O + SO2↑
Bảo toàn electron ta có:
Câu 19:
Nhiệt phân 3,634 gam KMnO4 thu được V ml khí O2 (ở đktc), biết phản ứng xảy ra hoàn toàn. Giá trị V là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
2KMnO4 K2MnO4 + MnO2 + O2↑
0,023 → 0,0115
Câu 20:
Dung dịch thuốc thử nào sau đây có thể dùng để phân biệt dung dịch NaCl với dung dịch NaBr ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Sử dụng dung dịch AgNO3.
+ Xuất hiện kết tùa trắng: NaCl.
+ Xuất hiện kết tủa vàng: NaBr.
