Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 15)
-
6703 lượt thi
-
9 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Hoàn thành phương trình hóa học của các phản ứng theo sơ đồ sau đây (mỗi mũi tên là một phản ứng):
Fe2O3 Fe FeCl2 FeCl3
 Xem đáp án
Xem đáp án
Hoàn thành phương trình hóa học của các phản ứng theo sơ đồ sau đây (mỗi mũi tên là một phản ứng):
(1) Fe2O3 + 3CO 2Fe + 3CO2
(2) Fe + 2HCl ⟶ FeCl2 + H2
(3) 2FeCl2 + Cl2 ⟶ 2FeCl3
Câu 2:
Một số khu vực ở đồng bằng, nước bị nhiễm quá nhiều phèn sắt sẽ có màu vàng và mùi hôi tanh. Trong thành phần nước nhiễm phèn có hàm lượng khá lớn các muối sắt như FeSO4 (tầng sâu), Fe2(SO4)3 (tầng mặt). Trong dân gian, người ta sử dụng tro bếp để khử phèn trong nước, thành phần hóa chất quan trọng có trong tro bếp là K2CO3. Hãy nêu hiện tượng và viết phương trình hóa học của các phản ứng chính xảy ra khi thực hiện cách làm trên.
 Xem đáp án
Xem đáp án
Khi cho tro bếp (chứa K2CO3) vào nước nhiễm phèn
- Hiện tượng: Có kết tủa tạo thành (màu nâu đỏ) và có khí (không màu, không mùi) thoát ra.
- Phương trình hóa học:
(1) FeSO4 + K2CO3 ⟶ K2SO4 + FeCO3↓
(2) Fe2(SO4)3 + 3K2CO3 + 3H2O ⟶ 3K2SO4 + 2Fe(OH)3↓ + 3CO2↑
Câu 3:
Có 4 chất rắn (dạng bột) gồm: đá vôi, đồng(II) oxit, nhôm oxit, vôi sống. Hãy trình bày phương pháp hóa học để nhận biết mỗi chất rắn trên và viết phương trình hóa học của các phản ứng.
 Xem đáp án
Xem đáp án
- Lấy mỗi chất một ít làm chất thử.
- Cho lần lượt từng chất rắn vào 4 ống nghiệm chứa nước (dư), lắc đều. Nếu chất nào tan trong nước tạo dung dịch thì chất đó là CaO.
CaO + 2H2O → Ca(OH)2
- Cho lần lượt 3 chất rắn còn lại vào 3 ống nghiệm chứa dung dịch NaOH (dư), lắc đều. Nếu chất nào tan trong dung dịch NaOH tạo dung dịch thì chất đó là Al2O3.
Al2O3 + 2NaOH → 2NaAlO2 + H2O
- Cho lần lượt 2 chất rắn còn lại vào 2 ống nghiệm chứa dung dịch HCl (dư). Nếu chất nào tan trong dung dịch HCl tạo dung dịch không màu đồng thời có bọt khí không màu, không mùi thoát ra thì chất đó là CaCO3; chất nào tan trong dung dịch HCl tạo dung dịch có màu xanh thì chất đó là CuO.
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
CuO + 2HCl → CuCl2 + H2O
Câu 4:
Sơ đồ bên cạnh mô tả quá trình tạo ra kết tủa CaCO3 (trục tung) khi thổi từ từ khí CO2 (trục hoành) vào dung dịch nước vôi trong (Ca(OH)2).
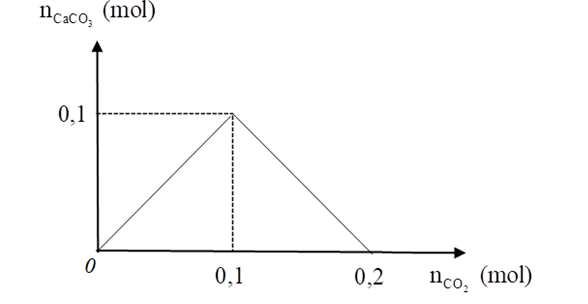
 Xem đáp án
Xem đáp án
Viết phương trình hóa học
- Khi CO2 từ 0 đến 0,1 hay số mol CO2 = 0,1 mol, xảy ra phản ứng tạo CaCO3 nhiều dần đến lớn nhất = 0,1 mol
- Khi CO2 từ 0,1 đến 0,2 hay số mol CO2 phản ứng tiếp = (0,2 – 0,1) = 0,1 mol, xảy ra phản ứng hòa tan dần dần CaCO3 cho đến hết
Câu 5:
Áp dụng sơ đồ này, khi cần có một lượng 3,5 gam CaCO3 thì phải sục vào dung dịch bao nhiêu lít khí CO2 (điều kiện tiêu chuẩn).
 Xem đáp án
Xem đáp án
Áp dụng sơ đồ này:
- Số mol Ca(OH)2 ban đầu = số mol CaCO3 lớn nhất = 0,1 mol
- Khi cần có một lượng 3,5 gam CaCO3 hay số mol CaCO3 = = 0,035 mol.
Vì số mol nên xảy ra 2 trường hợp:
+ TH1: Kết tủa CaCO3 chưa lớn nhất hay Ca(OH)2 còn dư, từ đồ thị (hoặc PTHH (1)) ta có (mol)
⇒= 22,4.0,035 = 0,784 (lít)
+ TH2: Kết tủa CaCO3 đã tan 1 phần, từ đồ thị (hoặc PTHH (1), (2)) ta có = 2.0,1 – 0,035 = 0,265 (mol)
⇒ = 22,4.0,265 = 5,936 (lít)
Câu 6:
Cho m gam hỗn hợp gồm Na và NaHCO3vào bình chứa 1 lít nước, dung dịch thu được có khối lượng tăng 10,6 gam so với ban đầu và chỉ chứa một chất tan duy nhất. Viết phương trình hóa học của các phản ứng đã xảy ra và tính nồng độ mol/lít của chất tan có trong dung dịch sau phản ứng. (Biết các phản ứng xảy ra hoàn toàn và thể tích dung dịch thay đổi không đáng kể trong quá trình phản ứng).
 Xem đáp án
Xem đáp án
Khi cho Na và NaHCO3 vào bình chứa 1 lít nước
- Phương trình hóa học:
- Vì dung dịch chỉ chứa 1 chất tan duy nhất (là Na2CO3) nên số mol Na = x (mol) thì số mol NaHCO3 = x; số mol Na2CO3 = x (mol)
- Khối lượng dung dịch tăng 10,6 gam nên ta có:
⇒ 23x + 84x - 2.0,5x = 10,6
⇒ x = 0,1 (mol)
- Nồng độ mol/lít của Na2CO3 = = 1,0 M
Câu 7:
Hỗn hợp (X) gồm Fe và Al. Cho 11 gam (X) vào một lượng dư dung dịch H2SO4 thì thoát một ra 8,96 lít khí (điều kiện tiêu chuẩn). Nếu cũng cho 11 gam (X) vào dung dịch NaOH (dư) thì được V lít khí (điều kiện tiêu chuẩn). Viết phương trình hóa học của các phản ứng đã xảy ra và tính giá trị V.
 Xem đáp án
Xem đáp án
Gọi số mol Fe, Al lần lượt là x, y (mol)
- Khi tác dụng với H2SO4
- Khi tác dụng với NaOH
- Theo phương trình (1), (2) và các dữ kiện đầu bài, ta có hệ phương trình đại số:
- Theo phương trình (3):
= 1,5y = 0,3 (mol)
⇒ V= 22,4.0,3 = 6,72 (lít)
Câu 8:
Đốt cháy hoàn toàn m gam hỗn hợp (Y) gồm etilen (C2H4) và khí hiđro thì thu được hỗn hợp gồm CO2 và H2O có khối lượng bằng nhau. Tính thành phần phần trăm về thể tích các khí trong hỗn hợp (Y).
 Xem đáp án
Xem đáp án
Gọi số mol C2H4, H2 lần lượt là x, y (mol)
- Phương trình hóa học:
- Vì nên ta có: 44.2x = 18. (2x + y)
⇒ 52x = 18y
⇒ y = x
- Thành phần % thể tích khí
Câu 9:
Đun nóng 56 lít hỗn hợp (Y) (đo ở điều kiện tiêu chuẩn) trong bình kín một thời gian, sau đó đưa hỗn hợp sản phẩm về nhiệt độ ban đầu (trước khi đun) thì thấy thể tích khí giảm 10%. Tính hiệu suất của phản ứng cộng hiđro trong thí nghiệm trên.
 Xem đáp án
Xem đáp án
Khi đun nóng 56 lít hỗn hợp (Y)
- Số mol khí = = 2,5 (mol)
- Ta có hệ phương trình đại số:
- Phương trình hóa học
CH2=CH2 + H2 CH3-CH3 (3)
- Theo phương trình, số mol H2 phản ứng = số mol khí giảm = 2,5.0,1 = 0,25 mol
⇒ Số mol C2H4 phản ứng = 0,25 mol
⇒ Hiệu suất phản ứng = =38,89%.
