Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 26)
-
6714 lượt thi
-
15 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Nung muối mangan(II) nitrat ở 300oC thu được một chất rắn A và một chất khí B màu nâu đỏ. Chất rắn A được dùng làm pin khô. Đun nóng nhẹ A với dung dịch HCl đậm đặc thu được chất C và khí D. Cho khí D phản ứng với dung dịch NaOH thu được dung dịch E. Kim loại sắt nung đỏ phản ứng với D tạo thành chất F. Dung dịch muối mangan (II) nitrat phản ứng với amoniac và cacbon đioxit tạo kết tủa G và dung dịch chứa chất tan H. Chất H thường được dùng làm phân bón hóa học. Xác định công thức từng chất và viết phương trình hóa học.
 Xem đáp án
Xem đáp án
Các phương trình phản ứng hóa học xảy ra là
1. Mn(NO3)2 MnO2 + 2NO2 ↑.
2. MnO2 + 4HClđặc MnCl2 + Cl2↑ + 2H2O.
3. Cl2 + 2NaOH → NaCl + NaClO + H2O.
4. 2Fe + 3Cl2 2FeCl3.
5. Mn(NO3)2 + NH3 + CO2 + H2O → MnCO3 + NH4NO3.
Vậy theo thứ tự các chất lần lượt là
A: MnO2 – chất làm pin khô
B: NO2 – khí màu nâu đỏ
C: MnCl2
D: Cl2
E: NaCl, NaClO, H2O – nước giaven
F: FeCl3
G: MnCO3 – chất kết tủa
H: NH4NO3 – chất dùng làm phân bón
Câu 2:
Diamoni hidrophotphat (DAP) là một loại phân bón hóa học
a) Phân bón hóa học này cung cấp nguyên tố dinh dưỡng nào cho cây trồng? Xác định hàm lượng các nguyên tố đó trong công thức của DAP?
 Xem đáp án
Xem đáp án
a) Diamoni hidrophotphat (DAP) là một loại phân bón hóa học kép có công thức hóa học là (NH4)2HPO4, nó cung cấp đồng thời 2 nguyên tố dinh dưỡng N và P cho cây trồng.
- Hàm lượng các nguyên tố có trong công thức của DAP là
+) Hàm lượng của nguyên tố N = = = 21,21%
+) Hàm lượng của nguyên tố P = = = 23,49%
+) Hàm lượng P2O5 = = = 53,78%Câu 3:
b) Trên bao bì phân bón DAP thương mại có ghi các chữ số 18 – 46 – 0. Cho biết ý nghĩa của các chữ số này? Tính các chữ số tương ứng của một mẫu DAP tinh khiết, từ đó nhận xét gì về độ tinh khiết của phân bón DAP thương mại.
 Xem đáp án
Xem đáp án
b) Trên bao bì phân bón DAP thương mại có ghi các chữ số 18 – 46 – 0 có nghĩa là trong phân bón này có 18% N, 46% P2O5 và 0% K2O.
- DAP nguyên chất chứa 21,21% N, 53,78% P2O5 và 0% K2O DAP thương mại không tinh khiết.
Câu 4:
c) DAP được điều chế từ một hợp chất có tính bazơ và một hợp chất có tính axit. Viết phương trình hóa học.
 Xem đáp án
Xem đáp án
c) 3NH3 + 2H3PO4 → (NH4)2HPO4 + NH4H2PO4.
Câu 5:
d) DAP còn được điều chế từ ure và một dung dịch axit (như câu c). Viết phương trình hóa học.
 Xem đáp án
Xem đáp án
d) H3PO4 + (NH2)2CO + 2H2O → (NH4)2HPO4 + H2CO3
Câu 6:
e) Ở 70oC, DAP phân hủy dần thành một chất khí và một chất rắn. Viết phương trình hóa học.
 Xem đáp án
Xem đáp án
e) (NH4)2HPO4 NH3 + NH4H2PO4
Câu 7:
 Xem đáp án
Xem đáp án
A MgO và A + HCl → MgCl2 + CO2 + H2O
Suy ra trong A chắc chắn có Mg, C, ngoài ra có thể có H và O.
nHCl dư = nNaOH = 0,02.2,5 = 0,05 mol
nHCl phản ứng = 0,1.2,5 – 0.05 = 0,2 mol
Bảo toàn nguyên tố Cl ta có:
nmuối = = 0,1 mol = nMg(trong A)
→ nC(trong A) = 0,08 mol
A + HCl → MgCl2 + CO2 + H2O
9,32g 0,2 mol 0,1 mol 0,08 mol
Bảo toàn khối lượng ta được:
mNước = (9,32 + 0,2.36,5) – (0,1.95 + 0,08.44) = 3,6 gam
Vậy nNước = 0,2 mol.
Bảo toàn nguyên tố H ta có
nH(trong A) + nH(trong HCl) = nH(trong nước)
→ nH(trong A) = nH(trong nước) - nH(trong HCl) = 0,2 mol
mA = mMg + mC + mH + mO
→ mO = mA – (mMg + mC + mH) = 5,76 gam → nO = 0,36 mol
Lập tỷ lệ nMg : nC : nH : nO = 0,1 : 0,08 : 0,2 : 0,36 = 5 : 4 : 10 : 18
CTPT của A là Mg5C4H10O18 vậy CTCT có thể có là:
2Mg(HCO3)2.3Mg(OH)2 hoặc 4MgCO3.Mg(OH)2.4H2O
Câu 8:
a) Thành phần chính của bông vải là gì? Viết công thức phân tử?
 Xem đáp án
Xem đáp án
a) Thành phần chính của bông vải là Xenlulozơ. Công thức phân tử là (C6H10O5)n hoặc [(C6H7O2(OH)3]n.
Câu 9:
b) Bông vải được tạo thành trong cây từ các chất nào? Viết phương trình hóa học tương ứng?
 Xem đáp án
Xem đáp án
b) Bông vải được tạo thành trong cây từ CO2, H2O thông qua quá trình quang hợp của cây nhờ chất diệp lục.
6nCO2 + 5nH2O (C6H10O5)n + 6nO2.
Câu 10:
c) Bông vải có cho phản ứng với H2SO4 đặc, nóng không? Nếu có mô tả hiện tượng và viết các phương trình hóa học.
 Xem đáp án
Xem đáp án
c) Bông vải có phản ứng với H2SO4 đặc, nóng.
- Khi cho H2SO4 đặc, nóng vào bông vải thì bông vải bị hóa đen do H2SO4 đặc có tính háo nước mạnh, nó hút hết nước của bông vải. Ngoài ra còn thấy có khí thoát ra.
(C6H10O5)n 6nC + 5nH2O.
C + 2H2SO4 đặc CO2↑ + 2SO2↑ + 2H2O.
Câu 11:
d) Cho bông vải phản ứng với hỗn hợp HNO3 và H2SO4. Viết phương trình hóa học. Để làm verni, phim, chất dẻo hàm lượng nitơ trong sản phẩm cần 12%. Đề nghị công thức hóa học của sản phẩm.
 Xem đáp án
Xem đáp án
d) [(C6H7O2(OH)3]n + 3nHNO3 [(C6H7O2(ONO2)(OH)2]n + nH2O
[(C6H7O2(OH)3]n + 3nHNO3 [(C6H7O2(ONO2)2(OH)]n + 2nH2O
[(C6H7O2(OH)3]n + 3nHNO3 [(C6H7O2(ONO2)3]n + 3nH2O
- Để làm verni, phim, chất dẻo hàm lượng nitơ trong sản phẩm cần 12%. Nghĩa là
Biện luận thấy t = 3, M = 350 g/mol (thỏa mãn)
Verni, phim, chất dẻo là polime thuộc dạng – NH – R’ – CO – NH – R’ – CO –
CTTQ có dạng R(CONH)3 nên R + 129 = 350 → R = 221
R có dạng C17H17, CTPT dạng C20H20N3O3
hoặc C16H29, CTPT dạng C19H32N3O3.
Câu 12:
Hình bên là giản đồ độ tan (g/100 g H2O) của các chất trong nước phụ thuộc vào nhiệt độ.
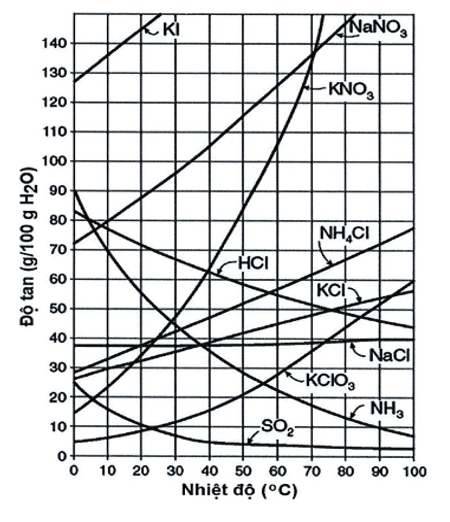
a) Cho biết khi nhiệt độ tăng, các chất nào có độ tan trong nước giảm? Vì sao?
 Xem đáp án
Xem đáp án
a) Khi nhiệt độ tăng, các chất có độ tan trong nước giảm là SO2, NH3, HCl. Vì các chất này là các chất khí. Khi nhiệt độ tăng dẫn đến động năng của chất tan ở thể khí tăng lên, các phân tử của nó có xu hướng lớn hơn để thoát khỏi lực hút của các phân tử dung môi và quay trở lại pha khí.
Câu 13:
b) Chất nào có độ tan ít phụ thuộc vào nhiệt độ nhất? Chất nào có độ tan thay đổi nhiều theo nhiệt độ nhất?
 Xem đáp án
Xem đáp án
b) Chất có độ tan ít phụ thuộc vào nhiệt độ nhất là NaCl.
Chất có độ tan thay đổi nhiều theo nhiệt độ nhất là KNO3.
Câu 14:
c) Cho 60g KNO3 vào 50g H2O. Đun nóng đến 70oC, khuấy trộn đều sau đó làm nguội và ổn định ở 20oC thấy còn m (g) chất rắn tách ra.
i. Ở 70oC, 60g KNO3 có hòa tan hoàn toàn vào lượng nước trên không?
Vì sao?
ii. Ở nhiệt độ nào dung dịch KNO3 trở nên bão hòa?
iii. Tính m?
 Xem đáp án
Xem đáp án
c)
i. Theo giản đồ ta có: Ở 70oC thì độ tan trong nước của KNO3 là 130g
→ 50 gam H2O sẽ hòa tan được x gam KNO3
x = = 65 gam
Vậy ở 70oC thì 50 gam nước có thể hòa tan được 60 gam KNO3
ii. Ở nhiệt độ bất kì nào thì dung dịch KNO3 cũng đều có thể đạt bão hòa.
iii. - Do KNO3 không ngậm nước nên = 50g
- Độ tan của 60g KNO3 ở 20oC là 35g
= 17,5 g
Vậy m = = 60 – 17,5 = 42,5g
Câu 15:
d) Lấy 5g dung dịch NH3 bão hòa ở 10oC cho vào 20g H2O ở nhiệt độ 20oC.
i. Cho biết dung dịch ở 30oC có bão hòa NH3 không? Giải thích?
ii. Ở nhiệt độ nào dung dịch NH3 thu được ở 30oC trở nên bão hòa?
iii. Muốn thu được dung dịch Nh3 bão hòa ở 30oC cần cho 5g dung dịch NH3 bão hòa ở 10oC vào bao nhiêu gam nước ở 30oC?
 Xem đáp án
Xem đáp án
d)
i. Ở 10oC, độ tan trong nước của NH3 là 70 (g/ 100g H2O)
- Gọi mNH3 (10oC) là x gam, mH2O (10oC) là y gam, ta có hệ phương trình
- Vậy = + 20 = 23 gam.
- Do NH3 không ngậm nước nên
= 23 gam
- Ở 300C, độ tan trong nước của NH3 là 70 (g/ 100g H2O), gọi là a gam, ta có: suy ra a = 10,35 gam
Vậy dung dịch ở 300C chưa bão hòa NH3
- Khối lượng NH3 cần thêm vào để dung dịch ở 30oC bão hòa NH3 là
= a - x = 10,35 – 2 = 8,35 gam
ii. Ở nhiệt độ bất kì nào thì dung dịch NH3 cũng đều có thể đạt bão hòa
iii. Ở 300C, độ tan trong nước của NH3 là 70 (g/ 100g H2O), gọi là b gam, ta có vậy b = 4,4 gam
- Vậy khối lượng nước cần thêm vào để dung dịch ở 30oC đạt bão hòa NH3 là
mnước thêm = b – = 4,4 – 3 = 1,4 gam.
