Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 21)
-
6705 lượt thi
-
11 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Cho chuỗi phản ứng sau (mỗi mũi tên ứng với một phương trình hóa học):
C2H4C2H5OHCH3COOHCH3COOC2H5 CH3COONaCH4
Viết phương trình hóa học thực hiện chuỗi phản ứng trên (ghi rõ điều kiện nếu có).
 Xem đáp án
Xem đáp án
Phương trình hóa học minh họa chuỗi phản ứng:
(1) CH2 = CH2 + H2O CH3CH2OH
(2) CH3CH2OH + O2 CH3COOH + H2O
(3) CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O
(4) CH3COOCH2CH3 + NaOH CH3COONa + H2O
(5) CH3COONa + NaOH CH4↑ + Na2CO3
Câu 2:
Viết công thức phân tử của các chất ứng với các kí hiệu X1, X2, X3, X4, X5 và hoàn thành phương trình hoá học của các sơ đồ phản ứng sau:
X1 + H2O X2 + X3↑ + H2↑
X2 + X4 BaCO3↓+ Na2CO3 + H2O
X2 + X3 X1 + NaClO + H2O
X4 + X5 BaSO4↓ + CO2↓ + H2O
 Xem đáp án
Xem đáp án
Các chất X1: NaCl; X2: NaOH; X3: Cl2; X4: Ba(HCO3)2; X5: H2SO4.
(1) 2NaCl (X1) + 2H2O 2NaOH (X2) + Cl2↑ (X3) + H2↑
(2) 2NaOH + Ba(HCO3)2 (X4) → BaCO3↓ + Na2CO3 + 2H2O
(3) 2NaOH + Cl2 → NaCl + NaClO + H2O
(4) Ba(HCO3)2 + H2SO4 (X5) → BaSO4↓ + 2CO2↓ + 2H2O
Câu 3:
Hỗn hợp X gồm MgO, Al2O3, Fe3O4, CuO. Cho khí CO dư qua X nung nóng được chất rắn Y. Hòa tan Y vào dung dịch KOH dư được dung dịch Z và chất rắn T. Hoà tan chất rắn T vào dung dịch H2SO4 loãng dư. Cho dung dịch HCl đến dư vào dung dịch Z thấy xuất hiện kết tủa, sau đó kết tủa tan dần đến hết. Viết phương trình hóa học của các phản ứng xảy ra (ghi rõ điều kiện phản ứng nếu có), biết các phản ứng xảy ra hoàn toàn.
 Xem đáp án
Xem đáp án
Các phương trình hóa học của phản ứng xảy ra:
- Cho khí CO dư qua X gồm MgO, Al2O3, Fe3O4, CuO.
(1) Fe3O4 + 4CO 3Fe + 4CO2
(2) CuO + CO Cu + CO2
- Chất rắn Y gồm gồm MgO, Al2O3, Fe, Cu tác dụng KOH dư được dung dịch Z và chất rắn T
(3) Al2O3 + 2KOH → 2KAlO2 + H2O
- Hòa tan T gồm MgO, Fe, Cu bằng dung dịch SO4 loãng, dư
(4) MgO + H2SO4 → MgSO4 + H2O
(5) Fe + H2SO4 → FeSO4 + H2 ↑
- Cho HCl đến dư vào dung dịch X gồm KAlO2, KOH dư
(6) KOH + HCl → KCl+ H2O
(7) KAlO2 + HCl → KCl + Al(OH)3↓ + H2O
(8) Al(OH)3 + 3HCl → AlCl3 + 3H2O
Câu 4:
Hình vẽ bên là thiết bị điều chế khí Y trong phòng thí nghiệm.
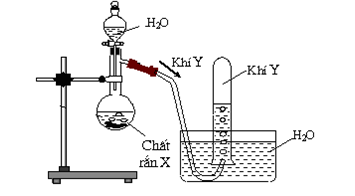
Khí Y có thể là khi nào trong 2 khí sau: metan, axetilen. Biết khí Y làm mất màu dung dịch brom.
- Xác định công thức cấu tạo của Y.
- Viết phương trình điều chế Y, phản ứng hóa học Y tác dụng với dung dịch brom dư.
 Xem đáp án
Xem đáp án
- Vì Y làm mất màu dung dịch brom, tạo ra từ chất rắn X tác dụng với H2O, không tan trong nước (thu bằng phương pháp dời nước) nên Y là axetilen.
Công thức cấu tạo của Y: CH ≡ CH.
- Phương trình hóa học:
+ Phương trình hóa học điều chế Y:
CaC2 + 2H2O → CH ≡ CH↑ + Ca(OH)2
+ Cho Y tác dụng với Br2 dư:
CH ≡ CH + 2Br2 → CHBr2 – CHBr2
Câu 5:
Hòa tan hoàn toàn 28,4 gam hỗn hợp X gồm MgCO3 và muối cacbonat của kim loại M bằng lượng vừa đủ dung dịch HCl 7,3% thu được dung dịch Y và 6,72 lít khí CO2 (ở điều kiện tiêu chuẩn). Thêm 64,8 gam nước vào dung dịch Y được dung dịch Z. Nồng độ của MgCl2 trong dung dịch Z là 5%. Xác định công thức muối cacbonat và tính thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp X.
 Xem đáp án
Xem đáp án
Hỗn hợp X gồm MgCO3 và muối cacbonat của kim loại M:
Đặt công thức của muối là M2(CO3)a; số mol MgCO3 là x (mol); M2(CO3)a là y (mol).
⇒ m = 84x + (2M + 60a)y = 28,4 (*)
Khi X tác dụng HCl
MgCO3 + 2HCl → MgCl2 + H2O + CO2 (1)
x………… 2x…….. x …………… x (mol)
M2(CO3)a + 2aHCl → 2MCla + aH2O + aCO2 (2)
y ……….. 2ay …… 2y …………….. ay (mol)
Theo phương trình hóa học (1), (2) số mol CO2 = x + ay = 0,3 (**)
Theo PTHH (1), (2) số mol HCl = 2x + 2ay = 0,6
(gam)
Bảo toàn khối lượng:
28,4 + 300 = mdd Y + 0,3.44 mdd Y = 315,2 (gam)
Khi thêm H2O vào Y: mdd Z = 315,2 + 64,8 = 380 gam
Nồng độ của MgCl2: (***)
Từ (*), (**), (***) ta có: x = 0,2; ay = 0,1; M = 28a
a = 2; M = 56 (Fe); x = 0,2; y = 0,05.
Vậy công thức muối: FeCO3
Thành phần % khối lượng mỗi chất trong X:
+
+ .
Câu 6:
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Al2O3, Al(OH)3 vào dung dịch H2SO4 loãng 20% (vừa đủ) thu được 140 gam dung dịch Y chỉ chứa muối trung hòa có nồng độ 21,375% và 2,52 lít H2 (ở điều kiện tiêu chuẩn). Viết phương trình hóa học của các phản ứng xảy ra và tính giá trị của m.
 Xem đáp án
Xem đáp án
Hòa tan hỗn hợp X gồm Al, Al2O3, Al(OH)3 vào dung dịch H2SO4 loãng.
- Phương trình hóa học xảy ra:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 ↑ (1)
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O (2)
2Al(OH)3 + 3H2SO4 Al2(SO4)3 + 6H2O (3)
Dung dịch sau phản ứng: Al2(SO4)3 có:
(mol)
Theo phương trình hóa học:
(mol)
Khối lượng dung dịch H2SO4 ban đầu:
(gam)
Bảo toàn khối lượng:
m + 128,625 = 140 + 0,1125.2 m = 11,6 (gam)
Câu 7:
Hỗn hợp X gồm hai hiđrocacbon (CnH2n+2 với n1; CmH2m-2 với m2). Đốt cháy hoàn toàn hỗn hợp X cần dùng vừa đủ 12,88 lít khí O2 (ở điều kiện tiêu chuẩn) thì thu được hỗn hợp Y gồm CO2 và 6,3 gam H2O, biết thể tích khí CO2 bằng thể tích hỗn hợp X (các khí đều đo cùng điều kiện nhiệt độ và áp suất). Dẫn toàn bộ Y nói trên vào dung dịch Ca(OH)2 dư thu được m gam kết tủa và thấy khối lượng dung dịch giảm x gam so với khối lượng dung dịch Ca(OH)2 ban đầu.
a) Xác định công thức phân tử của hai hiđrocacbon.
Câu 8:
b) Tính m, x.
 Xem đáp án
Xem đáp án
b → b → mb → (m – 1)b (mol)
Kết hợp các dữ kiện ta có hệ phương trình:
⇒ 0,05 n + 0,1 m = 0,4
Ta có các trường hợp:
Số mol CO2 = na + mb = 0,4 mol
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,04 → 0,04 mol
Vậy:
+ m = 100.0,4 = 40 gam
+ x = 40 – (44.0,4 + 6,3) = 16,1 (gam).
Câu 9:
Lên men m gam glucozơ thành rượu etylic với hiệu suất phản ứng 90%. Hấp thụ toàn bộ khí CO2 sinh ra vào dung dịch Ba(OH)2, thu được 98,5 gam kết tủa và dung dịch X. Cho từ từ dung dịch NaOH vào dung dịch X, đến khi kết tủa lớn nhất thì cần ít nhất 100 ml dung dịch NaOH 1M. Tính giá trị của m.
 Xem đáp án
Xem đáp án
; nNaOH = 0,1 x 1 = 0,1 (mol)
Phương trình hóa học:
C6H12O6 2C2H5OH + 2CO2 (1)
0,35 ← 0,7 (mol)
CO2 + Ba(OH)2 → BaCO3↓ + H2O (2)
0,5 ← 0,5 (mol)
2CO2 + Ba(OH)2 → Ba(HCO3)2 (3)
0,2 ← 0,1 (mol)
Ba(HCO3)2 + NaOH → BaCO3↓ + NaHCO3 + H2O (4)
0,1 ← 0,1 (mol)
Theo phương trình hóa học số mol CO2 = 0,7 (mol) nên số mol glucozơ phản ứng là 0,35 (mol)
Vậy (gam).
Câu 10:
Hòa tan m gam hỗn hợp X gồm FeO, Fe3O4, Fe(OH)2, FeCO3 (trong đó số mol Fe3O4 bằng tổng số mol hỗn hợp) vào dung dịch H2SO4 đặc, nóng dư, khi phản ứng xảy ra hoàn toàn thu được dung dịch Y chứa (m + 104,4) gam muối sunfat và 10,08 lít hỗn hợp khí Z (ở điều kiện tiêu chuẩn) gồm CO2 và SO2 (sản phẩm khử duy nhất), Z có tỉ khối so với khí hiđro bằng . Viết phương trình hóa học của các phản ứng xảy ra và tính giá trị của m.
 Xem đáp án
Xem đáp án
Gọi a, b lần lượt là số mol CO2; SO2, ta có
Bảo toàn C:
Gọi số mol FeO, Fe3O4, Fe(OH)2 lần lượt là x, y, z (mol). Khi tác dụng với H2SO4 đặc, nóng, dư thì PTHH của phản ứng xảy ra như sau:
2FeO + 4H2SO4 (đặc) → Fe2(SO4)3 + SO2↑ + 4H2O (1)
x → 0,5x 0,5x (mol)
2Fe3O4 + 10H2SO4 (đặc) → 3Fe2(SO4)3 + SO2↑ + 10H2O (2)
y → 1,5y 0,5y (mol)
2Fe(OH)2 + 4H2SO4 (đặc) Fe2(SO4)3 + SO2↑ + 6H2O (3)
z → 0,5z 0,5z (mol)
2FeCO3 + 4H2SO4 (đặc) Fe2(SO4)3 + SO2↑ + 2CO2↑ + 4H2O (4)
0,15→ 0,075 0,075 0,15 (mol)
Theo bài ra, ta có hệ phương trình:
Vậy, giá trị của m = 75,6 (gam).
Câu 11:
Nhúng một thanh sắt nặng 110 gam vào 200 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,1M và AgNO3 0,1M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 111,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Tính khối lượng sắt tham gia phản ứng (biết rằng trong dung dịch không xảy ra phản ứng tạo muối Fe(NO3)3).
 Xem đáp án
Xem đáp án
Nhúng một thanh sắt vào l dung dịch hỗn hợp gồm Cu(NO3)2 và AgNO3
Phương trình hóa học xảy ra:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓ (1)
0,01 ← 0,02 → 0,02 (mol)
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓ (2)
x ← x → x (mol)
- Nếu chỉ xảy ra phản ứng (1) vừa đủ thì khối lượng thanh sau phản ứng:
110 + 0,02.108 – 0,01.56 = 111,6 < 111,72 (loại)
- Nếu xảy ra phản ứng (1) và (2) vừa đủ thì khối lượng thanh sau phản ứng:
110 + 0,02.108 + 0,02.64 – 0,03.56 = 111,76 > 111,72 (loại)
Vậy đã xảy ra hết phản ứng (1) và phản ứng (2) còn dư Cu(NO3)2.
Gọi số mol Cu(NO3)2 phản ứng là x mol.
msau = 110 + 0,02.108 + 64x – (0,01 + x).56 = 111,72
⇒ x = 0,015
Khối lượng Fe đã phản ứng:
mFe = (0,01 + 0,015).56 = 1,4 gam.
