Bộ 30 đề thi vào 10 Chuyên Hóa năm 2022-2023 có lời giải chi tiết ( Đề 20)
-
6696 lượt thi
-
23 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Xác định công thức hóa học của R1, R2, R3, R4, R5, R6 và viết các phương trình hoá học xảy ra, Ghi rõ điều kiện phản ứng (nếu có), cho biết:
a) R1 + O2 → R2 (R1 là khí không màu, mùi hắc)
 Xem đáp án
Xem đáp án
|
R1 |
R2 |
R3 |
R4 |
R5 |
R6 |
|
S |
SO2 |
H2SO4 |
Fe3O4 |
C |
CO2 |
Các phương trình hóa học:
a) S + O2 SO2
Câu 4:
d) R3 + R4 → Muối (1) + Muối (2) + H2O
 Xem đáp án
Xem đáp án
d) 4H2SO4 + Fe3O4 → Fe2(SO4)3 + FeSO4 + 4H2O
Câu 5:
e) R3 (đặc) + R5 → R2 + R6 (khí) + H2O
 Xem đáp án
Xem đáp án
e) 2H2SO4 (đặc) + C → 2SO2 + CO2 (khí) + 2H2O
Câu 6:
Sơ đồ dưới đây mô tả thí nghiệm điều chế khí Cl2 trong phòng thí nghiệm.
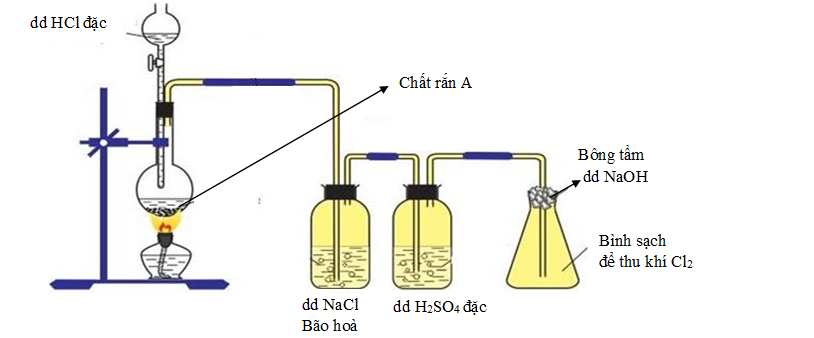
a) Cho biết chất rắn A trong bình cầu có thể là chất nào? Viết một phương trình hoá học của phản ứng xảy ra trong bình cầu.
 Xem đáp án
Xem đáp án
a. A là MnO2 hoặc KMnO4
MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Câu 7:
b) Giải thích tác dụng của các bình đựng dung dịch NaCl bão hòa, dung dịch H2SO4 đặc và nút bông tâm dung dịch NaOH.
 Xem đáp án
Xem đáp án
b. 2 bình đựng NaCl bão hoà và bình H2SO4 đặc dùng để rửa và làm khô khí.
- Bình đựng NaCl bão hoà dùng để giữ lại HCl
- Bình dung dịch H2SO4 đặc để làm khô khí, do H2SO4 đặc có tính hút ẩm.
- Nút bông tẩm dung dịch NaOH đề tránh HCl thoát ra khỏi bình thu khí.
Câu 8:
Có các chất: C2H5OH, CH3COOH, CH3COOC2H5
a) Trong điều kiện thích hợp, những chất nào trong các chất trên tác dụng được với dung dịch NaOH? Viết phương trình hoá học xảy ra.
 Xem đáp án
Xem đáp án
a) Các chất tác dụng với NaOH là: CH3COOH, CH3COOC2H5
CH3COOH + NaOH → CH3COONa + H2O
CH3COOC2H5 + NaOH CH3COONa + C2H5OH
Câu 9:
b) Bằng phương pháp hoá học hãy nhận biết các chất trên, viết phương trình hoá học minh họa.
 Xem đáp án
Xem đáp án
b)
|
Chất thử |
C2H5OH |
CH3COOH |
CH3COOC2H5 |
|
Quỳ tím |
- |
Đỏ |
- |
|
Na |
↑ |
|
- |
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Câu 10:
Giải thích các hiện tượng thực tế sau:
a) Khi nấu canh cua thấy nổi lên các mảng gạch cua.
 Xem đáp án
Xem đáp án
a) Khi nấu canh cua thấy nổi lên các mảng gạch cua là do hiện tượng động tụ protein (thịt cua là protein)
Câu 11:
b) Đoạn mía đề ngoài không khí lâu ngày, ở hai đầu đoạn mía thường có mùi của rượu etylic.
 Xem đáp án
Xem đáp án
b) Khi để ngọn mía lâu ngày trong không khí, ở đầu đoạn mía thường có mùi rượu etylic vì đoạn đầu cây mía tiếp xúc trực tiếp với không khí, trong không khí có thể có một số vi khuẩn giúp phân hủy dần saccarozơ thành glucozơ, sau đó lên men glucozơ thành rượu etylic.
Do vậy lâu ngày đoạn đầu mía thường có mùi của rượu etylic.
C12H22O11 + H2Okk → C6H12O6 (glucozơ) + C6H12O6(fructozơ)
C6H12O6 (glucozơ) 2C2H5OH + 2CO2
Câu 12:
Nêu hiện tượng và viết phương trình hoá học xảy khi tiến hành các thí nghiệm sau:
a) Cho dung dịch BaCl2 vào dung dịch NaHCO3 sau đó đun nóng.
 Xem đáp án
Xem đáp án
a) Cho dung dịch BaCl2 vào dung dịch NaHCO3 sau đó đun nóng. Xuất hiện kết tủa và sủi bọt khí
BaCl2 + 2NaHCO3 2NaCl + BaCO3↓ + CO2 ↑+ H2O
Câu 13:
b) Nhỏ vài giọt dung dịch AgNO3 vào ống nghiệm đựng 1 ml dung dịch amoniac, lắc nhẹ. Thêm tiếp 2 ml dung dịch glucozơ, sau đó đặt ống nghiệm vào cốc nước nóng.
 Xem đáp án
Xem đáp án
b) Khi thêm NH3, xuất hiện kết tủa trắng đục, sau đó kết tủa tan khi NH3 dư, tạo dung dịch trong suốt.
Nhỏ glucozơ và đưa ống nghiệm vào cốc nước nóng, sau 1 thời gian, xuất hiện lớp kim loại trắng bạc bám trên bề mặt ống nghiệm (Ag).
Phương trình hóa học:
CH2OH(CHOH)4CHO + 2AgNO3 + 3NH3 + H2O CH2OH(CHOH)4COONH4 + 2Ag↓ + 2NH4NO3
Câu 14:
Một mẫu quặng bôxit chứa Al2O3 có lẫn Fe2O3 và SiO2. Em hãy trình bày cách làm để thu được Al tinh khiết. Viết các phương trình hoá học xảy ra, ghi rõ điều kiện phản ứng nếu có.
 Xem đáp án
Xem đáp án
+ Nghiền nhỏ quặng và sau đó cho vào dung dịch NaOH loãng dư
- Lọc bỏ rắn không tan gồm có: Fe2O3 và SiO2
- Tan chỉ có Al2O3
Al2O3 + 2NaOH loãng dư → 2NaAlO2 + H2O
+ Sục lượng dư khí CO2 vào dung dịch thu được
NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
+ Lọc và tách lấy kết tủa, sau đó đem nung ngoài không khí
2Al(OH)3 Al2O3 + 3H2O
+ Lấy rắn thu được đem điện phân nóng chảy ⇒ thu được Al.
2Al2O3 4Al +3O2
Câu 15:
Viết các công thức cấu tạo dạng thu gọn có thể có của các hợp chất hữu cơ mạch hở, trong phân tử chỉ chứa liên kết đơn sau:
a) C3H8O
 Xem đáp án
Xem đáp án
* Công thức cấu tạo của C3H8O
CH3-CH2-CH2-OH
CH3-CH(OH)-CH3
C2H5-O-CH3
Câu 16:
b) C4H9Cl
 Xem đáp án
Xem đáp án
* Công thức cấu tạo của C4H9Cl
CH3– CH2– CH2– CH2Cl
CH3– CH2– CHCl – CH3
CH3 – CH(CH3) – CH2Cl
CH3 – C(CH3)Cl – CH3
Câu 17:
Cho a gam K tác dụng với 100 ml dung dịch H2SO4 0,1M, sau khi phản ứng kết thúc thu được dung dịch X và 0,56 lít (ở đktc) khí H2. Cô cạn dung dịch X thu được m gam chất rắn khan. Tìm giá trị của a và m.
 Xem đáp án
Xem đáp án
Dung dịch cô cạn có: KOH 0,03 mol; K2SO4: 0,01 mol
→ a = 0,05.39 = 1,95 gam
→ m = 0,03.56 + 174.0,01= 3,42 gam.
Câu 18:
Đốt cháy hoàn toàn một chất hữu cơ A chứa C, H, O, N (MA < 78) thu được CO2, H2O và N2. Biết rằng số mol H2O bằng 1,75 lần số mol CO2, tổng số mol CO2 và H2O bằng 2 lần số mol O3 tham gia phản ứng. Xác định công thức phân tử của A.
 Xem đáp án
Xem đáp án
Gọi công thức của A là CxHyOzNt
CxHyOzNt + O2 x CO2 + H2O + N2
a……........ a…………xa……… a……. a
Theo bài ra ta có:
a = 1,75.ax → 2y = 7x
xa + a = 2a → z = x
Thay vào A ta có → MA = 33,5x + 14t < 78
Nghiệm hợp lý là: x = 2; t = 1→ C2H7O2N
Câu 19:
Cho X và Y là các dung dịch HCl có nồng độ mol/lít khác nhau. Lấy V1 lít X trộn với V2 lít Y thu được 0,2 lít dung dịch Z.
a) Tính nồng độ mol/lít của dung dịch Z biết rằng V1 lít X phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa, V2 lít Y phản ứng vừa đủ với 20 gam dung dịch NaOH 4%.
 Xem đáp án
Xem đáp án
Gọi V1 lít X có HCl a mol/l + V2 lít Y có HCl b mol/l → 0,2 lít Z: HCl
Có V1 + V2 = 0,1 (lít)
- V1 lít X có HCl a mol/l có: nHCl = a.V1 (mol)
- V2 lít Y có HCl b mol/l có: nHCl = b.V2 (mol)
→ 0,2 lít Z: HCl có nHCl = 0,1V1 + 0,1V2
a)
* V lít X phản ứng với dung dịch AgNO3 dư thì thu được 4,305 gam kết tủa.
n↓= 0,03 (mol)
Có: a.V1 = 0,03 (V1 = )
* V2 lít Y phản ứng vừa đủ với 20 gam dung dịch NaOH 4% →mNaOH = 0,8 mol
= 0,8 mol = V2.b (V2 = )
→ nHCl = 0,1V1 + 0,1V2 = 0,03 + 0,8 = 0,83 (mol)
4,15 M
Câu 20:
b) Tính nồng độ mol/lít của dung dịch X và Y, biết rằng lượng H2 thu được khi cho 0,1 lít X phản ứng hết với Fe ít hơn lượng H2 thu được khi cho 0,1 lít Y phản ứng hết với Fe là 224 ml (ở đktc).
 Xem đáp án
Xem đáp án
b) Gọi a,b là nồng độ của 2 dung dịch. Số mol HCl có trong 100ml mỗi dung dung dịch là:
n(HCl X) = 0,1a mol và n(HCl Y) = 0,1b mol
Lượng H2 thoát ra từ 2 dung dịch chênh nhau 0,224 lít:
0,05a - 0,05b = 0,01→ a - b = ± 0,2
Thể tích dung dịch Z:
V(Z) = V1 + V2 = + = 0,2 lít
→ 0,8a + 0,03b = 0,2a.b
* TH1: a = b + 0,2
→ 0,8a + 0,03b = 0,2a.b
→ 0,2b2 – 0,79b - 0,16 = 0
→ b = 4,14 (nhận) và b = -0,19(loại)
→ a = 4,34(M)
* TH2: b = a + 0,2
→ 0,8a + 0,03b = 0,2a.b → 0,2b2 – 0,79b - 0,006 = 0
⇒ a = 3,96 hoặc a = -7,58 (loại) ⇒ b = 4,16(M)
Vậy nồng độ mol của 2 dung dich X, Y lần lượt là 4,34M và 0,414M hoặc 3,96M và 4,16M.
Câu 21:
Cho 37,95 gam hỗn hợp bột X gồm BaCO3 và RCO3 (R có hoá trị không đổi) vào cốc chứa m gam dung dịch H2SO4 loãng nồng độ 9,8%. Khuấy đều hỗn hợp cho đến khi phản ứng kết thúc thì thu được dung dịch Y, chất rắn Z và 2,8 lít (ở đktc) khí CO2. Cô cạn dung dịch Y thu được 6,0 gam muối khan, còn nung chất rắn Z đến khối lượng không đổi thu được 30,95 gam chất rắn T và khí CO2.
a) Tìm m và khối lượng chất rắn Z.
 Xem đáp án
Xem đáp án
Do chất rắn Z đến khối lượng không đổi thu được 30,95 gam chất rắn T và khí CO2. Nên trong Z chứa BaCO3 nên H2SO4 hết.
Gọi số mol của BaCO3 là a mol và RCO3 là b mol; số mol của các chất trong Z lần lượt là BaCO3 x mol, RCO3 y mol
Ta có:
- Bảo toàn C ta có:
Hay a + b = x + y + 0,125
→ a + b – (x + y) = 0,125 (1)
(sau khi nung Z) = (a + b – 0,125) mol
- Bảo toàn S ta có
(2)
- Từ (1) và (2) ta có = 0,125 (mol)
a) = 98.0,125 = 12,25 (g)
Câu 22:
b) Xác định kim loại R, biết trong X số mol của BaCO3 gấp 1,5 lần số mol RCO3.
 Xem đáp án
Xem đáp án
b) Theo bài X số mol của BaCO3 gấp 1,5 lần số mol RCO3 nên ta có: a =1,5b (3)
- Bảo toàn H ta có:
- Bảo toàn khối lượng ta có:
⇔ 37,95 + 12,25 = 6 + 30,95 + + 0,125.44 + 2,25
⇒ = 5,5 gam
⇒ = 0,125 = a + b - 0,125
⇒ a + b = 0,25 (4)
Từ (3) và (4) có a = 0,15; b = 0,1
Theo bài mx = 197a + (R + 60)b = 37,95
⇒ R = 24 là Mg
Câu 23:
Hỗn hợp A gồm CH4, C2H4, C3H4 (CH=C−CH3). Khi cho 6,4 gam hỗn hợp A vào bình đựng dung dịch Br2 (dư) thì có tối đa 0,2 mol Br2 tham gia phản ứng. Mặc khác, đốt cháy hoàn toàn 0,5 mol hỗn hợp A cần dùng vừa đủ V lít (ở đktc) khí O2 sau phản ứng thu được nước và m gam CO2. Tìm giá trị của m và V.
 Xem đáp án
Xem đáp án
Gọi số mol của CH4, C2H4, C3H4 lần lượt là x, y, z mol
-Theo bài: 6,4 gan A + 0,2 mol Br2
→ mA = 16x + 28y + 40z=6,4 gam
→ y + 2z = 0,2 mol
- Khi đốt cháy số mol của các chất trong A: CH4, C2H4, C3H4 lần lượt là ax, ay, az mol
0,5 gam A + V mol O2 m g CO2 + H2O
+ Theo bài có nA = ax + ay + az = 0,5
mA = 16ax + 28ay + 40az = a (16x + 28y + 40z) = a.6,4gam
+ Bảo toàn C có = ax + 2ay + 3az = (ax + ay + az) + (ay + 2az) = 0,5 + a.0,2 (mol)
+ Bảo toàn H có = 4ax + 4ay + 4az = 4.0,5 = 2 mol
→ = 2.18 = 36 g
+ Bảo toàn O có 2. =2. + = (1,5 + 0,2a) mol
+ Bảo toàn khối lượng có: mA + = +
hay 6,4a + 32(1,5 +0,2a) = 44(0,5 + 0,2a) + 36
→ a = 2,5
→ = 0,5 + a.0,2 = 1 mol
→ = 44 gam
→ =(1,5 + 0,2a ) = 2 mol
→ V = 2.22,4 = 44,8 lít
