- Đề số 1
- Đề số 2
- Đề số 3
- Đề số 4
- Đề số 5
- Đề số 6
- Đề số 7
- Đề số 8
- Đề số 9
- Đề số 10
- Đề số 11
- Đề số 12
- Đề số 13
- Đề số 14
- Đề số 15
- Đề số 16
- Đề số 17
- Đề số 18
- Đề số 19
- Đề số 20
- Đề số 21
- Đề số 22
- Đề số 23
- Đề số 24
- Đề số 25
- Đề số 26
- Đề số 27
- Đề số 28
- Đề số 29
- Đề số 30
- Đề số 31
- Đề số 32
- Đề số 33
- Đề số 34
- Đề số 35
- Đề số 36
Bộ đề kiểm tra định kì học kì 1 Hóa 9 có đáp án (Mới nhất) - Đề 20
-
7760 lượt thi
-
16 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Có thể chứa dung dịch H2SO4 đặc, nguội trong bình làm từ kim loại nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Kim loại sắt thụ động hóa trong H2SO4 đặc nguội nên có thể chứa H2SO4 đặc nguội trong bình chứa làm từ sắt.
Câu 2:
Nhóm kim loại nào dưới đây tác dụng với nước ở nhiệt độ thường?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các kim loại K, Na, Ca, Ba tác dụng với nước ở nhiệt độ thường tạo dung dịch kiềm và giải phóng khí hiđro.
Câu 3:
Biện pháp nào sau đây không làm giảm sự ăn mòn kim loại?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nước muối tạo môi trường thuận lợi cho kim loại dễ bị ăn mòn hơn.
Câu 4:
Trong các kim loại Cu, Na, Mg. Ni. Ag. Zn, hai kim loại dẫn điện tốt nhất là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Đàn hồi, cứng, ít bị ăn mòn là những tính chất của thép.
Câu 6:
Cho kim loại kali vào dung dịch FeCl3, hiện tượng quan sát được là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cho kali vào dung dịch FeCl2, kali tác dụng với nước trong dung dịch tạo KOH và giải phóng khí hiđro:
FeCl3 tác dụng với KOH tạo kết tủa Fe(OH)3 màu nâu đỏ.
Câu 7:
Cho hỗn hợp X gồm 31,75g FeCl2 và 24,375g FeCl3 tác dụng với dung dịch NaOH dư, để ngoài không khí một thời gian. Khối lượng kết tủa thu được là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nếu để trong không khí một thời gian sẽ tiếp tục xảy ra phản ứng:
Số mol FeCl2 là:
Theo phương trình (3), số mol Fe(OH)3 là:
Số mol FeCl3 là:
Khối lượng kết tủa Fe(OH)3 thu được là:
Câu 8:
Cho các cặp chất sau: (1) Al + H2SO4loãng; (2) Zn + CuSO4; (3) Fe + HCl; (4) Ag + HCl; (5) Cu + AgNO3; (6) Pb + FeCl2. Số sặp chất xảy ra phản ứng là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Câu 9:
Cho 3 kim loại R, M, N. Để xác định đọ hoạt động của chúng, một học sinh đã tiến hành thí nghiệm, kết quả như sau:
Thí nghiệm 1: M không đẩy được R ra khỏi dung dịch muối.
Thí nghiệm 2: M đẩy được N ra khỏi dung dịch muối nhưng không giải phóng khí khi cho tác dụng với dung dịch HCl.
Thí nghiệm 3: R tác dụng được với dung dịch HCl giải phóng khí.
Thứ tự hoạt động giảm dần của các kim loại trên là:
 Xem đáp án
Xem đáp án
Thí nghiệm 1 chứng tỏ: R hoạt động hơn M.
Thí nghiệm 2 chứng tỏ: M hoạt động hơn N, M đứng sau Hiđro trong dãy hoạt động hóa học.
Thí nghiệm 3 chứng tỏ: R đứng trước Hiđro trong dãy hoạt động hóa học.
Vậy thứ tự hoạt động giảm dần là R, (H), M, N
Câu 10:
Nguyên tố X có thể tạo thành với nhôm hợp chất có công thức hóa học tổng quát là AlaXb, mỗi phân tử gồm 5 nguyên tử, khối lượng phân tử là 150. Hỏi X là nguyên tố nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Mỗi phân tử gồm 5 nguyên tử nên a + b = 5 (1)
Khối lượng mol của AlaXb là:
Từ (1) và (2)
Lập bảng biện luận:
|
b |
1 |
2 |
3 |
4 |
|
X |
42 (loại) |
32 (nhận) |
30,75 (loại) |
30 (loại) |
Vậy X là nguyên tố lưu huỳnh.
Câu 11:
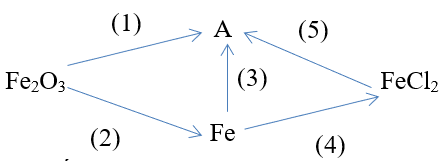
Trong 2 sơ đồ phản ứng, có thể điều chế chất A trực tiếp như sau:
A là chất nào trong các chất sau?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 12:
Cho hai lá kim loại Fe và Zn ngâm riêng trong 2 cốc đựng dung dịch CuSO4 dư. Sau một thời gian lấy các lá kim loại ra, rửa nhẹ, làm khô và cân. Khối lượng các lá kim loại thay đổi như thế nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Gọi x, y là số mol của Fe và Zn phản ứng.
Ở phản ứng (1), khối lượng đồng tạo ra là 64x, khối lượng Fe đã phản ứng là 56x, vậy khối lượng lá sắt sẽ tăng thêm là: 64x – 56x = 9x
Ở phản ứng (2), khối lượng đồng tạo ra là 64y, khối lượng Zn đã phản ứng là 65y, vậy khối lượng lá kẽm sẽ giảm đi là: 65y – 64y = y
Câu 13:
Một hỗn hợp gồm các chất Fe, Cu, Ag, Fe2O3, CuO. Dùng phương pháp hóa học, hãy tách riêng Ag tinh khiết khỏi hỗn hợp trên. Viết các phương trình hóa học minh họa.
 Xem đáp án
Xem đáp án
Cho hỗn hợp Fe, Cu, Ag, Fe2O3, CuO tác dụng với axit HCl dư, các chất Fe, Fe2O3, CuO sẽ bị hòa tan, chất rắn còn lại là Cu và Ag.
Cho chất rắn trên tác dụng với dung dịch AgNO3, vì Cu hoạt động hơn Ag nên sẽ đẩy Ag khỏi dung dịch muối. Chất rắn thu được sau cùng là Ag.
Câu 15:
Cho hỗn hợp 8,4 g sắt và 3,2 g lưu huỳnh vào bình kín, nung nóng bình đến khi phản ứng xảy ra hoàn toàn.
a) Tính khối lượng muối sunfua thu được sau phản ứng
 Xem đáp án
Xem đáp án
a)
1 1 1
Số mol Fe ban đầu là:
Số mol S ban đầu là:
Lập tỉ lệ số mol: Fe dư
Theo phương trình, số mol FeS thu được sau phản ứng là:
Khối lượng FeS là:
Câu 16:
b)* Sản phẩm thu được sau phản ứng cho tác dụng hết với dung dịch axit sunfuric loãng. Tính thể tích khí thoát ra (đktc).
 Xem đáp án
Xem đáp án
b) Hỗn hợp thu được sau phản ứng có FeS và Fe dư.
1 1
1 1
Số mol Fe đã phản ứng ở phương trình (1) là: nFe = nS = 0,1 (mol)
Số mol Fe ở phương trình (2) là: nFe (2) = 0,15 – 0,1 = 0,05 (mol)
Theo phương trình (3), số mol H2S là:
Thể tích khí thu được ở đktc là: