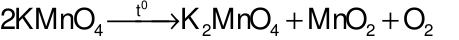Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 6)
-
6897 lượt thi
-
30 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Số oxi hoá có thể có của lưu huỳnh trong hợp chất là -2, +4, +6.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu tạo một phân tử halogen gồm 2 nguyên tử
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Trong hợp chất, nguyên tố flo chỉ có số oxi hoá là -1
Câu 4:
(a) Được dùng để sát trùng, làm sạch nước sinh hoạt.
(b) Được dùng để chữa sâu răng.
(c) Được dùng để tẩy trắng tinh bột, dầu ăn.
(d) Được dùng để bảo quản trái cây chín.
Số ứng dụng trên của ozon là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cả 4 ứng dụng trên đều là ứng dụng của ozon.
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong công nghiệp, người ta điều chế nước Giaven bằng cách điện phân dung dịch NaCl không có màng ngăn.
Phản ứng hóa học minh họa:
2NaCl + 2H2O  2NaOH + Cl2+ H2
2NaOH + Cl2+ H2
Do không có màng ngăn:
Cl2+ 2NaOH → NaCl + NaClO + H2O (nước Gia – ven)
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Dung dịch HF không được đựng bằng lọ thuỷ tinh vì HF có khả năng ăn mòn thuỷ tinh.
4HF + SiO2→ SiF4+ 2H2O
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Ở điều kiện thường, lưu huỳnh tồn tại ở trạng thái rắn.
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Dùng thuốc thử là dung dịch AgNO3
+ Không hiện tượng: NaF
NaF + AgNO3→ Không phản ứng
+ Xuất hiện kết tủa trắng: NaCl
NaCl + AgNO3→ NaNO3+ AgCl↓
+ Xuất hiện kết tủa vàng: NaBr
NaBr + AgNO3→ NaNO3+ AgBr↓
+ Xuất hiện kết tủa vàng đậm: NaI
NaI + AgNO3→ NaNO3+ AgI↓
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Sự dịch chuyển cân bằng hoá học là sự di chuyển từ trạng thái cân bằng hoá học nàysang trạng thái cân bằng hoá học khác do tác động của các yếu tố từ bên ngoài tác động lên cân bằng.
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Để vận chuyển axit sunfuric đặc, nguội có thể đựng trong bình chứa làm bằng Fe
Câu 12:
 (mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là
(mỗi mũi tên ứng với một phản ứng). Hai chất X, Y lần lượt là Xem đáp án
Xem đáp án
Đáp án đúng là: B
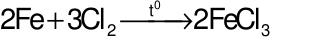
FeCl
3+ 3NaOH → Fe(OH)3↓ + 3NaClCâu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
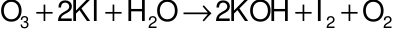
I
2sinh ra tác dụng với hồ tinh bột thấy xuất hiện màu xanh đậm.Câu 14:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khi đốt cháy axetilen để hàn, cắt kim loại, nhiệt lượng giải phóng ra lớn nhất khi axetilen cháy trong khí oxi nguyên chất
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Dung dịch H2SO4đậm đặc có thể dùng để làm khô khí Cl2ẩm. Do H2SO4đặc hút ẩm và Cl2không tác dụng với H2SO4đặc.
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Tính chất hoá học của dung dịch axit sunfuric loãng là tính axit mạnh.
Câu 17:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
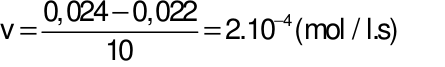
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong phản ứng: 3H2S + 2KMnO4→ 2MnO2 +2KOH + 3S↓ +2H2O
Số oxi hóa của S tăng từ -2 lên 0, do đó H2S đóng vai trò là chất khử.
Câu 19:
(a) N2(k) + 3H2(k) ⇄ 2NH3(k)
(b) H2(k) + I2(k) ⇄ 2HI (k)
(c) 2SO2(k) + O2(k) ⇄ 2SO3(k)
(d) 2NO2(k) ⇄ N2O4(k)
Khi thay đổi áp suất những số cân bằng hóa học bị chuyển dịch là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khi thay đổi áp suất, những cân bằng hoá học bị dịch chuyển là: (a), (c), (d). Đây là các cân bằng có tổng số mol khí ở hai vế là khác nhau.
Câu 20:
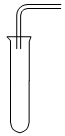
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Vì ống nghiệm ngửa nên khí thu được nặng hơn không khí
→ chọn Cl2
Câu 21:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
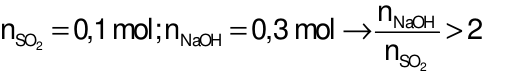
→
phản ứng sinh ra muối Na2SO3và NaOH dưCâu 22:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
CaCO3tác dụng với H2SO4đặc hay loãng đều thu được sản phẩm giống nhau.
CaCO3+ H2SO4→ CaSO4+ CO2↑ + H2O
Câu 23:
N2 (k) + 3H2 (k) ⇄ 2NH3 (k)  < 0.
< 0.
Muốn sản xuất amoniac đạt hiệu quả cao, người ta phải thay đổi các yếu tố nào sau đây ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất (chiều thuận)
Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều làm tăng nhiệt độ (chiều thuận)
Lấy NH3ra khỏi phản ứng, cân bằng chuyền dịch theo chiều làm tăng NH3(chiều thuận).
Câu 24:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Gọi số mol Al và Mg lần lượt là x và y mol
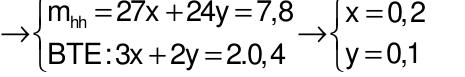
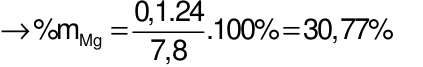
Câu 25:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Loại B, C và D do: Các chất CuSO4, Cu, H2SO4không tác dụng với HCl
Câu 26:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Bảo toàn nguyên tố S: 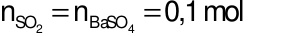
→ V = 2,24 lít
Câu 27:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Gọi số mol khí Cl2và O2lần lượt là x và y mol
→ x + y = 0,25 (1)
Bảo toàn khối lượng: mR+ mkhí= mrắn
→ mkhí= 23 – 7,2 = 15,8
→ 71x + 32y = 15,8 (2)
Từ (1) và (2) 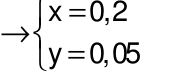
Bảo toàn e: 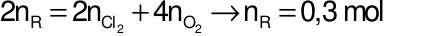
→ MR= 24 (Mg)
Câu 28:
 Xem đáp án
Xem đáp án
Đáp án đúng là:
Gọi số mol của Fe và FeO lần lượt là x và y mol
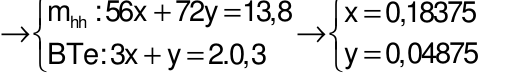
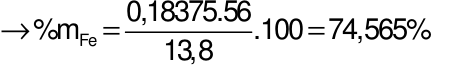
Câu 29:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Quy đổi hỗn hợp X thành Fe (a mol), O (b mol) và Cu (c mol)
→ 56a + 16b + 64c = 2,44 (1)
Bảo toàn e: 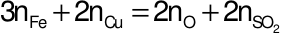
→ 3a + 2c = 2b + 0,045 (2)
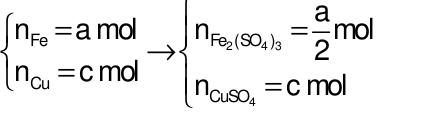
→ 200a + 160c = 6,6 (3)
Từ (1), (2), (3) → a = b = 0,025; c = 0,01 mol
→ %mCu= 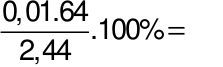 26,23%
26,23%
Câu 30:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Bảo toàn nguyên tố C: 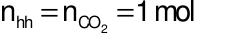
→ m = 1.100 =100 gam
Chú ý: Có phân tử khối của KHCO3và CaCO3 đều là 100 đvC.
----------- HẾT ----------