Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 3)
-
6893 lượt thi
-
20 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
Để nhận biết các dung dịch mất nhãn HCl, HI, Na2SO4dùng thuốc thử nào sau đây:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Nhỏ AgNO3vào các dung dịch HCl, HI, Na2SO4:
+ Xuất hiện kết tủa trắng thì đó là: HCl, Na2SO4
AgNO3+ HCl → AgCl↓ + HNO3
2AgNO3+ Na2SO4 → 2NaNO3+ Ag2SO4↓
+ Xuất hiện kết tủa vàng đậm là HI
AgNO3+ HI → AgI↓ + HNO3
- Cho BaCl2vào các dung dịch còn lại là HCl và Na2SO4:
+ Xuất hiện kết tủa thì đó là Na2SO4
BaCl2+ Na2SO4→ BaSO4↓ + 2NaCl
+ Không hiện tượng là HCl
Câu 2:
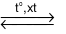 2NH3khi giảm áp suất cân bằng sẽ:
2NH3khi giảm áp suất cân bằng sẽ: Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cho phản ứng: 3H2+ N2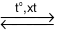 2NH3khi giảm áp suất cân bằng sẽ:
2NH3khi giảm áp suất cân bằng sẽ:
Chuyển dịch từ phải sang trái (chuyển dịch theo chiều làm tăng số mol khí)
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
2Fe + 3Cl2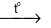 2FeCl3
2FeCl3
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số mol NaOH là: nNaOH= 0,1.0,2 = 0,02 mol
Do SO2dư nên muối thu được là: NaHSO3
Phương trình phản ứng:
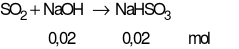
Theo phương trình phản ứng ta có:  = 0,02 mol
= 0,02 mol
Vậy khối lượng muối thu được là:  = 0,02.104 = 2,08g.
= 0,02.104 = 2,08g.
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Số oxi hóa của Clo trong các chất KClO4, HCl, NaClO lần lượt là: +7; -1; +1.
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số mol HCl là: nHCl= 0,4.0,1 = 0,04 mol suy ra 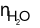 = 0,02 mol (bảo toàn H)
= 0,02 mol (bảo toàn H)
Áp dụng định luật bảo toàn khối lượng ta có: mhỗn hợp+ mHCl= mmuối+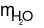
Suy ra mmuối= mhỗn hợp+ mHCl- 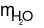 = 2,81 + 0,04.36,5 – 0,02.18 = 3,91g.
= 2,81 + 0,04.36,5 – 0,02.18 = 3,91g.
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B.
Tính oxi hóa của các halogen giảm dần theo thứ tự: F2 >Cl2 >Br2 >I2.
Câu 8:
A.5,6.
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số mol KClO3là: 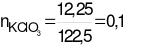 mol
mol
Phương trình phản ứng:
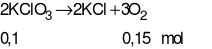
Vậy thể tích khí O2thu được là:  = 0,15.22,4 = 3,36 lít.
= 0,15.22,4 = 3,36 lít.
Câu 9:
C.12.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
KClO3+ 6HCl → 3Cl2+ KCl + 3H2O
Tổng hệ số các chất trong phản ứng sau khi cân bằng là:
1 + 6 + 3 + 1 + 3 = 14
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
2NaOH + H2SO4→ Na2SO4+ 2H2O
CuO + H2SO4→ CuSO4+ H2O
Fe + H2SO4→ FeSO4+ H2
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Tính axit giảm dần theo thứ tự: HI >HBr >HCl >HF.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
KClO3+ 6HCl → KCl + 3Cl2+ 3H2O
Tổng hệ số của các chất sản phẩm sau khi cân bằng là: 1 + 3 + 3 = 7
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Số mol khí H2là: 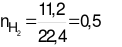 mol suy ra ne nhận = 0,5.2 = 1 mol
mol suy ra ne nhận = 0,5.2 = 1 mol
Mg → Mg+2 + 2e, Al → Al+3+ 3e, Fe → Fe+3+ 3e
2H++ 2e → H2
Bảo toàn e ta có: ne(KL nhường) =  (nhận) = 1 mol
(nhận) = 1 mol
Lại có: moxit= mKL+ mO
Bảo toàn e ta có: ne(KL nhường) = nOxi(nhận) = 1 mol
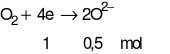
Suy ra nO (oxit) = 0,5 mol suy ra mO= 0,5.16 = 8 gam
Vậy khối lượng oxit thu được là:
moxit= mKL+ mO = 13,4 + 8 = 21,4 gam
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Axit sunfuric đặc làm khô chất: O2vì H2SO4đặc hút ẩm và O2không phản ứng với H2SO4đặc.
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số mol khí O2là: 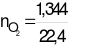 = 0,06 mol
= 0,06 mol
Phương trình phản ứng:

Vậy khối lượng KClO3là: m = 0,04.122,5 = 4,9 gam
Câu 17:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số oxi hóa của S trong các chất K2SO3, SO2, H2S lần lượt là: +4; +4; -2.
Câu 18:
A.17,8 gam.
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số mol SO2là: 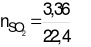 = 0,15 mol
= 0,15 mol
Sục khí SO2vào dung dịch NaOH dư tạo ra muối trung hòa Na2SO3.
Phương trình phản ứng:
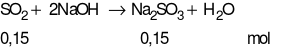
Khối lượng muối thu được là:  = 0,15.126 = 18,9 gam.
= 0,15.126 = 18,9 gam.
Câu 19:
C.Mg, NaOH, CuO.
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Mg + 2HCl → MgCl2+ H2
NaOH + HCl → NaCl + H2O
CuO + 2HCl → CuCl2+ H2O
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Có ∆H = -58KJ < 0 suy ra khi giảm nhiệt độ cân bằng sẽ chuyển dịch theo chiều thuận (chiều phản ứng tỏa nhiệt).
