Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 9)
-
6892 lượt thi
-
23 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Ở điều kiện thường: Cl2, O2ở thể khí, I2ở thể rắn, Br2ở thể lỏng.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Độ âm điện: F >Cl >Br >I.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết hoá học trong phân tử hiđro clorua (HCl) là liên kết cộng hóa trị có cực.
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Khi đun nóng, iot biến thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là sự thăng hoa.
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
S phản ứng với kim loại Hg ngay ở nhiệt độ thường: Hg + S → HgS.
Câu 6:
Na2S2O3+ H2SO4→ Na2SO4+ S↓ + SO2+ H2O
Để tốc độ phản ứng trên xảy ra nhanh hơn, có thể thực hiện phương pháp nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
Câu 7:
D. nhiều trong muối iotua, hiếm hơn muối bromua.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Iot có tính oxi hóa yếu hơn brom vì iot có bán kính lớn hơn, độ âm điện nhỏ hơn.
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Có 3 chất phản ứng được với dung dịch HCl loãng là: AgNO3, KOH, FeS.
Phương trình hóa học:
AgNO3+ HCl → AgCl↓ + HNO3
KOH + HCl → KCl + H2O
FeS + 2HCl → FeCl2+ H2S↑
Câu 9:
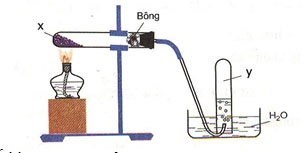
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hình vẽ trên mô tả thí nghiệm điều chế khí O2(Y) từ chất X là hợp chất giàu oxi và kém bền với nhiệt như: KMnO4, KClO3, …
Ví dụ: 2KMnO4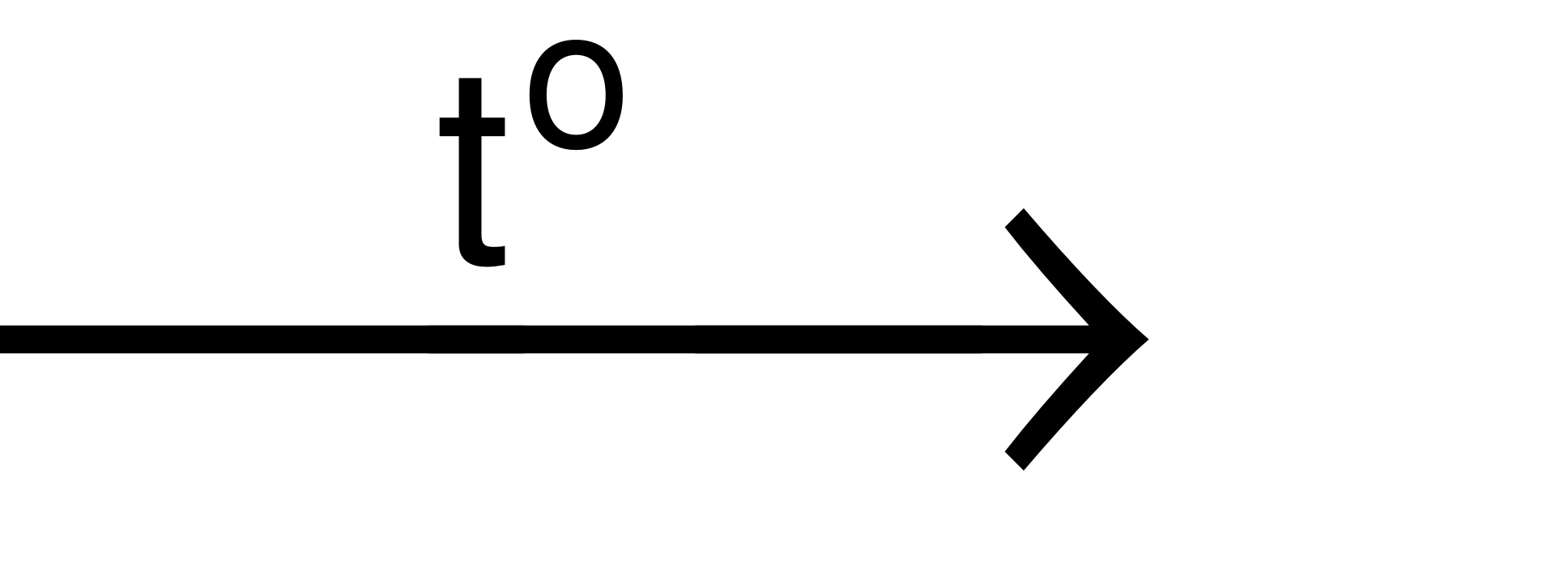 K2MnO4+ MnO2+ O2↑.
K2MnO4+ MnO2+ O2↑.
Khí O2tan ít trong nước → thu khí O2bằng cách đẩy nước.
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Dẫn khí H2S vào lượng dư dung dịch NaOH:
H2S + 2NaOH → Na2S + 2H2O.
→ Dung dịch thu được gồm: Na2S và NaOH dư.
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phương trình hóa học: Fe2O3+ 3H2SO4→ Fe2(SO4)3+ 3H2O.
→ Sản phẩm thu được: Fe2(SO4)3; H2O.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phát biểu sai là: SO2là chất khí không màu, mùi trứng thối, nặng hơn không khí.
Sửa lại: SO2là chất khí không màu, mùi hắc, nặng hơn không khí (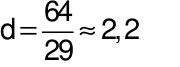 ).
).
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Hỗn hợp Mg và Al tác dụng với lượng dư dung dịch H2SO4:
Mg + H2SO4→ MgSO4+ H2↑
2Al + 3H2SO4→ Al2(SO4)3+ 3H2↑
→ Thu được 2 muối.
Loại B vì Cu không phản ứng, chỉ thu được 1 muối là MgSO4.
Loại C vì thu được 3 muối:
Fe3O4+ 4H2SO4→ Fe2(SO4)3+ FeSO4+ 4H2O
Zn + H2SO4→ ZnSO4+ H2↑
Loại D vì Ag không phản ứng với H2SO4loãng, chỉ có Fe2O3phản ứng thu được một muối là Fe2(SO4)3.
Câu 14:
 2HI (k), H >0. Cân bằng trên khôngbị chuyển dịch khi
2HI (k), H >0. Cân bằng trên khôngbị chuyển dịch khi Xem đáp án
Xem đáp án
Đáp án đúng là: A
H2 (k)+ I2 (k) 2HI
2HI
→ Số mol của hệ trước phản ứng = 1 + 1 = 2; số mol của hệ sau phản ứng = 2.
→ Cân bằng trên khôngbị chuyển dịch khi thay đổi áp suất chung của hệ.
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
nFe= 0,012 (mol).
Phương trình hóa học: 2Fe + 3Cl2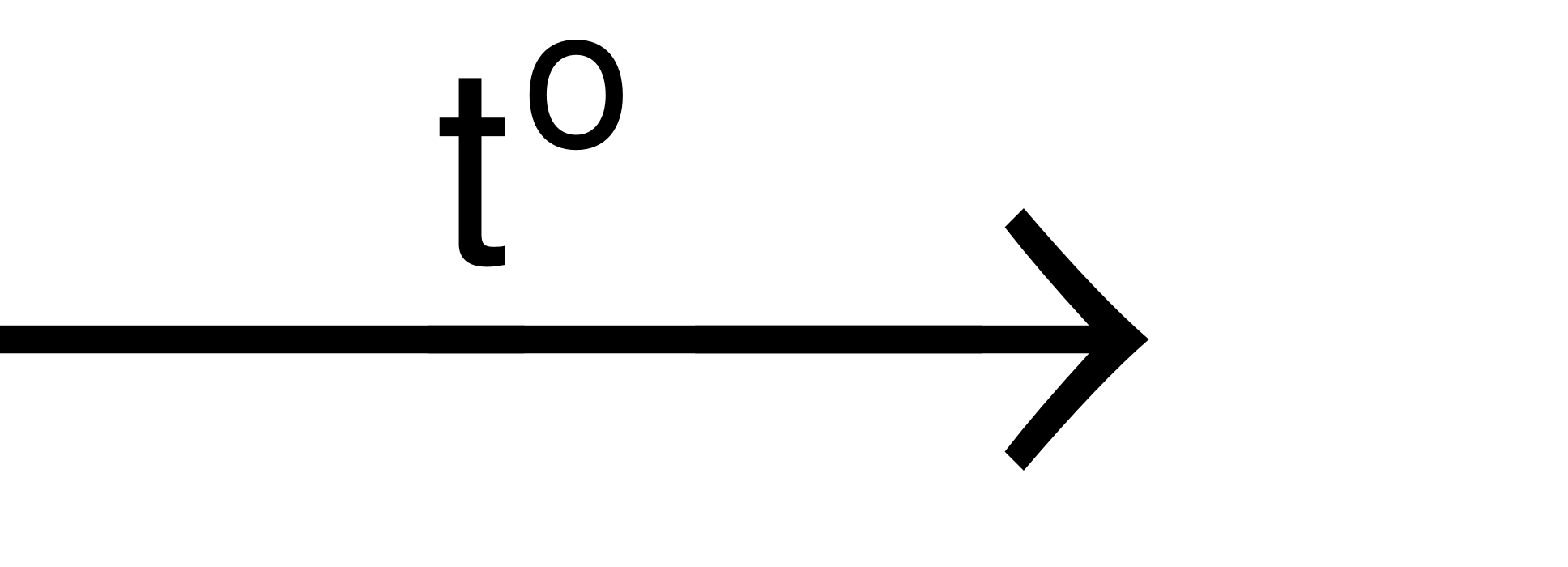 2FeCl3.
2FeCl3.
→ 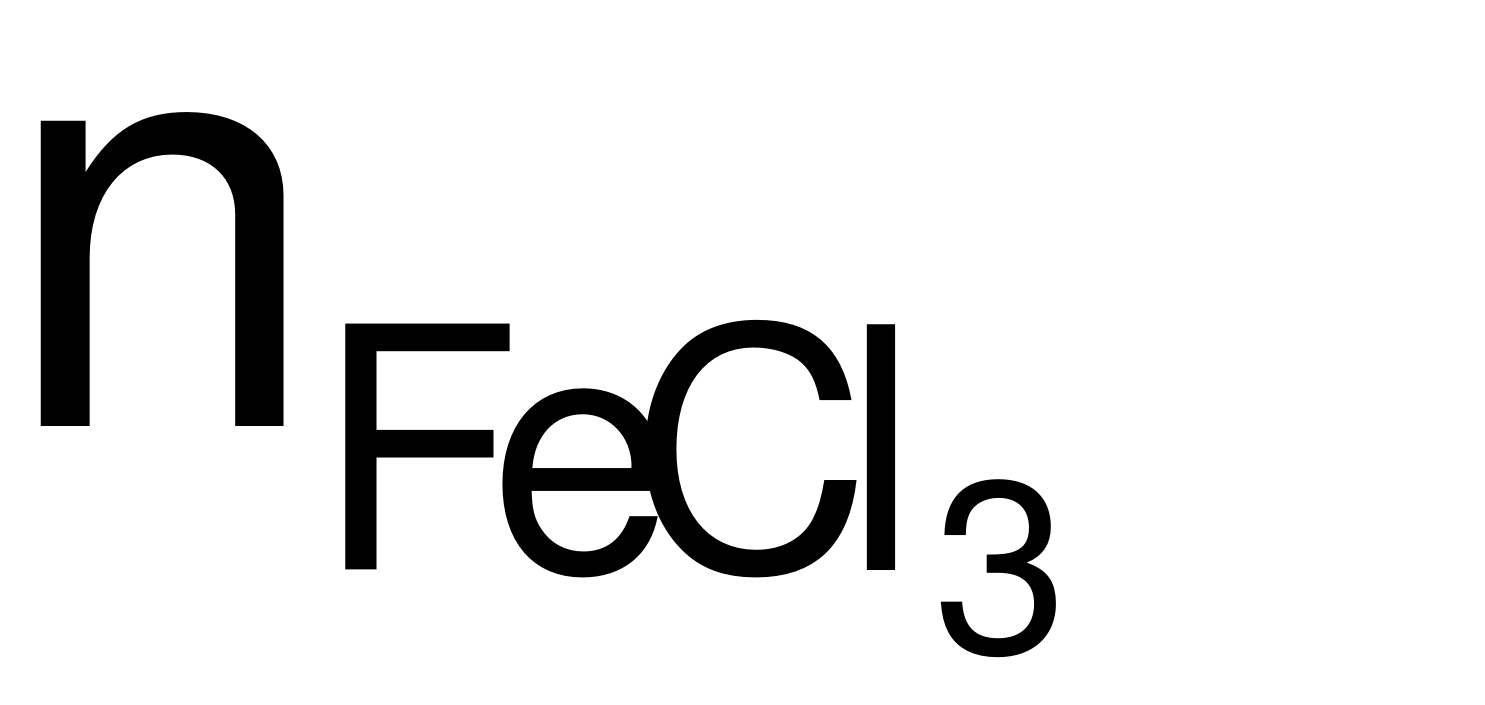 = nFe= 0,012 (mol)
= nFe= 0,012 (mol)
→ 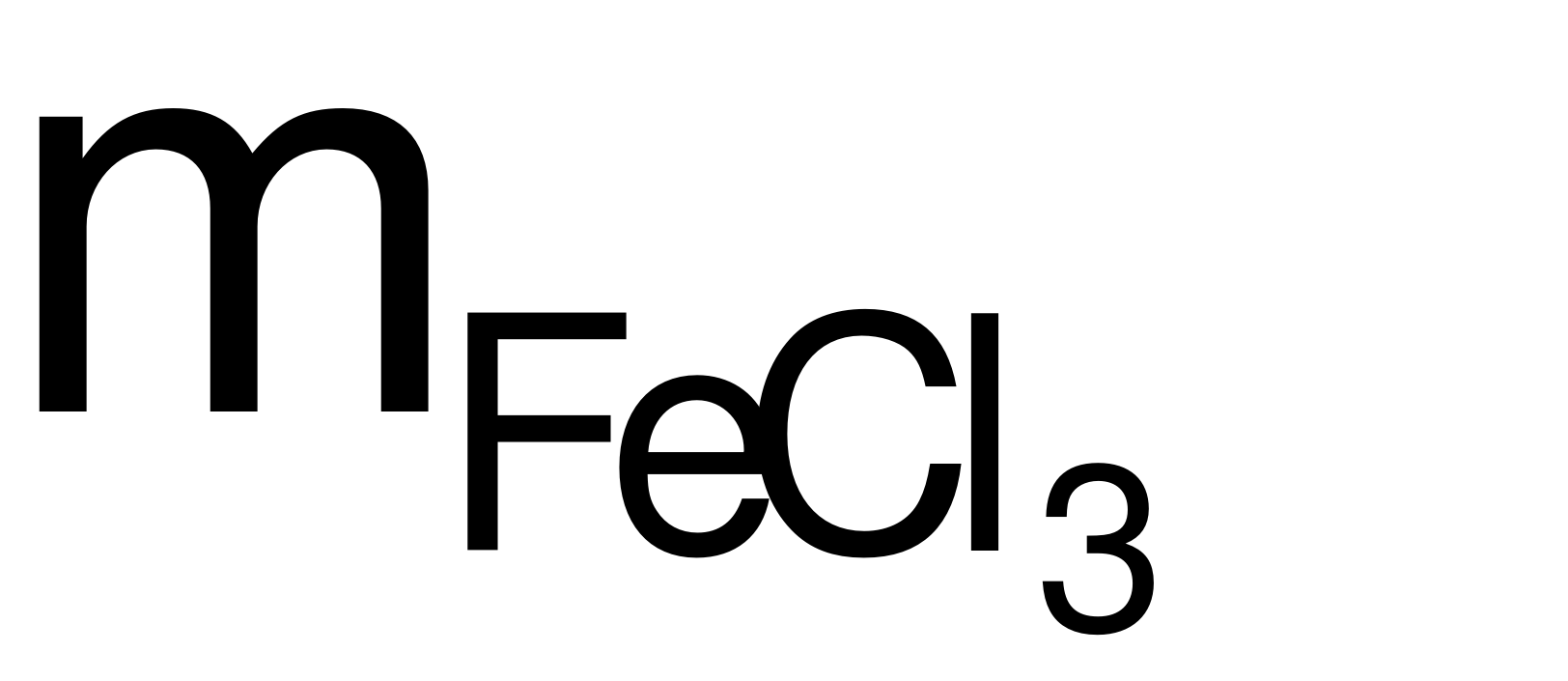 = 0,012×162,5 = 1,95 (gam).
= 0,012×162,5 = 1,95 (gam).
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
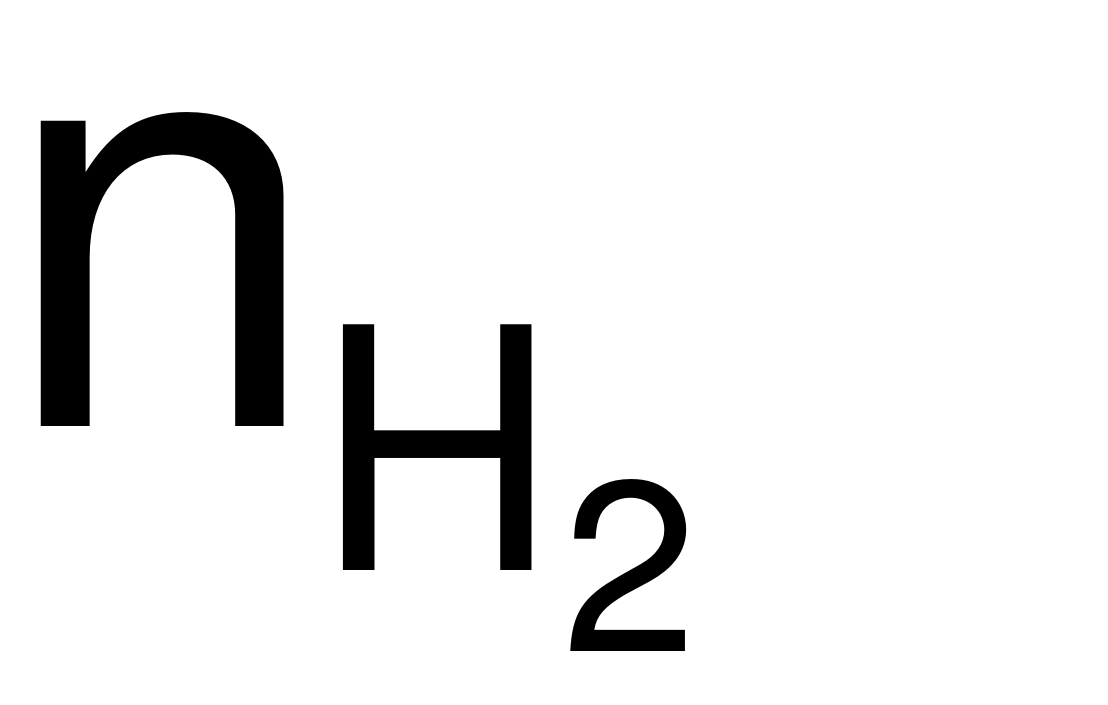 = 0,325 (mol) → nHCl= 2
= 0,325 (mol) → nHCl= 2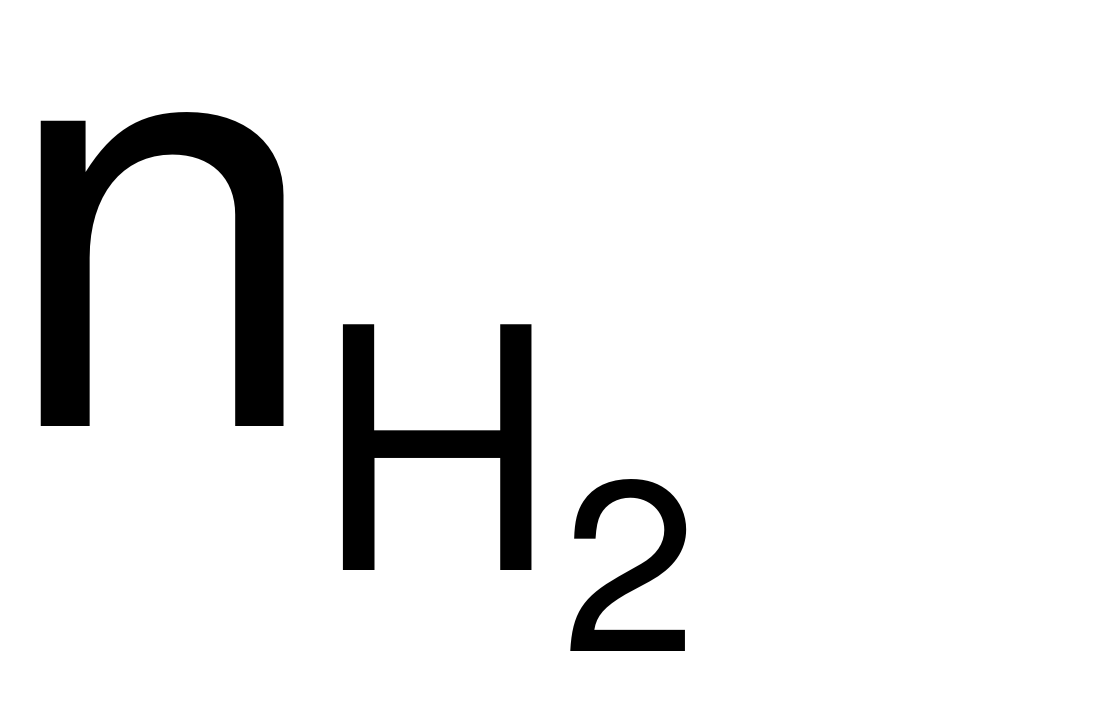 = 0,65 (mol).
= 0,65 (mol).
→ mMuối = m(Mg, Al) + m(Cl)= 6,45 + 0,65×35,5 = 29,525 (gam).
Câu 17:
(a) Dẫn khí Cl2vào dung dịch KI.
(b) Dẫn khí F2vào nước nóng.
(c) Cho Ag vào dung dịch HCl.
(d) Cho dung dịch HCl vào dung dịch Na2CO3.
(e) Cho dung dịch AgNO3vào dung dịch KF.
(g) Cho khí H2tác dụng với I2, có chiếu sáng.
Số thí nghiệm có xảy ra phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Các thí nghiệm xảy ra phản ứng là: (a), (b), (d).
Phương trình hóa học:
(a) Cl2+ 2KI → 2KCl + I2
(b) 2F2+ 2H2O → 4HF + O2
(d) 2HCl + Na2CO3→ 2NaCl + CO2↑ + H2O
Chú ý: I2chỉ oxi hóa được H2ở nhiệt độ cao và có mặt chất xúc tác.
I2+ H2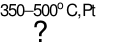 2HI
2HI
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
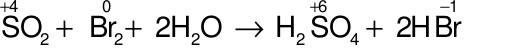
→ SO2thể hiện tính khử, Br2thể hiện tính oxi hóa.
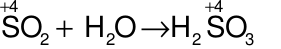
→ SO2không thể hiện tính oxi hóa, không thể hiện tính khử.
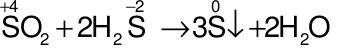
→ SO2thể hiện tính oxi hóa, H2S thể hiện tính khử.
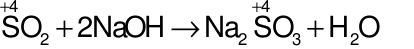
→ SO2không thể hiện tính oxi hóa, không thể hiện tính khử.
Câu 19:
A. Mg.
B. Zn.
D. Ca.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
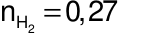 (mol).
(mol).
Gọi hóa trị của kim loại R là n.
→ nR= 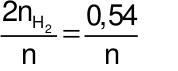 (mol)
(mol)
→ MR= 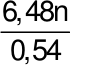 = 12n.
= 12n.
Chọn n = 2 → MR= 24 (đvC) → R là kim loại Magie (Mg).
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phát biểu đúng: Có thể phân biệt hai dung dịch NaCl và H2SO4bằng BaCl2(thấy xuất hiện kết tủa trắng là H2SO4, không có hiện tượng gì là NaCl).
Loại B vì: Ở nhiệt độ thường, oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, …).
Loại C vì: Đốt cháy FeS trong lượng dư khí oxi thì thu được Fe2O3và SO2.
4FeS + 7O2→ 2Fe2O3+ 4SO2
Loại D vì: Dung dịch H2SO4 loãng không hòa tan được cacbon và lưu huỳnh (chú ý: Dung dịch H2SO4 đặc, nóng hòa tan được cacbon và lưu huỳnh)
Câu 21:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
2KMnO4+ 16HCl → 2KCl + 2MnCl2+ 5Cl2+ 8H2O
12,5(mol)
→ 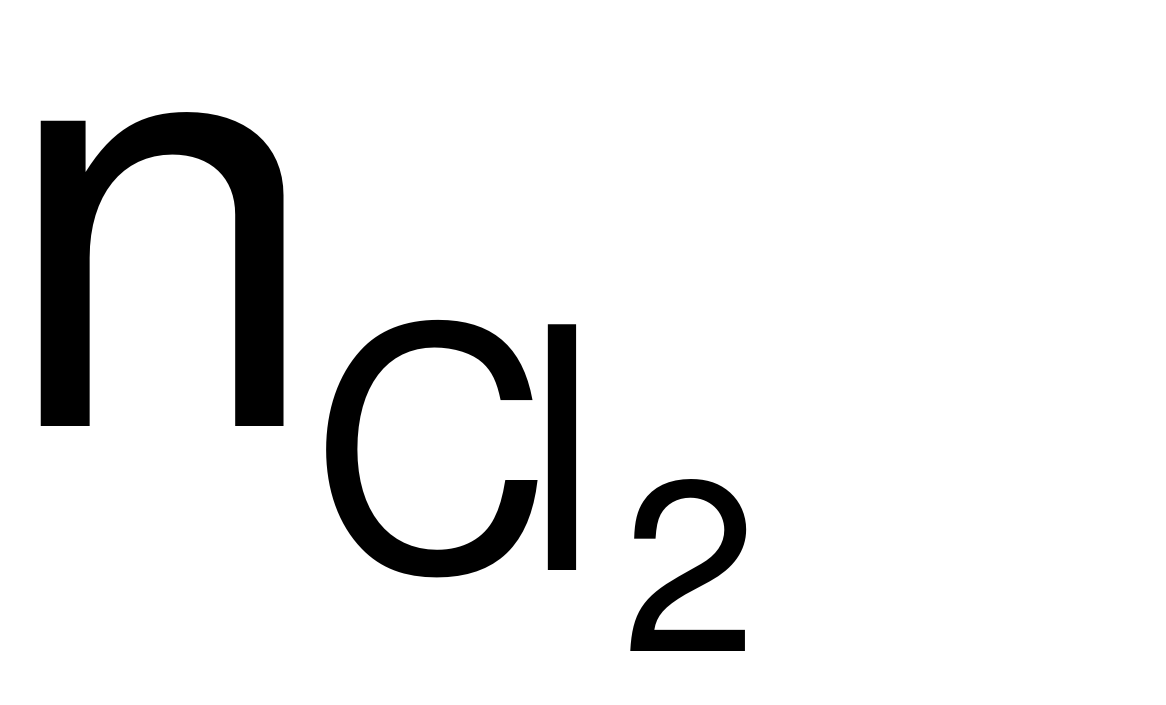 = 2,5 (mol).
= 2,5 (mol).
CaCO3+ 2HCl → CaCl2+ CO2↑ + H2O
1 1(mol)
→ 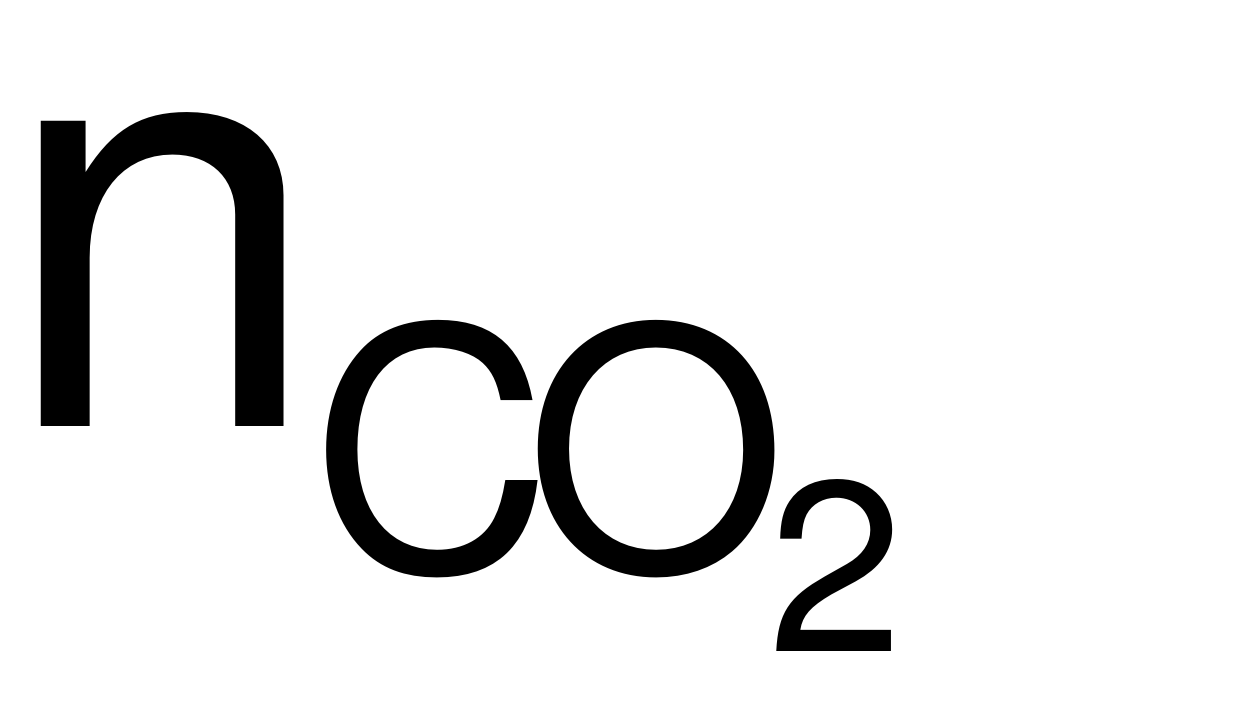 = 1 (mol).
= 1 (mol).
2KMnO4 K2MnO4+ MnO2+ O2↑
K2MnO4+ MnO2+ O2↑
10,5 (mol)
→ 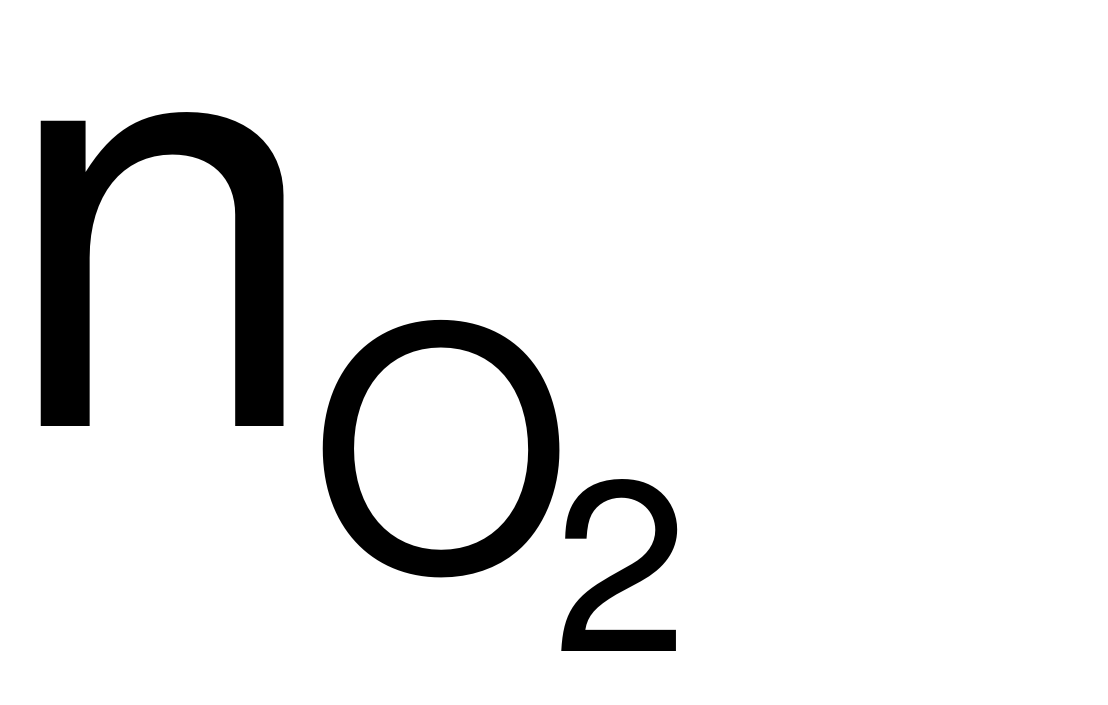 = 0,5 (mol).
= 0,5 (mol).
2Al + 3H2SO4→ Al2(SO4)3+ 3H2↑
1 1,5 (mol)
→ 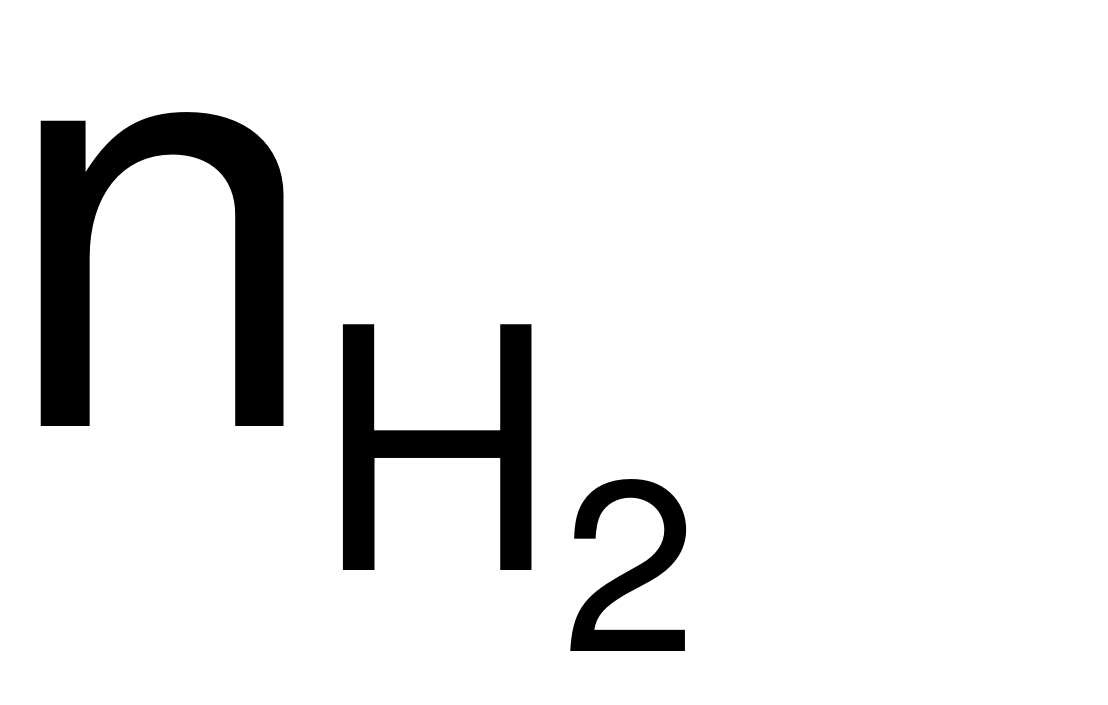 = 1,5 (mol).
= 1,5 (mol).
→ Thí nghiệm thu được số mol khí lớn nhất: Cho 1 molKMnO4 tác dụng với lượng dư dung dịch HCl đặc.
Câu 22:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Bảo toàn khối lượng: mX+ 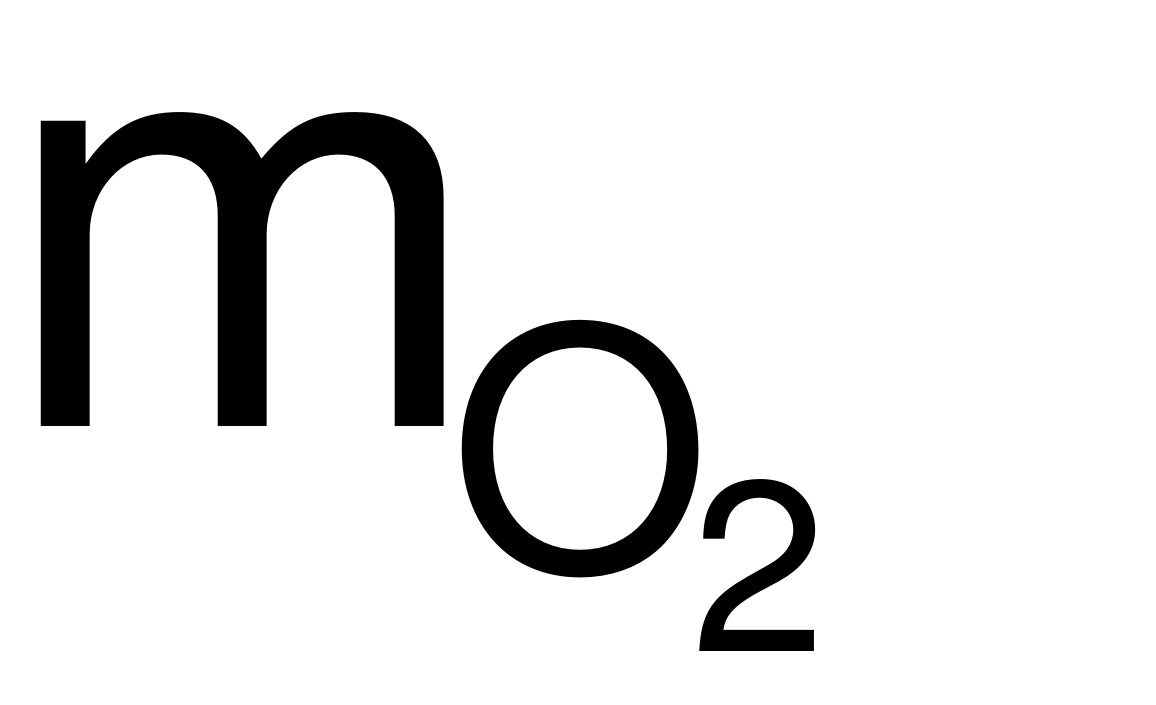 = mY→ m + 32a = 1,71 (1).
= mY→ m + 32a = 1,71 (1).
Trong 0,855 gam Y có:
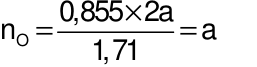 (mol), m(Cu, Mg, Al)=
(mol), m(Cu, Mg, Al)= 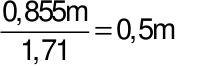 (gam).
(gam).
Cho Y tác dụng với dung dịch H2SO4(2H + O → H2O).
→ 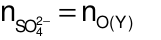 = a (mol).
= a (mol).
→ mmuối= m(Cu, Mg, Al) + 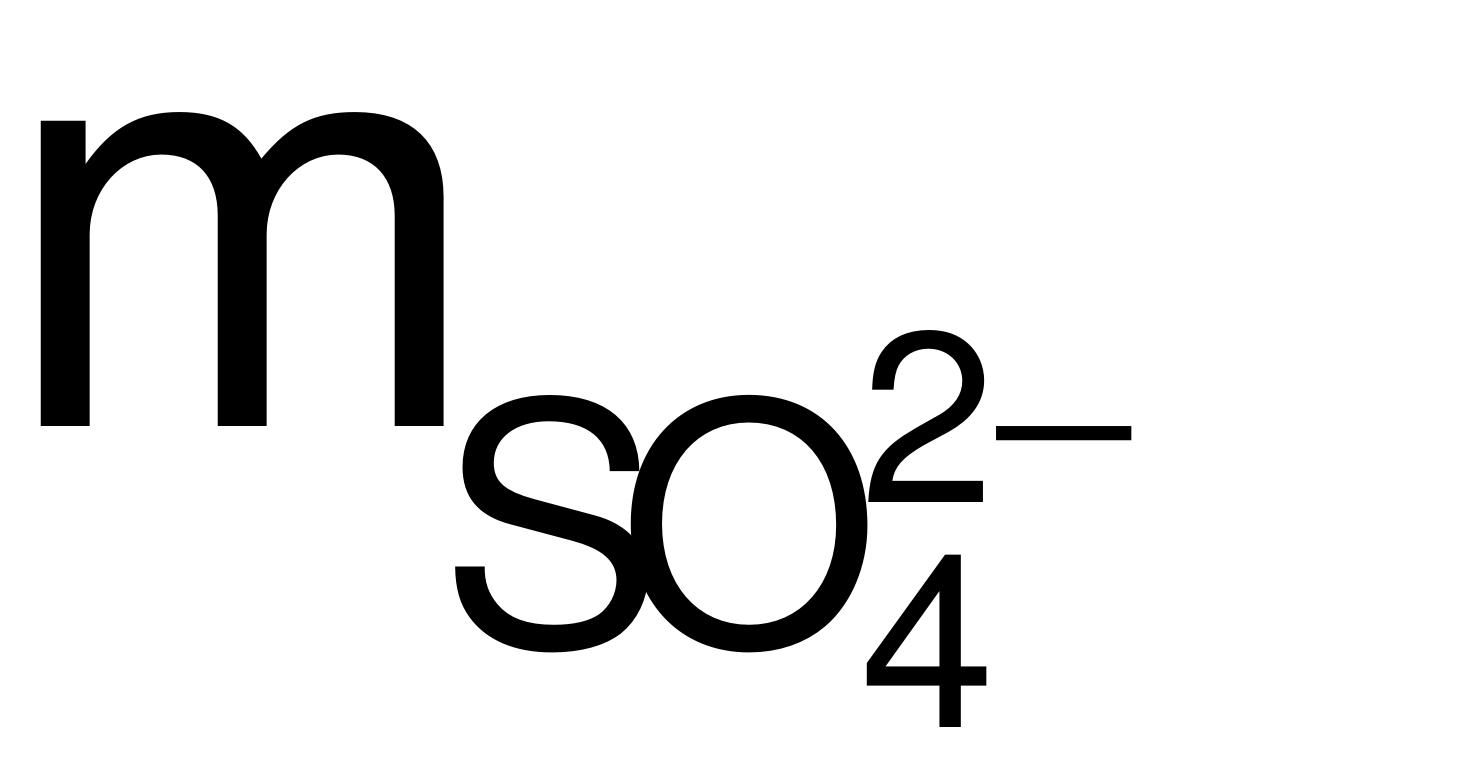 → 0,5m + 96a = 2,255 (2)
→ 0,5m + 96a = 2,255 (2)
Từ (1) và (2), suy ra: m = 1,15; a = 0,0175.
→ m + a = 1,15 + 0,0175 = 1,1675 ≈ 1,2.
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Coi chất rắn Y gồm: Fe (x mol), Cu (y mol) và O (z mol).
→ 56x + 64y + 16z = 1,22 (1)
mmuối= 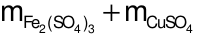 = 400×0,5x + 160y = 3,3 (2)
= 400×0,5x + 160y = 3,3 (2)
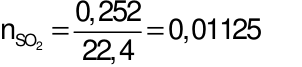 (mol).
(mol).
Bảo toàn electron: 3nFe+ 2nCu= 2 + 2nO(Y)
+ 2nO(Y)
→ 3x + 2y = 2×0,01125 + 2z (3)
Từ (1), (2) và (3), suy ra: x = 0,0125; y = 0,005; z = 0,0125.
→%mCu= 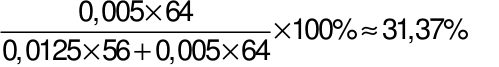 .
.
II. PHẦN TỰ LUẬN (2,5 điểm)
