Trắc nghiệm chuyên đề Hóa 11 Chủ đề 5. Các dạng bài tập về axit nitric có đáp án
Trắc nghiệm chuyên đề Hóa 11 Chủ đề 5. Các dạng bài tập về axit nitric có đáp án
-
1299 lượt thi
-
18 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Cho m (g) hỗn hợp Fe và Cu tác dụng hết với 100 ml dung dịch HNO3 2,4 M có nung nóng thu được dung dịch A và một khí màu nâu đỏ. Cô cạn dung dịch A thu được 10,48 g hỗn hợp 2 muối khan.
a. Tính m (g)?
 Xem đáp án
Xem đáp án
= 0,1.2,4 = 0,24 mol;
2H+ + NO3- + e → NO2 + H2O
a. nNO3- tạo muối = 0,12 mol
mmuối = m + mNO3- = m + 0,12.62 ⇒ m = 10,48 – 7,44 = 3,04 gam
Câu 2:
b. Cho 2 muối trong dung dịch A tác dụng với 200 ml dung dịch NaOH. Tính nồng độ mol/l của dung dịch NaOH dùng cho phản ứng?
 Xem đáp án
Xem đáp án
b. Ta có nN+ = nNO3- tạo muối = 0,12 mol ⇒ CM(NaOH) = = 0,6 M
Câu 3:
Hoà tan hoàn toàn m gam Al trong dung dịch HNO3 thì thu được 8,96 lít (đktc) hỗn hợp khí A (gồm NO và N2O) có tỉ khối = 16,75. Tính m?
 Xem đáp án
Xem đáp án
Nhh khí = = 0,4 mol
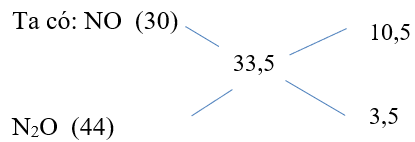
⇒ nNO = 0,3 mol và = 0,1mol
Các phương trình phản ứng:
Al -3e → Al+3 ; N+5 + 3e → N+2; 2N+5 + 8e → N2+1
nAl = mol
Vậy mAl = = 15,3 gam
Câu 4:
Hòa tan 38,4 gam Cu vào dd HNO3 loãng dư, thu được V lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của V:
 Xem đáp án
Xem đáp án
Sử dụng bảo toàn e: nNO = = 0,4 mol ⇒ V = 0,4.22,4 = 8,96 lít
Câu 5:
Hòa tan hoàn toàn hh X gồm 8,1 gam Al và 29,25 gam Zn bằng dd HNO3 12,6% (vừa đủ) thu được V lit N2O (đktc, khí duy nhất) và dd Y chứa 154,95 gam muối tan. Giá trị của V là:
 Xem đáp án
Xem đáp án
= 85,05 gam
my = = 0,075 mol
0,15 mol ⇒ V = 0,15.22,4 = 3,36 lít
Câu 6:
Nung m gam bột sắt trong oxi, thu được 46,4 gam hỗn hợp chất rắn X. Hoà tan hết hỗn hợp X trong dung dịch HNO3 dư, thoát ra 8,96 lít (đktc) NO (sản phẩm khử duy nhất) và dd Y chứa m1 gam muối nitrat.
a. Tính giá trị của m, m1 ?
 Xem đáp án
Xem đáp án
Fe + O2 → X + HNO3 → Fe3+ + NO
Trong quá trình phản ứng xảy ra sự trao đổi e của Fe, N, O
a. Bảo toàn e ta có: ⇒ m = 39,2 gam
Khối lượng muối thu được: = 0,7.242 = 169,4 gam
Câu 7:
b. Số mol của HNO3 đã phản ứng là bao nhiêu?
 Xem đáp án
Xem đáp án
b. Số mol HNO3 phản ứng: n = nNO3- tạo muối + nNO = 0,7.3 + 0,4 = 2,5 mol
Câu 8:
Nung 2,23 gam hh X gồm (Fe, Cu, Ag) trong oxi một thời gian thu được 2,71 gam hh Y. Hoà tan Y bằng dung dịch HNO3 dư, thu được 0,672 lít khí NO (sp khử duy nhất, ở đktc) và dung dịch A. Cô cạn dung dịch A thu được m gam muối. Tính khối lượng muối tạo thành và mol HNO3 phản ứng?
 Xem đáp án
Xem đáp án
Số mol NO3- tạo muối là: nNO3- tạo muối = 3.nNO = 0,03.3 = 0,09 mol
Khối lượng muối tạo thành: m = mX + mNO3- tạo muối = 2,23 + 0,09.62 = 7,81 gam
Số mol oxi tham gia phản ứng: = 0,015 mol ⇒ nO = 0,03 mol
Số mol HNO3 đã phản ứng là: n = 4.nNO + 2.nO = 0,18 mol
Câu 9:
Nung m bột Cu trong oxi, sau 1 thời gian thu được 29,6 gam hỗn hợp chất rắn X gồm (Cu, CuO, Cu2O). Hòa tan hỗn hợp X trong HNO3 đặc, nóng vừa đủ thu được 6,72 lít khí NO2 (đktc, sản phẩm khử duy nhất) và dd Y. Giá trị của m là:
 Xem đáp án
Xem đáp án
Bảo toàn e ta có: + 0,3.1 ⇒ m = 25,6 gam
Câu 10:
Cho 30 gam hỗn hợp X gồm: Fe; FeO; Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư được 5,6 lít khí NO (đktc, sp khử duy nhất) và dung dịch Y. Số mol của HNO3 đã phản ứng là:
 Xem đáp án
Xem đáp án
Quy đổi 30 gam hỗn hợp X thành Fe và O ⇒ 56x + 16y = 30 (1); 3x – 2y = 0,25.3 (2);
Từ 1, 2 ⇒ x = 0,45 và y = 0,3; = 4.nNO + 2nO = 4.0,25 + 2.0,3 = 1,6 mol
Câu 11:
Nung 19,89 gam hh X gồm (Al, Zn, Mg) trong oxi một thời gian thu được 23,09 gam hh Y. Hoà tan Y bằng dung dịch HNO3 dư, thu được 1,12 lít khí N2 (sản phẩm khử duy nhất, ở đktc) và dd Z. Cô cạn dd Z thu m gam muối. Giá trị của m là:
 Xem đáp án
Xem đáp án
tạo muối = 0,05. 10 = 0,5 mol; m = mX + = 19,89 + 0,5.62 = 50,89 gam.
Câu 12:
Nung nóng 66,2 gam Pb(NO3)2 thu được 55,4 gam chất rắn.
a. Tính hiệu suất của phản ứng phân hủy.
 Xem đáp án
Xem đáp án
Phương trình phản ứng
Pb(NO3)2 → PbO + 2NO2 + O2
x 2x x mol
mNO2 + mO2 = 46.2x + 32.0,5x = 66,2 – 55,4 ⇒ x = 0,1 mol
a. Khối lượng của Pb(NO3)2 phản ứng là: = 0,1.331 = 33,1 gam
Hiệu suất phản ứng thủy phân là: H = = 50%
Câu 13:
b. Tính thể tích các khí thoát ra (đkc) và tỷ khối của hỗn hợp khí so với không khí.
 Xem đáp án
Xem đáp án
b. Thể tích khí thoát ra: V = = 5,6 lít
Mtb = = 43,2 gam ⇒ dhh/kk = 43,2/29 = 1,49
Câu 14:
Khi nhiệt phân hoàn toàn muối nitrat của kim loại hóa trị 1 thu được 32,4 gam kim loại và 10,08 lít khí (đktc). Xác định công thức và tính khối lượng muối ban đầu.
 Xem đáp án
Xem đáp án
Gọi kim loại cần tìm là M ⇒ muối nitrat là: MNO3
MNO3 → M + NO2 + O2
x x x
x + x/2 = 1,5x = = 0,45 ⇒ x = 0,3
M = 32,4/0,3 = 108 ⇒ M là Ag
mcr = 67,3 – (0,8.46 + 0,2.32) = 24,1 gam
Câu 15:
Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
 Xem đáp án
Xem đáp án
= 0,03 ⇒ = 0,03 mol ⇒ CM = 0,1 M ⇒ pH = 1
Câu 16:
Phân huỷ hoàn toàn 18,8g muối nitrat của một kim loại hoá trị II, thu được 8g oxit của kim loại đó. Vậy kim loại chưa biết là:
 Xem đáp án
Xem đáp án
= 0,2 ⇒ = 0,1 mol ⇒ = = 188 ⇒ M = 64 là Cu
Câu 17:
Đem nung một khối lượng Cu(NO3)2 sau một thời gian dừng lại, làm nguội, rồi cân thấy khối lượng giảm 0,54g. Vậy khối lượng muối Cu(NO3) đã bị nhiệt phân là:
 Xem đáp án
Xem đáp án
= 0,01 mol ⇒ = 0,005 mol ⇒ = 0,94 gam
Câu 18:
 Xem đáp án
Xem đáp án
Công thức muối nitrat là M(NO3)n; nNO2 = 0,05 mol ⇒
⇒ = 94n ⇒ M = 32n ⇒ M = 64. CT là Cu(NO3)2.
