Đề kiểm tra giữa kì 1 Hóa 11 KNTT có đáp án (Đề 3)
-
109 lượt thi
-
30 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Biểu thức tính hằng số cân bằng (KC) của phản ứng tổng quát: aA + bB cC + dD là
 Xem đáp án
Xem đáp án
Chọn C
Câu 2:
Các dung dịch acid, base, muối dẫn điện được là do trong dung dịch của chúng có các
 Xem đáp án
Xem đáp án
Chọn A
Câu 11:
Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một chất khí. Chất khí đó là
 Xem đáp án
Xem đáp án
Chọn A
Câu 17:
Cho cân bằng hoá học: 2SO2 (g) + O2 (g) 2SO3 (g); phản ứng thuận là phản ứng toả nhiệt. Phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn B
Câu 18:
Cho các cân bằng sau:
(1) H2(g) + I2(g) 2HI(g) (4) 2HI(g) H2(g) + I2(g)
(2) ![]() H2(g) +
H2(g) + ![]() I2(g) HI(g) (5) H2(g) + I2(s) 2HI(g)
I2(g) HI(g) (5) H2(g) + I2(s) 2HI(g)
(3) HI(g) ![]() H2(g) +
H2(g) + ![]() I2(g)
I2(g)
Ở nhiệt độ xác định, nếu KC của cân bằng (1) bằng 64 thì KC bằng 0,125 là của cân bằng
 Xem đáp án
Xem đáp án
Chọn C
Câu 20:
Cho dãy các chất: K2SO4.Al2(SO4)3.24H2O, C2H5OH, C12H22O11 (saccharose), CH3COOH, Ca(OH)2, CH3COONH4. Số chất điện li là
 Xem đáp án
Xem đáp án
Chọn B
Câu 22:
Trong phản ứng: N2(g) + O2(g) 2NO(g). N2 thể hiện
A. tính khử. B. tính oxi hóa. C. tính base. D. tính acid.
 Xem đáp án
Xem đáp án
Chọn A
Câu 24:
Tìm các tính chất không thuộc về khí nitrogen?
(a) Hóa lỏng ở nhiệt độ rất thấp (-196oC).
(b) Cấu tạo phân tử nitrogen là .
(c) Tan nhiều trong nước.
(d) Nặng hơn oxygen.
(e) Kém bền, dễ bị phân hủy thành nitrogen nguyên tử.
 Xem đáp án
Xem đáp án
Chọn C
Câu 26:
Có 4 ống nghiệm, mỗi ống đựng một chất khí khác nhau, chúng được úp ngược trong các chậu nước X, Y, Z, T. Kết quả thí nghiệm được mô tả bằng hình vẽ sau:
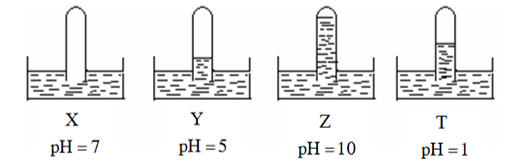
 Xem đáp án
Xem đáp án
Chọn B
Câu 27:
Tổng hệ số (các số nguyên, tối giản) của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là
 Xem đáp án
Xem đáp án
Chọn A
Câu 28:
Trong công nghiệp, halogen được sản xuất từ phản ứng:
CH4(g) + H2O(g) ⇌ 3H2(g) + CO(g)
a) Tính hằng số cân bằng KC của phản ứng trên ở 760 oC.
Biết ở nhiệt độ này, tất cả các chất đều ở thể khí và nồng độ mol của CH4, H2O, H2 và CO ở trạng thái cân bằng lần lượt là 0,126 M; 0,242 M; 1,150 M và 0,126 M.
b) Ở 760 oC, giả sử ban đầu chỉ có CH4 và H2O có nồng độ bằng nhau và bằng x M. Xác định x, biết nồng độ của H2 ở trạng thái cân bằng là 0,6 M.
 Xem đáp án
Xem đáp án
a) Hằng số cân bằng KC của phản ứng ở 760 oC là:
b) Ta có: CH4(g) + H2O(g) ⇌ 3H2(g) + CO(g)
Ban đầu: x x 0 0 M
Phản ứng: 0,2 0,2 0,6 0,2 M
Cân bằng: (x – 0,2) (x – 0,2) 0,6 0,2 M
Do giá trị KC chỉ phụ thuộc vào bản chất của các chất trong cân bằng và nhiệt độ. Nên:
Þ 0,0432 = 6,285x2 – 2,514x + 0,2514
Þ 6,285x2 – 2,514x + 0,2082 = 0
Þ x = 0,283 (thoả mãn); x = 0,12 (loại do 0,12 < 0,2).
Câu 29:
Tại sao khi bảo quản các dung dịch muối M3+ (Fe3+, Al3+ …) trong phòng thí nghiệm, người ta thường nhỏ vài giọt acid vào trong lọ đựng dung dịch muối?
 Xem đáp án
Xem đáp án
Phản ứng thủy phân muối:
Khi thêm vài giọt acid tức là thêm H+ thì cân bằng trên chuyển dịch theo chiều nghịch nên hạn chế được sự thủy phân của muối M3+.
Câu 30:
Việc sản xuất ammonia trong công nghiệp dựa trên phản ứng thuận nghịch sau đây:
N2(g) + 3H2(g) 2NH3(g) = -92 kJ
Khi hỗn hợp phản ứng đang ở trạng thái cân bằng, những thay đổi dưới đây sẽ làm cân bằng chuyển dịch như thế nào? Giải thích.
(a) Tăng nhiệt độ. (d) Giảm nhiệt độ.
(b) Tăng áp suất. (e) Lấy NH3 ra khỏi hệ.
(c) Thêm chất xúc tác.
 Xem đáp án
Xem đáp án
Phản ứng trên có < 0 nên chiều thuận tỏa nhiệt, chiều nghịch thu nhiệt.
(a) Khi tăng nhiệt độ thì cân bằng chuyển dịch theo chiều làm giảm nhiệt độ (chiều phản ứng thu nhiệt) tức chiều nghịch.
(b) Khi tăng áp suất thì cân bằng chuyển dịch theo chiều làm giảm số mol khí tức chiều thuận.
(c) Khi thêm chất xúc tác cân bằng không chuyển dịch vì chất xúc tác không ảnh hưởng đến cân bằng.
(d) Khi giảm nhiệt độ cân bằng chuyển dịch theo chiều làm tăng nhiệt độ (chiều phản ứng tỏa nhiệt) tức chiều thuận.
(e) Khi lấy NH3 ra khỏi hệ thì cân bằng chuyển dịch theo chiều làm tăng NH3 tức chiều thuận.
