Trắc nghiệm Hóa 11 KNTT Bài 1: Khái niệm về cân bằng hoá học có đáp án
-
434 lượt thi
-
15 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Phản ứng thuận nghịch là phản ứng
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
Câu 2:
Nhận xét nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phản ứng một chiều là phản ứng xảy ra hoàn toàn.
Câu 3:
Yếu tố nào sau đây luôn luôn không làm dịch chuyển cân bằng của hệ phản ứng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các yếu tố có thể ảnh hưởng đến cân bằng hoá học là nồng độ, nhiệt độ và áp suất.
Câu 4:
Phản ứng nào sau đây là phản ứng thuận nghịch?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Biểu diễn PTHH của phản ứng thuận nghịch dùng hai nửa mũi tên 1 chiều nhau
Ví dụ: 2SO2 + O2 2SO3.
Câu 5:
Trong các phát biểu sau đây, phát biểu nào đúng khi một hệ ở trạng thái cân bằng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi một hệ ở trạng thái cân bằng, nồng độ của các chất trong hệ không đổi.
Câu 6:
Các yếu tố có thể ảnh hưởng đến cân bằng hoá học là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Theo nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài như biến đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Câu 7:
Cho phản ứng hoá học sau:
Yếu tố nào sau đây cần tác động để cân bằng trên chuyển dịch sang phải?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Khi tăng áp suất chung của hệ thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức là chiều làm giảm số mol khí và ngược lại. Nên để cân bằng trên chuyển dịch sang phải thì cần tăng áp suất.
Câu 8:
Hằng số cân bằng KC của một phản ứng thuận nghịch phụ thuộc vào yếu tố nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
KC chỉ phụ thuộc nhiệt độ và bản chất của phản ứng, không phụ thuộc nồng độ ban đầu của các chất.
Câu 9:
Biểu thức tính hằng số cân bằng (KC) của phản ứng tổng quát: aA + bB cC + dD là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Biểu thức tính hằng số cân bằng (KC) của phản ứng tổng quát: aA + bB cC + dD là
Câu 10:
Xét cân bằng sau:
Nếu tăng nồng độ SO2(g) (các điều kiện khác giữ không đổi), cân bằng sẽ chuyển dịch theo chiều cao?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khi tăng nồng độ một chất trong phản ứng thì cân bằng hoá học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại. Vậy khi tăng nồng độ SO2(g) (các điều kiện khác giữ không đổi), cân bằng sẽ chuyển dịch theo chiều thuận.
Câu 11:
Cho phản ứng hoá học sau: H2(g) + Br2(g) 2HBr(g)
Biểu thức hằng số cân bằng (KC) của phản ứng trên là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Biểu thức hằng số cân bằng (KC) của phản ứng: H2(g) + Br2(g) 2HBr(g) là
Câu 12:
Biểu thức nào sau đây là biểu thức hằng số cân bằng (KC) của phản ứng:
C(S) + 2H2 (g) CH4(g)?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Biểu thức hằng số cân bằng (KC) của phản ứng C(S) + 2H2 (g) CH4(g) là:
Câu 13:
Viết biểu thức tính hằng số cân bằng của phản ứng sau:
CH3COOH(l) + C2H5OH(l) CH3COOC2H5(l) + H2O(l)
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Biểu thức tính hằng số cân bằng của phản ứng: CH3COOH(l) + C2H5OH(l) CH3COOC2H5(l) + H2O(l) là 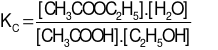
Câu 14:
Biểu thức tính hằng số cân bằng của phản ứng: CaO(s) + CO2(g) CaCO3(s) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Biểu thức tính hằng số cân bằng của phản ứng: CaO(s) + CO2(g) CaCO3(s) là 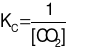

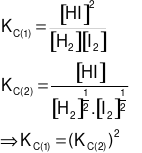
 H2(g) +
H2(g) +  I2(g) HI(g) KC(2)
I2(g) HI(g) KC(2)