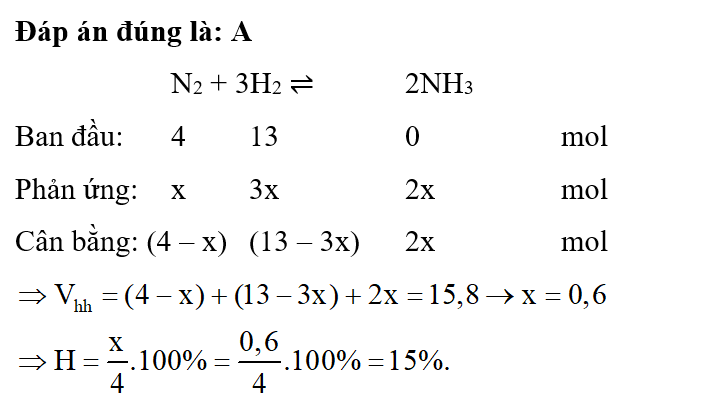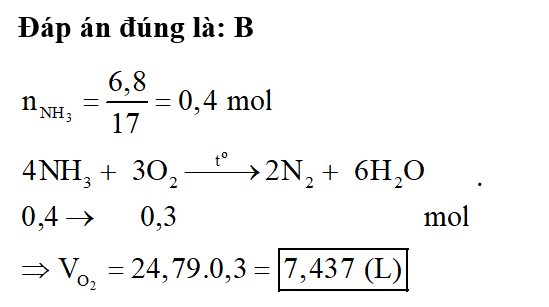Trắc nghiệm Hóa 11 CD Bài 9. Phương pháp tách biệt và tinh chế hợp chất hữu cơ có đáp án
Trắc nghiệm Hóa 11 CD Bài 9. Phương pháp tách biệt và tinh chế hợp chất hữu cơ có đáp án
-
94 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Khi có sấm sét, nitrogen tác dụng với oxygen tạo ra?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi có sấm sét, nitrogen (N2) tác dụng với oxygen (O2) tạo khí nitrogen monoxide (NO).
Câu 2:
Ở -198oC, nitrogen tồn tại ở dạng nào?
 Xem đáp án
Xem đáp án
Hướng dẫn giải
Nitrogen hóa lỏng ở -196oC, nên ở -198oC, nitrogen tồn tại ở dạng lỏng.
Câu 3:
Khi có tia lửa điện hoặc nhiệt độ cao. Nitrogen tác dụng trực tiếp với oxygen tạo ra hợp chất X. X tiếp tục tác dụng với oxygen trong không khí tạo thành hợp chất Y. Công thức của X, Y lần lượt là
Câu 4:
Trong phản ứng tổng hợp ammonia:
N2(g) + 3H2(g) 2NH3(g); ∆rH < 0.
Sẽ thu được nhiều khí NH3 nhất nếu:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Để thu được nhiều NH3 thì cân bằng chuyển dịch theo chiều thuận.
+ ∆rH < 0, phản ứng thuận toả nhiệt. Giảm nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng toả nhiệt, tức chiều thuận.
+ Tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm số mol khí, tức chiều thuận.
Câu 5:
Vì sao nitrogen lỏng có thể được sử dụng để làm lạnh nhanh?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nitrogen hóa lỏng ở nhiệt độ rất thấp (-196oC) nên có thể sử dụng để làm lạnh nhanh.
Câu 6:
Một bình kín có thể tích là 2 lít chứa 2 mol H2 và 2 mol N2, ở nhiệt độ to. Khi ở trạng thái cân bằng có 0,8 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
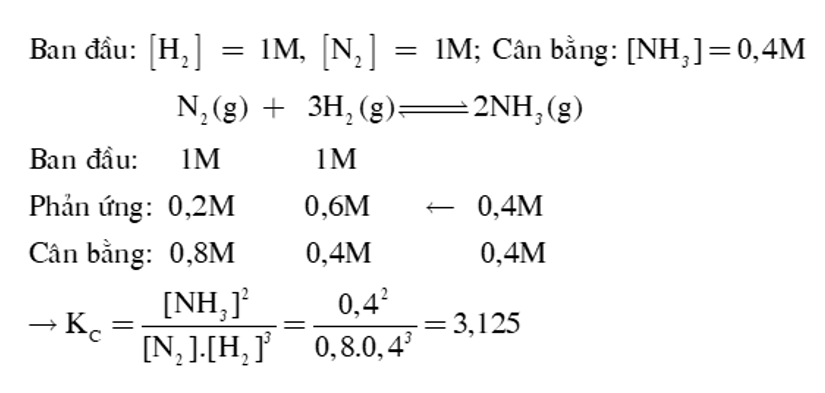
Câu 7:
Phản ứng tổng hợp ammonia:
N2 (g) + 3H2 (g) 2NH3 (g)
Biết năng lượng liên kết (kJ/mol) của N - H và H- H lần lượt là 391 và 436. Năng lượng liên kết của trong nitrogen là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 8:
Người ta cho N2 và H2 vào trong bình kín dung tích không đổi và thực hiện phản ứng: N2 + 3H2 2NH3. Sau một thời gian phản ứng đạt trạng thái cân bằng, nồng độ các chất trong bình như sau: [N2] = 3M; [H2] = 4M; [NH3] = 2M. Nồng độ mol/L của N2 và H2 ban đầu lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
N2 + 3H2 ⇌ 2NH3
Ban đầu: a b 0 mol
Phản ứng: 1 3 2 mol
Cân bằng: (a – 1) (b – 3) 2 mol
Þ [N2] cân bằng = a – 1 = 3 Þ a = 4.
[H2] cân bằng = b – 3 = 4 Þ b = 7.
Câu 10:
Các liên kết N-H trong phân tử ammonia là liên kết:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các liên kết N-H trong phân tử ammonia là liên kết cộng hóa trị phân cực.
Câu 11:
Tính khử của NH3 do:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong phân tử NH3, nguyên tử N có số oxi hóa là -3, thấp nhất của nguyên tố nitrogen trong các hợp chất hóa học, vì vậy ammonia có tính khử.
Câu 12:
Công thức hoá học của muối ammonium nitrate là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Công thức hoá học của muối ammonium nitrate là NH4NO3.
Câu 13:
Hợp chất nào sau đây nitrogen có số oxi hoá là -3?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Trong hợp chất NH4Cl, nguyên tử N có số oxi hoá -3.
Câu 14:
Nhờ tạo được liên kết hydrogen với nước nên ammonia có tính chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nhờ tạo được liên kết hydrogen với nước nên ammonia dễ tan và tan nhiều trong nước.
Câu 16:
Phát biểu không đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khí NH3 (M = 17) nhẹ hơn không khí (M = 29).
Câu 17:
Phản ứng hoá học nào sau đây chứng tỏ ammonia là một chất khử mạnh?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
2NH3 + 3Cl2 N2 + 6HCl
Trong phản ứng này, số oxi hoá của N tăng từ -3 lên 0, do đó NH3 thể hiện tính khử.
Câu 19:
Nhúng hai đũa thủy tinh vào bình đựng dung dịch HCl đặc và NH3 đặc, đưa hai đầu đũa lại gần nhau thấy xuất hiện khói trắng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Khói trắng là NH4Cl:
NH3 + HCl → NH4Cl
Câu 20:
Cho cân bằng hoá học: N2(g) + 3H2(g) 2NH3(g); phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Thêm chất xúc tác không làm cân bằng hoá học chuyển dịch.
Câu 21:
Trong phân tử HNO3, nguyên tử N có:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
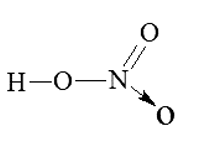
Từ công thức cấu tạo của HNO3 xác định được trong phân tử HNO3, nguyên tử N có hoá trị là IV.
Gọi số oxi hoá của N trong HNO3 là x, ta có: (+1) + x + (-2).3 = 0 Þ x = +5.
Câu 22:
Các tính chất hoá học của HNO3 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các tính chất hoá học của HNO3 là tính acid mạnh, tính oxi hóa mạnh và bị phân huỷ.
Câu 23:
Tính chất nào sau đây không phải tính chất vật lí của sulfur?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Sulfur tan tốt trong benzene.
Câu 24:
Để loại bỏ SO2 ra khỏi CO2, ta có thể dùng cách nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cho hỗn hợp khí qua dung dịch brom dư. Khí SO2 phản ứng bị giữ lại; khí CO2 không phản ứng thoát ra, thu được CO2 tinh khiết.
Câu 25:
SO2 luôn thể hiện tính khử trong các phản ứng với:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
SO2 luôn thể hiện tính khử trong các phản ứng với: O2, nước Br2, dung dịch KMnO4.
Câu 26:
Để nhận biết anion có trong dung dịch K2SO4, không thể dùng thuốc thử nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
MgCl2 không tác dụng với K2SO4 do đó không thể dùng MgCl2 để nhận ra ion
Câu 27:
Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Do SO2 phản ứng được với xút tạo thành muối.
Câu 28:
Cho phản ứng: SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4.
Trong phương trình hóa học của phản ứng trên, khi hệ số của KMnO4 là 2 thì hệ số của SO2 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Câu 29:
Trong điều kiện thích hợp, xảy ra các phản ứng sau:
(a) 2H2SO4 + C 2SO2 + CO2 + 2H2O.
(b) H2SO4 + Fe(OH)2 FeSO4 + 2H2O.
(c) 4H2SO4 + 2FeO Fe2(SO4)3 + SO2 + 4H2O.
(d) 6H2SO4 + 2Fe Fe2(SO4)3 + 3SO2 + 6H2O.
Trong các phản ứng trên, phản ứng xảy ra với dung dịch H2SO4 loãng là
 Xem đáp án
Xem đáp án
Phản ứng (b) Nguyên tử Fe không thay đổi số oxi hóa sau phản ứng ⇒ phản ứng của H2SO4 loãng
Câu 30:
Cho các phát biểu sau:
(a) Sulfuric acid đặc có tính háo nước, gây bỏng nặng khi tiếp xúc với da tay.
(b) Khi pha loãng sulfuric acid đặc cần cho từ từ nước vào acid, không làm ngược lại gây nguy hiểm.
(c) Khi bị bỏng sulfuric acid đặc, điều đầu tiên cần làm là xả nhanh chỗ bỏng với nước lạnh.
(d) Sulfuric acid loãng có tính oxi hóa mạnh, khi tác dụng với kim loại không sinh ra khí hydrogen.
(e) Thuốc thử nhận biết sulfuric acid và muối sulfate là ion Ba2+ trong BaCl2, Ba(OH)2, Ba(NO3)2.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Bao gồm: a, c, e.
(b) Sai vì khi pha loãng sulfuric acid đặc cần cho từ từ acid đặc vào nước.
(d) Sai vì sulfuric acid loãng khi tác dụng với kim loại có sinh ra khí hydrogen.