Đề kiểm tra cuối học kì 1 Hóa 11 Cánh diều có đáp án (Đề 3)
-
80 lượt thi
-
31 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Cho cân bằng hoá học: N2 (g) + 3H2 (g) 2NH3 (g); phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
 Xem đáp án
Xem đáp án
Chọn D
Câu 2:
Sự phá vỡ cân bằng cũ để chuyển sang một cân bằng mới do các yếu tố bên ngoài tác động được gọi là
 Xem đáp án
Xem đáp án
Chọn B
Câu 3:
Cho dãy các chất sau: KOH, NaCl, H2SO3, CuO, C6H12O6 (glucose). Số chất không điện li có trong dãy là
 Xem đáp án
Xem đáp án
Chọn B
Câu 9:
Lưu ý bắt buộc để đảm bảo an toàn khi sử dụng dung dịch sulfuric acid đặc là
 Xem đáp án
Xem đáp án
Chọn D
Câu 10:
Chất nào sau đây được dùng làm vật liệu xây dựng, nặn đúc tượng, bó chỉnh hình trong y học?
 Xem đáp án
Xem đáp án
Chọn B
Câu 16:
Các chất hữu cơ có tính chất hoá học tương tự nhau và thành phần phân tử hơn kém nhau một hay nhiều nhóm CH2 được gọi là các chất
 Xem đáp án
Xem đáp án
Chọn b
Câu 17:
Cho phản ứng sau: 2C(s) + O2(g) ⇌ 2CO(g). Biểu thức hằng số cân bằng KC của phản ứng là
 Xem đáp án
Xem đáp án
Chọn B
Câu 18:
Cho phản ứng thuận nghịch sau:
NH3 + H2O ⇌
Trong phản ứng nghịch, theo thuyết Bronsted – Lowry chất nào là base?
 Xem đáp án
Xem đáp án
Chọn C
Câu 22:
Sulfur dioxide có thể tham gia những phản ứng sau:
(1) SO2 + Br2 + 2H2O H2SO4 + 2HBr
(2) SO2 + 2H2S 3S + 2H2O
Câu nào sau đây diễn tả không đúng tính chất của các chất trong phản ứng trên?
 Xem đáp án
Xem đáp án
Chọn C
Câu 25:
Cho hỗn hợp các alkane có mạch carbon thẳng sau: pentane (sôi ở 36 °C), heptane (sôi ở 98 °C), octane (sôi ở 126 °C) và nonane (sôi ở 151 °C). Có thể tách riêng các chất đó bằng cách nào sau đây?
 Xem đáp án
Xem đáp án
Chọn D
Câu 26:
Phổ khối lượng của hợp chất hữu cơ X được cho như hình vẽ bên dưới:
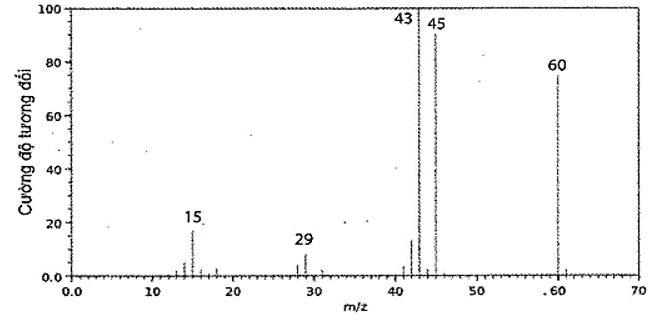
Phân tử khối của hợp chất hữu cơ X là
 Xem đáp án
Xem đáp án
Chọn B
Câu 29:
Acetone là một hợp chất hữu cơ dùng để làm sạch dụng cụ trong phòng thí nghiệm, tẩy rửa sơn móng tay…. Kết quả phân tích nguyên tố của acetone như sau: 62,07% C; 27,59% O về khối lượng, còn lại là hydrogen. Lập công thức phân tử của acetone. Biết phân tử khối của acetone được xác định thông qua phổ khối lượng dưới đây:
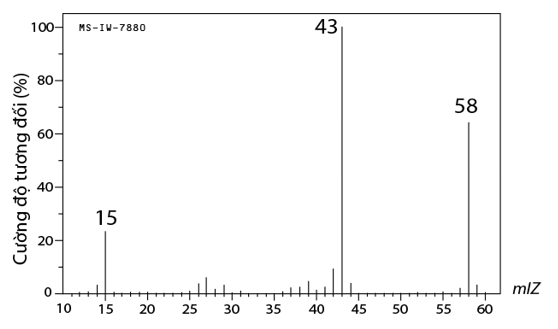
 Xem đáp án
Xem đáp án
%mH = 100% - 62,07% - 27,59% = 10,34%.
Đặt công thức phân tử của acetone là: CxHyOz.
Ta có:
x : y : z = \[\frac{{\% {m_C}}}{{12}}:\frac{{\% {m_H}}}{1}:\frac{{\% {m_O}}}{{16}} = \frac{{62,07}}{{12}}:\frac{{10,34}}{1}:\frac{{27,59}}{{16}} = 3:6:1\]
Công thức đơn giản nhất của acetone là: C3H6O.
Công thức phân tử của acetone theo công thức đơn giản nhất có dạng: (C3H6O)n.
Từ phổ khối lượng của acetone xác định được Macetone = 58 Þ n = 1.
Công thức phân tử của acetone là: C3H6O.
Câu 30:
Giải thích vì sao mặc dù có cùng công thức phân tử C2H4O2 nhưng acetic acid (CH3COOH) có tính chất khác với methyl formate (HCOOCH3).
 Xem đáp án
Xem đáp án
Tính chất của các chất phụ thuộc vào thành phần phân tử (loại nguyên tố, số lượng nguyên tử) và cấu tạo hoá học (trật tự liên kết của các nguyên tử với nhau).
Do đó dù có cùng công thức phân tử C2H4O2 nhưng acetic acid có tính chất khác với methyl formate do cấu tạo hoá học khác nhau.
Câu 31:
Em hãy nêu ít nhất 2 biện pháp giảm thải lượng sulfur dioxide vào không khí và cho biết cơ sở của các biện pháp này.
 Xem đáp án
Xem đáp án
- Một số biện pháp giảm thải lượng sulfur dioxide vào không khí và cơ sở hoá học của nó:
+ Thay thế dần các nhiên liệu hoá thạch bằng nhiên liệu thân thiện với môi trường như ethanol, hydrogen, … kết hợp với khai thác các nguồn năng lượng tái tạo như năng lượng mặt trời, năng lượng gió.
Cơ sở của biện pháp: Giảm nguồn phát sinh khí SO2.
+ Dẫn khí thải của các nhà máy vào tháp hoặc bồn chứa các chất hấp phụ phù hợp, như than hoạt tính, hấp phụ khí sulfur dioxide, trước khi thải ra môi trường.
Cơ sở của biện pháp: Xử lí khí thải trước khi thải ra môi trường.
+ Chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm hơn bằng các hoá chất như vôi sống, vôi tôi hoặc đá vôi nghiền…
Cơ sở của biện pháp: Tái chế các sản phẩm phụ có chứa sulfur.