Trắc nghiệm Hóa học 11 KNTT Ôn tập chương 1 có đáp án
-
274 lượt thi
-
15 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
Một dung dịch chứa 0,2 mol Na+; 0,1 mol Mg2+; 0,05 mol Ca2+; 0,15 mol HCO3- và x mol Cl-. Giá trị của x là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Áp dụng định luật bảo toàn điện tích ta có:
0,2.1 + 0,1.2 + 0,05.2 = 0,15.1 + x.1 → x = 0,35.
Câu 2:
Dung dịch X chứa các ion: Fe2+ (0,1 mol), Al3+ (0,2 mol), Cl- (x mol), SO42- (y mol). Cô cạn dung dịch X thu được 46,9 gam muối rắn. Giá trị của x và y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
\[\left\{ \begin{array}{l}BTDT:\,x + 2y = 0,1.2 + 0,2.3 = 0,8\,\\BTKL:\,0,1.56 + 0,2.27 + 35,5x + 96y = 46,9\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,2\,mol\\y = \,0,3\,mol\end{array} \right.\]
Câu 3:
Trong dung dịch trung hòa về điện, tổng đại số điện tích của các ion bằng không. Dung dịch A có chứa 0,01 mol Mg2+; 0,01 mol Na+; 0,02 mol Cl- và x mol SO42. Giá trị của x là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Áp dụng định luật bảo toàn điện tích ta có:
0,01.2 + 0,01.1 = 0,02.1 + x.2 → x = 0,005.
Câu 4:
Dung dịch X gồm a mol Na+; 0,15 mol K+; 0,1 mol HCO3− ; 0,15 mol CO32− và 0,05 mol SO42−. Tổng khối lượng muối trong dung dịch X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Áp dụng định luật bảo toàn điện tích ta có:
a.1 + 0,15.1 = 0,1.1 + 0,15.2 + 0,05.2 → a = 0,35.
Tổng khối lượng muối trong dung dịch X là:
0,35.23 + 0,15.39 + 0,1.61 + 0,15.60 + 0,05.96 = 33,8 gam.
Câu 5:
Giá trị pH của dung dịch NaOH 0,1 M là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
\[NaOH \to N{a^ + } + O{H^ - }\]
Nồng độ ion \[\left[ {O{H^ - }} \right]\]là 0,1 = 10-1 M
Giá trị pH = 14 + log(10-1) = 13.
Câu 6:
Giá trị pH của dung dịch HCl 0,001 M là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
\[HCl \to {H^ + } + C{l^ - }\]
Nồng độ ion \[\left[ {{H^ + }} \right]\] là 0,001 = 10-3 M
Giá trị pH = -log(10-3) = 3.
Câu 7:
Giá trị pH của dung dịch H2SO4 0,005 M là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
\[{H_2}S{O_4} \to 2{H^ + } + SO_4^{2 - }\]
Nồng độ ion \[\left[ {{H^ + }} \right]\] là 0,005.2 = 0,01 = 10-2 M
Giá trị pH = -log(10-2) = 2.
Câu 8:
Pha loãng dung dịch HCl có pH = 3 bao nhiêu lần để được dung dịch mới có pH = 4?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
pH = 3 thì nồng độ ion \[\left[ {{H^ + }} \right]\] là 10-3 M
pH = 4 thì nồng độ ion \[\left[ {{H^ + }} \right]\] là 10-4 M
Để được dung dịch mới có pH = 4 thì cần pha loãng dung dịch HCl có pH = 3 với số lần là \[\frac{{{{10}^{ - 3}}}}{{{{10}^{ - 4}}}} = 10\]lần.
Câu 9:
Cho a lít dung dịch KOH có pH = 12,0 vào 8,00 lít dung dịch HCl có pH = 3,0 thu được dung dịch Y có pH =11,0. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
pH = 12 → pOH = 2 → \[\left[ {O{H^ - }} \right]\]= 0,01M \[ \Rightarrow {n_{O{H^ - }}} = 0,01a(mol)\]
pH = 3 thì \[\left[ {{H^ + }} \right] = {10^{ - 3}} = 0,001M \Rightarrow {n_{{H^ + }}} = 0,008(mol)\]
Dung dịch Y có pH = 11 → Môi trường base → pOH = 3 \[ \Rightarrow \left[ {O{H^ - }} \right]\]dư = 0,001M
\[ \Rightarrow {n_{O{H^ - }}}\]dư = 0,01a – 0,008 (mol) \[ \Rightarrow \left[ {O{H^ - }} \right]\]dư = \[\frac{{0,01a - 0,008}}{{a + 8}} = 0,001 \Rightarrow a = 1,78\]
Câu 10:
Cho dung dịch X chứa hỗn hợp H2SO4 0,1 M và HNO3 0,3 M, dung dịch Y chứa hỗn hợp Ba(OH)2 0,2 M và KOH 0,1 M. Lấy a lít dung dịch X cho vào b lít dung dịch Y, thu được 1 lít dung dịch Z có pH = 13. Giá trị a, b lần lượt là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
\[{n_{{H^ + }}}\]= 2.0,1a + 0,3a = 0,5a (mol); \[{n_{O{H^ - }}}\]= 2.0,2b + 0,1b = 0,5b (mol)
pH = 13 → OH- dư; pOH = 1 \[ \Rightarrow \left[ {O{H^ - }} \right]\]dư = 0,1M → \[{n_{O{H^ - }}}\]dư = 0,1 (mol)
Ta có \[\left\{ \begin{array}{l}a + b = 1\\0,5b - 0,5a = 0,1\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,4\\b = 0,6\end{array} \right.\]
Câu 11:
Trộn 100 mL dung dịch có pH = 1 gồm HCl và HNO3 với 100 mL dung dịch NaOH nồng độ a (mol/L) thu được 200 mL dung dịch có pH = 12. Giá trị của a là (biết trong mọi dung dịch [H+][OH-] = 10-14)
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
pH = 1 \[ \Rightarrow \left[ {{H^ + }} \right]\]= 0,1M \[ \Rightarrow {n_{{H^ + }}}\]= 0,01 mol; \[{n_{O{H^ - }}}\]= 0,1a mol
pH = 12 → OH- dư, pOH = 2 \[ \Rightarrow \left[ {O{H^ - }} \right]\]dư = 0,01M → \[{n_{O{H^ - }}}\]dư = 0,002 (mol)
→ 0,1a – 0,01 = 0,002 → a = 0,12M.
Câu 12:
Trộn 250 mL dung dịch chứa hỗn hợp HCl 0,08 M và H2SO4 0,01 M với 250 mL dung dịch NaOH a M thu được 500 mL dung dịch có pH = 12. Giá trị a là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
pH = 12 → pOH = 2 \[ \Rightarrow \left[ {O{H^ - }} \right]\]dư = 0,01M → \[{n_{O{H^ - }}}\]dư = 0,5.0,01 = 0,005 (mol)
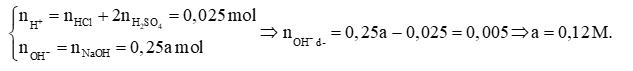
Câu 13:
Cho phản ứng hoá học sau: PCl3(g) + Cl2(g) PCl5(g)
Ở T oC, nồng độ các chất ở trạng thái cân bằng như sau: [PCl5] = 0,059 M; [PCl3] = [Cl2] = 0,035 M. Hằng số cân bằng (KC) của phản ứng tại T oC là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
\[{K_C} = \frac{{\left[ {PC{l_5}} \right]}}{{\left[ {PC{l_3}} \right]\left[ {C{l_2}} \right]}} = \frac{{0,059}}{{0,{{035}^2}}} = 48,16\]
Câu 14:
Xét cân bằng: N2O4 (k) 2NO2 (k) ở 25oC. Khi chuyển dịch sang một trạng thái cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
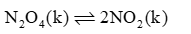
Hằng số cân bằng: \[{K_C} = \frac{{{{\left[ {N{O_2}} \right]}^2}}}{{\left[ {{N_2}{O_4}} \right]}}\]
Khi chuyển dịch sang một trạng thái cân bằng mới KC không đổi nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2 tăng lên 3 lần.
Câu 15:
Cho cân bằng hoá học sau: 2CO2(g) 2CO(g) + O2(g)
Ở T oC, nồng độ các chất ở trạng thái cân bằng như sau: [CO2] = 1,2 M, [CO] = 0,35 M và [O2] = 0,15 M. Hằng số cân bằng của phản ứng tại T oC là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
\[{{\rm{K}}_{\rm{C}}} = \frac{{0,{{35}^2}.0,15}}{{1,{2^2}}} = 1,{276.10^{ - 2}}\]
