Trắc nghiệm luyện tập : Hidrocacbon thơm có đáp án ( vận dụng)
-
601 lượt thi
-
10 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Nitro hóa benzen thu được 14,1 gam hỗn hợp hai chất nitro có khối lượng phân tử hơn kém nhau 45 đvC. Đốt cháy hoàn toàn hỗn hợp hai chất nitro này được 0,07 mol N2. Hai chất nitro đó là
 Xem đáp án
Xem đáp án
C6H6 + nHNO3 → C6H6-n(NO2)n + nH2O
C6H6-n(NO2)n → ½ nN2
Mol: ← 0,07
M = 78 + 45n = → n = 1,4
Phân tử khối hơn kém 45u → hơn kém nhau 1 nhóm -NO2
→ C6H5NO2 và C6H4(NO2)2
Đáp án cần chọn là: A
Câu 2:
TNT (2,4,6- trinitrotoluen) được điều chế bằng phản ứng của toluen với hỗn hợp gồm HNO3 đặc và H2SO4 đặc, trong điều kiện đun nóng. Biết hiệu suất của toàn bộ quá trình tổng hợp là 80%. Lượng TNT (2,4,6- trinitrotoluen) tạo thành từ 230 gam toluen là
 Xem đáp án
Xem đáp án
Phương trình phản ứng:
C6H5CH3 + 3HNO3 C6H2(NO2)3CH3 + 3H2O (1)
gam: 92 → 227
gam: 230.80% → x
Theo phương trình và giả thiết ta thấy khối lượng TNT (2,4,6-trinitrotoluen) tạo thành từ 230 gam toluen với hiệu suất 80% là :
x = = 454 gam
Đáp án cần chọn là: C
Câu 3:
Đề hiđro hóa etylbenzen ta được stiren, trùng hợp stiren ta được polistiren với hiệu suất chung 80%. Khối lượng etylbenzen cần dùng để sản xuất 10,4 kg polistiren là
 Xem đáp án
Xem đáp án
C6H5C2H5 → C6H5CH = CH2→ (CH(C6H5)−CH2−)n
npolistiren = ( mol)
→netylbenzen(pu) = n . npolistiren = 100 mol
→m etylbenzen(bd)= (g)
Đáp án cần chọn là: C
Câu 4:
Để oxi hoá hết 10,6 gam o-xilen (1,2-đimetylbenzen) cần bao nhiêu lít dung dịch KMnO4 0,5M trong môi trường H2SO4 loãng. Giả sử dùng dư 20% so với lượng phản ứng.
 Xem đáp án
Xem đáp án
Quá trình cho – nhận e:
Mn +7 + 5e → Mn +2
2C−3 → 2C+3 +12e
Bảo toàn e: 5.= 12. => phản ứng = 0,24mol
Mà KMnO4 dư 20% nên = 0,288mol
Vậy = 0,576 lít
Đáp án cần chọn là: D
Câu 7:
A, B, C là ba chất hữu cơ có %C, %H (theo khối lượng) lần lượt là 92,3% và 7,7%, tỉ lệ khối lượng mol tương ứng là 1: 2 : 3. Từ A có thể điều chế B hoặc C bằng một phản ứng. C không làm mất màu nước brom. Đốt 0,1 mol B rồi dẫn toàn bộ sản phẩm cháy qua bình đựng dung dịch nước vôi trong dư. Khối lượng dung dịch tăng hoặc giảm bao nhiêu gam ?
 Xem đáp án
Xem đáp án
Theo giả thiết ta thấy A, B, C có cùng công thức đơn giản nhất.
nC : nH = Công thức đơn giản nhất của A, B, C là CH.
Từ A có thể điều chế B hoặc C bằng một phản ứng; C không làm mất màu nước brom nên A là C2H2, B là C4H4; C là C6H6 (benzen).
Sơ đồ đốt cháy B :
C4H4 4CO2 + 2H2O (1)
mol: 0,1 → 0,4 → 0,2
Dẫn toàn bộ sản phẩm cháy vào bình đựng nước vôi trong dư thì xảy ra phản ứng :
CO2 + Ca(OH)2 → CaCO3 + H2 O (2)
mol: 0,4 → 0,4
mkết tủa = 0,4.100 = 40 gam => mdung dịch giảm = 40 – 21,2 =18,8 gam
Đáp án cần chọn là: C
Câu 8:
Một hỗn hợp X gồm 2 aren A, R đều có M < 120, tỷ khối của X đối với C2H6 là 3,067. CTPT và số đồng phân của A và R là
 Xem đáp án
Xem đáp án
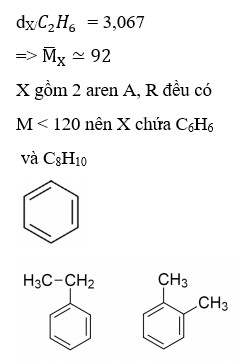
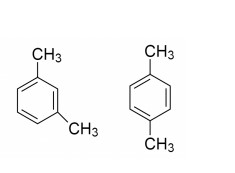
Đáp án cần chọn là: D
Câu 9:
Tiến hành trùng hợp 10,4 gam stiren được hỗn hợp X gồm polistiren và stiren (dư). Cho X tác dụng với 200 ml dung dịch Br2 0,15M, sau đó cho dung KI dư vào thấy xuất hiện 1,27 gam iot. Hiệu suất trùng hợp stiren là:
 Xem đáp án
Xem đáp án
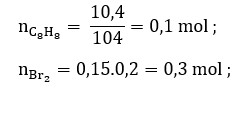

n (C6H5) CH = CH2 [ - CH(C6H5)−CH2−]n (1)
mol: 0,075
C6H5 – CH = CH2 + Br2 → C6H5 – CHBr − CH2Br (2)
mol: 0,025 → 0,025
KI + Br2 → KBr + I2 (3)
mol: 0,005 → 0,005
Theo (3) : n Br2 dư = 0,005 =>nBr2 phản ứng = nC8H8 dư = 0,025 mol
=> nC8H8 phản ứng = 0,075 mol => H = .100% = 75%
Đáp án cần chọn là: B
Câu 10:
1,3 gam chất hữu cơ A cháy hoàn toàn thu được 4,4 gam CO2 và 0,9 gam H2O. Tỉ khối hơi của A đối với oxi là d thỏa mãn điều kiện 3 < d < 3,5. Công thức phân tử của A là :
 Xem đáp án
Xem đáp án
nCO2 = 0,1 mol; nH2O = 0,05 mol
Bảo toàn nguyên tố C và H: nC (trong A) = nCO2 = 0,1 mol; nH (trong A) = 2.nH2O = 0,1 mol
=> mC + mH = 0,1.12 + 0,1 = 1,3 = mA => trong A không chứa O
CTPT của A là (CH)n
Ta có:
3 < < 3,5 => 3 < < 3,5 => 7 < n < 8,6
=> n = 8
=> CTPT của A là C8H8
Đáp án cần chọn là: B



