Đề thi cuối kì 1 Hóa 11 CTST cấu trúc mới có đáp án (Đề 3)
-
144 lượt thi
-
28 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 6:
Ở dạng phân tử, lưu huỳnh (sulfur) gồm bao nhiêu nguyên tử liên kết cộng hoá trị với nhau tạo thành mạch vòng?
 Xem đáp án
Xem đáp án
Chọn D
Câu 7:
Chất nào sau đây được sử dụng như một loại bột màu làm phụ gia pha màu cho công nghiệp sơn; cho thuỷ tinh …?
 Xem đáp án
Xem đáp án
Chọn C
Câu 10:
Chất lỏng cần tách được chuyển sang pha hơi, rồi làm lạnh cho hơi ngưng tụ, thu lấy chất lỏng ở khoảng nhiệt độ thích hợp đây là cách tiến hành của phương pháp?
 Xem đáp án
Xem đáp án
Chọn A
Câu 14:
Cho ba dung dịch riêng biệt NH4NO3, Fe2(SO4)3, NaNO3. Thuốc thử dùng để nhận biết các dung dịch trên là
 Xem đáp án
Xem đáp án
Chọn A
Câu 17:
Khi lần lượt tác dụng với mỗi chất dưới đây, trường hợp nào sulfuric acid (H2SO4) đặc, nóng và sulfuric acid (H2SO4) loãng cho sản phẩm giống nhau?
 Xem đáp án
Xem đáp án
Chọn D
Câu 18:
Cho phổ khối lượng của một hợp chất hữu cơ A như hình vẽ:
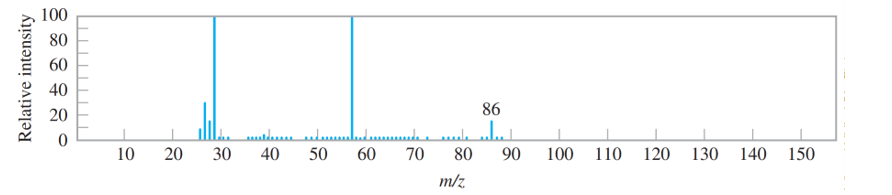
Hợp chất hữu cơ A có thể là
 Xem đáp án
Xem đáp án
Chọn A
Câu 19:
Cho các nhận định sau:
a. CH2Cl2, CH2Br-CH2Br, CHCl3, CH3COOCH3, C6H5CH3 đều là dẫn xuất của hydrocabon.
b. CH2Cl2, CH2=CH-CHO, CH3COOH, CH2=CH2 đều là hợp chất hữu cơ.
c. CHBr3, CH2=CH-COOCH3, C6H5OH, C2H5OH, (CH3)3N đều là hợp chất vô cơ.
d. Trong dãy CH3OH, CH2=CH-Cl, C6H5ONa, CH≡C-CH3 có một chất là hydrocarbon.
 Xem đáp án
Xem đáp án
|
a |
S |
|
b |
Đ |
|
c |
S |
|
d |
Đ |
Câu 20:
Sulfur dioxide có thể tham gia những phản ứng sau:
(1) SO2 + Br2 + 2H2O H2SO4 + 2HBr
(2) SO2 + 2H2S 3S + 2H2O
a. Phản ứng (1): SO2 là chất khử, Br2 là chất oxi hóa.
b. Phản ứng (2): SO2 là chất oxi hóa, H2S là chất khử.
c. Phản ứng (2): SO2 là vừa là chất khử, vừa là chất oxi hóa.
d. Phản ứng (1): Br2 là chất oxi hóa; phản ứng (2): H2S là chất khử.
 Xem đáp án
Xem đáp án
|
a |
Đ |
|
b |
Đ |
|
c |
S |
|
d |
Đ |
Câu 21:
Cho các phát biểu sau:
a. Công thức CH3 – CH2 = OH phù hợp với thuyết cấu tạo hóa học.
b. Theo thuyết cấu tạo hóa học C trong hợp chất hữu cơ có thể có hóa trị IV hoặc II.
c. Công thức CH3 – CH2 – CH2 – N không phù hợp với thuyết cấu tạo hóa học.
d. CH3CH2Cl là dẫn xuất của hydrocarbon.
 Xem đáp án
Xem đáp án
|
a |
S |
|
b |
S |
|
c |
Đ |
|
d |
Đ |
Câu 22:
Cho các công thức cấu tạo sau:
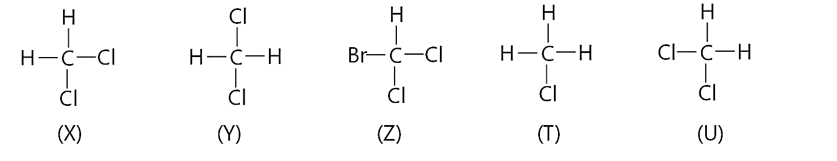
a. X, Y, Z cùng biểu diễn một chất.
b. X, T, U là đồng đẳng của nhau.
c. X, Y, U có cùng công thức phân tử CH2Cl2.
d. Y, T, U là đồng phân của nhau.
 Xem đáp án
Xem đáp án
|
a |
S |
|
b |
S |
|
c |
Đ |
|
d |
S |
Câu 23:
Một hợp chất có công thức cấu tạo:
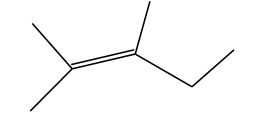
Hợp chất này có tổng số bao nhiêu nguyên tử carbon và hydrogen?
 Xem đáp án
Xem đáp án
Công thức phân tử của hợp chất hữu cơ này là: C7H14.
Vậy tổng số nguyên tử C và H có trong hợp chất này là: 21.
Câu 25:
 Xem đáp án
Xem đáp án
Các chất trong dãy vừa tác dụng với dung dịch H2SO4 loãng, vừa tác dụng với dung dịch H2SO4 đặc, nóng là: CuO, Mg, KOH, Na2CO3.
Câu 26:
Khí SO2 do các nhà máy thải ra là nguyên nhân chính trong việc gây ô nhiễm môi trường. Theo quy chuẩn kĩ thuật quốc gia về chất lượng không khí xung quanh (QCVN 05:2013/BTNMT) thì nếu lượng SO2 vượt quá 350 μg/m3 không khí đo trong 1 giờ ở một thành phố thì coi như không khí bị ô nhiễm. Nếu người ta lấy 50 lít không khí trong 1 giờ ở một thành phố và phân tích thấy có 0,012 mg SO2 thì nồng độ SO2 (μg/m3) ở khu vực đó là?
 Xem đáp án
Xem đáp án
50 lít không khí có 0,012 mg SO2.
Þ 1000 lít không khí có
Hay trong 1 m3 không khí này có 240 μg SO2.
Câu 27:
Acetone là một hợp chất hữu cơ dùng để làm sạch dụng cụ trong phòng thí nghiệm, tẩy rửa sơn móng tay…. Kết quả phân tích nguyên tố của acetone như sau: 62,07% C; 27,59% O về khối lượng, còn lại là hydrogen. Biết phân tử khối của acetone được xác định thông qua phổ khối lượng dưới đây, số lượng các nguyên tử có trong 1 phân tử acetone là?

 Xem đáp án
Xem đáp án
%mH = 100% - 62,07% - 27,59% = 10,34%.
Đặt công thức phân tử của acetone là: CxHyOz.
Ta có:
x : y : z =
Công thức đơn giản nhất của acetone là: C3H6O.
Công thức phân tử của acetone theo công thức đơn giản nhất có dạng: (C3H6O)n.
Từ phổ khối lượng của acetone xác định được Macetone = 58 Þ n = 1.
Công thức phân tử của acetone là: C3H6O.
Số lượng các nguyên tử có trong một phân tử acetone là: 10.
Câu 28:
Hỗn hợp X gồm N2 và H2 có tỉ lệ mol tương ứng là 1 : 4. Nung nóng X trong bình kín ở nhiệt độ khoảng 450oC có bột Fe xúc tác, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 4. Hiệu suất của phản ứng tổng hợp NH3 là h%. Giá trị của h là?
 Xem đáp án
Xem đáp án
Giả sử có 1 mol N2 và 4 mol H2.
Phương trình hoá học: N2 + 3H2 ⇌ 2NH3
Ban đầu: 1 4 0 mol
Phản ứng: x 3x 2x mol
Sau phản ứng: (1 – x) (4 – 3x) 2x mol
Tổng số mol khí sau phản ứng: nsau = (1 – x) + (4 – 3x) + 2x = 5 – 2x (mol).
Áp dụng định luật bảo toàn khối lượng có:
mtrước = msau ⇔ 28.1 + 2.4 = (5 – 2x).4.2 Þ x = 0,25.
Giả sử h = 100% thì N2 hết, do đó hiệu suất phản ứng tính theo N2.
Ta có: h% = = 25%.
