Đề thi cuối kì 1 Hóa 11 KNTT cấu trúc mới có đáp án (Đề 1)
-
154 lượt thi
-
28 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 2:
Trong các dung dịch acid sau có cùng nồng độ 0,1 M, dung dịch nào có pH cao nhất?
 Xem đáp án
Xem đáp án
Chọn A
Câu 4:
Ở trạng thái lỏng nguyên chất, phân tử chất nào sau đây tạo được liên kết hydrogen với nhau?
 Xem đáp án
Xem đáp án
Chọn B
Câu 9:
Bước sơ cứu đầu tiên cần làm ngay khi một người sulfuric acid đậm đặc đổ vào tay gây bỏng là
 Xem đáp án
Xem đáp án
Chọn A
Câu 10:
Chất nào sau đây được dùng để làm thuốc cung cấp magnesium cho cơ thể, giúp giảm cơn đau cơ, giảm hiện tượng chuột rút?
 Xem đáp án
Xem đáp án
Chọn C
Câu 12:
Trong thành phần phân tử hợp chất hữu cơ nhất định phải có nguyên tố nào sau đây?
 Xem đáp án
Xem đáp án
Chọn B
Câu 13:
Chưng cất là phương pháp tách chất dựa vào sự khác nhau về tính chất vật lí (ở một áp suất nhất định) nào sau đây của các chất trong hỗn hợp?
 Xem đáp án
Xem đáp án
Chọn A
Câu 14:
Phương pháp nào sau đây là phương pháp quan trọng để tách biệt và tinh chế những chất hữu cơ ở dạng rắn?
 Xem đáp án
Xem đáp án
Chọn C
Câu 19:
Cho phản ứng hoá học sau:
SO2 + 2NaOH → Na2SO3 + H2O
Vai trò của của SO2 trong phản ứng trên là
 Xem đáp án
Xem đáp án
Chọn C
Câu 20:
Với một phản ứng thuận nghịch bất kì tại trạng thái cân bằng:
a). Tốc độ của phản ứng thuận bằng tốc độ của phản ứng nghịch.
b). Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
c). Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm.
d). Phản ứng thuận và phản ứng nghịch vẫn diễn ra.
 Xem đáp án
Xem đáp án
|
a |
Đ |
|
b |
Đ |
|
c |
S |
|
d |
Đ |
Câu 21:
Cho các nhận định về ammonia.
a). Ở điều kiện thường, ammonia là chất khí có mùi khai, xốc và độc.
b). Khi tan trong nước tạo thành dung dịch có tính base.
c). Có cấu trúc tam giác phẳng.
d). Có khả năng nhận proton.
 Xem đáp án
Xem đáp án
|
a |
Đ |
|
b |
Đ |
|
c |
S |
|
d |
Đ |
Câu 22:
Cho các phát biểu sau:
a). HCHO và C6H12O6 thuộc cùng một dãy đồng đẳng.
b). CH3OH và CH3CH2OH là đồng đẳng của nhau.
c). CH3OCH3 và CH3CH2OH đều là dẫn xuất của hydrocarbon.
d). C6H5OH và C2H5OH là đồng phân của nhau.
 Xem đáp án
Xem đáp án
|
a |
S |
|
b |
Đ |
|
c |
Đ |
|
d |
S |
Câu 23:
Cho dãy chất: CH4; C6H6; C6H5-OH; C2H5ZnI; C2H5PH2.
a). Các chất trong dãy đều là hydrocarbon
b). Có 2 chất là hydrocarbon.
c). Các chất trong dãy đều là hợp chất hữu cơ.
d). Có 3 hợp chất vô cơ và 2 hợp chất hữu cơ.
 Xem đáp án
Xem đáp án
|
a |
S |
|
b |
Đ |
|
c |
Đ |
|
d |
S |
Câu 24:
Cho các phản ứng hoá học sau:
(1). Fe + 2HCl → FeCl2 + H2
(2). Ba + 2H2O → Ba(OH)2 + H2
(3). Cl2 + H2O ⇌ HCl + HClO
(4). CO2 + 2NaOH → Na2CO3 + H2O
Số phản ứng thuận nghịch là?
 Xem đáp án
Xem đáp án
Chỉ có phản ứng (3) là phản ứng thuận nghịch.
Câu 25:
Dẫn khí SO2 vào 200 mL dung dịch KMnO4 0,02 M đến khi mất màu tím theo sơ đồ phản ứng:
Thể tích khí SO2 (đkc) mL đã phản ứng là? (kết quả làm tròn đến hàng đơn vị).
 Xem đáp án
Xem đáp án
Vkhí = 0,01.24,79 = 0,2479 lít = 248 mL.
Câu 26:
Kết quả phân tích nguyên tố cho thấy thành phần phần trăm khối lượng các nguyên tố có trong hợp chất X như sau: carbon là 52,17%; hydrogen là 13,04%; còn lại là oxygen. Nghiên cứu cũng xác định được phân tử khối của chất X này là 46. Tổng số nguyên tử có trong 1 phân tử X là?
 Xem đáp án
Xem đáp án
%O = 100% - %C - %H = 100% - 52,17% - 13,04% = 34,79%.
Đặt công thức đơn giản nhất của hợp chất X là: CxHyOz. Ta có:
x : y : z =
= 4,3475 : 13,04 : 2,17 = 2 : 6 : 1.
Vậy công thức đơn giản nhất của X là: C2H6O.
Þ Công thức phân tử của X có dạng: (C2H6O)n.
Phân tử khối của X là 46 nên (12.2 + 6 + 16).n = 46 Þ n = 1.
Vậy công thức phân tử của X là: C2H6O.
Tổng số nguyên tử có trong X là: 2 + 6 + 1 = 9.
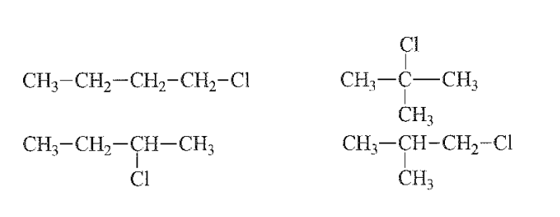
Câu 27:
 Xem đáp án
Xem đáp án
C4H9Cl có đồng phân cấu tạo về mạch carbon và vị trí nhóm thế (nhóm –Cl) trên mạch.
Câu 28:
Thực hiện phản ứng tổng hợp ammonia từ và với hiệu suất h%, thu được hỗn hợp X chứa 10% (về thể tích). Cho X tác dụng với CuO dư, nung nóng. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp Y (gồm khí và hơi) và hỗn hợp rắn Z có khối lượng giảm đi so với khối lượng CuO ban đầu là 12,8 gam. Làm lạnh Y, còn 7,437 lít khí (đkc) không bị ngưng tụ. Giá trị của h là?
 Xem đáp án
Xem đáp án
Sau khi ngưng tụ còn lại khí N2 ⟹ = 0,3 mol = (ban đầu).
N2 + 3H2 ⇌ 2NH3
3CuO + 2NH3 3Cu + N2 + 3H2O
CuO + H2 Cu + H2O
mchất rắn giảm = mO phản ứng = 12,8 gam ⟹ nO phản ứng = 0,8 mol.
Bảo toàn electron toàn bộ quá trình: (ban đầu) = 2nO phản ứng ⟹ (ban đầu) = 0,8 (mol).
Ta thấy: ⟹ Hiệu suất tính theo H2.
N2 + 3H2 ⇌ 2NH3
Ban đầu: 0,3 0,8 (mol)
Phản ứng: x 3x 2x (mol)
Sau: (0,3 − x) (0,8 − 3x) 2x (mol)
⟹ nSau = (0,3 − x) + (0,8 − 3x) + 2x = 1,1 − 2x (mol)
Mà = 10% ⟹ = 1,1 ⟹ x = 0,05.
