Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 28)
-
3864 lượt thi
-
16 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Phương pháp giải:
Dựa vào phương pháp điều chế N2 trong phòng thí nghiệm.
Giải chi tiết:
Trong phòng thí nghiệm, người ta thường điều chế N2 bằng phương pháp đun nóng dung dịch NH4NO2 bão hòa:
NH4NO2 N2 + 2H2O
Câu 2:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Nhiệt phân các muối nitrat kim loại M(NO3)n:
Muối nitrat của các kim loại hoạt động mạnh [K, …, Ca] bị nhiệt phân thu được muối nitrit và O2.
Muối nitrat của các kim loại [Mg, …, Cu] bị nhiệt phân thu được oxit bazo, NO2 và O2.
Muối nitrat của các kim loại [Hg, Ag, …] bị nhiệt phân thu được kim loại, NO2 và O2.
Giải chi tiết:
4Fe(NO3)3 2Fe2O3 + 12NO2 + 3O2
Vậy nhiệt phân muối Fe(NO3)3 thu được Fe2O3, NO2 và 3O2
Câu 3:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Tính tỉ lệ
Qua sơ đồ ta thấy:
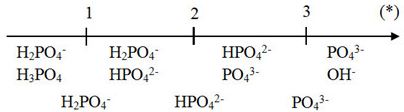
(*) ≤ 1 => tạo muối H2PO4-
1 < (*) < 2 => tạo muối H2PO4- và HPO42-
(*) = 2 => tạo muối HPO42-
2 < (*) < (3) => tạo muối HPO42- và PO43-
(*) ≤ 3 => tạo muối PO43-
Giải chi tiết:
Ta có: => tạo muối NaH2PO4 và Na2HPO4
Câu 4:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
- Những chất không phản ứng với nhau có thể tồn tại trong cùng một dung dịch.
- Các ion phản ứng với nhau khi tạo thành kết tủa/chất khí/chất điện li yếu.
Giải chi tiết:
A loại vì Ag+ + SO42- → Ag2SO4 ↓
B đúng
C loại vì Fe2+ + S2- → FeS↓
D loại vì Fe3+ + 3OH- → Fe(OH)3↓
Câu 5:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Phương pháp giải:
Đánh giá độ dinh dưỡng của phân đạm người ta dựa vào % khối lượng của N, phân lân dựa vào % khối lượng của P2O5, phân kali dựa vào 5 khối lượng của K2O.
Giải chi tiết:
Phân bón hóa học: Đạm, Lân, Kali lần lượt được đánh giá theo chỉ số hàm lượng % khối lượng N, P2O5, K2O.
Câu 6:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Phương pháp giải:
Giải chi tiết:
Để tạo độ xốp cho một số loại bánh, người ta thường dùng bột nở có thành phần hóa học chính là NH4HCO3.
NH4HCO3 NH3 + CO2 + H2O
Câu 7:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
HNO3 thể hiện tính oxi hóa khi phản ứng với các chất khử (chất có khả năng tăng số oxi hóa)
Giải chi tiết:
A đúng
B loại CuO, CaCO3
C loại CaO
D loại Fe2O3
Câu 8:
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng
(a) bông khô (b) bông có tẩm nước
(c) bông có tẩm nước vôi trong (d) bông có tẩm giấm ăn
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Phương pháp giải:
Để ngăn khí độc ta dùng hóa chất phản ứng với khí đó tạo thành chất không độc.
Giải chi tiết:
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là dùng bông có tẩm nước vôi trong để nút vào ống nghiệm.
2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
Câu 9:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Phương pháp giải:
HF có khả năng hòa tan SiO2 (thành phần chính của thủy tinh).
Giải chi tiết:
HF có khả năng hòa tan SiO2 (thành phần chính của thủy tinh) do đó HF được dùng để khắc chữ lên thủy tinh:
SiO2 + 4HF → SiF4 + 2H2O.
Câu 10:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Phương pháp giải:
Đặt công thức của thủy tinh là: xK2O.yCaO.zSiO2
Giải chi tiết:
Đặt công thức của thủy tinh là: xK2O.yCaO.zSiO2
Vậy công thức của thủy tinh là K2O.CaO.6SiO2.
Câu 11:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
Giải chi tiết:
Phản ứng chứng tỏ axit silixic yếu hơn axit cacbonic là:
Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3
Câu 12:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Bài toán CO2 tác dụng với dung dịch kiềm:
Tính tỉ lệ:
+ (*) ≥ 2 => Chỉ tạo muối CO32-
+ 1 < (*) < 2 => Tạo muối CO32- và HCO3-
+ (*) ≤ 1 => Chỉ tạo muối HCO3-
Giải chi tiết:
nCO2 = 0,896 : 22,4 = 0,04 mol; nOH- = 2nCa(OH)2 = 2.3.0,01 = 0,06 mol; nCa2+ = nCa(OH)2 = 0,03 mol
Ta có: => Tạo muối CO32- và HCO3-
Đặt nCO32- = x (mol) và nHCO3- = y (mol)
CO2 + 2OH- → CO32- + H2O
x 2x x
CO2 + OH- → HCO3-
y y y
+ nCO2 = x + y = 0,04 (1)
+ nOH- = 2x + y = 0,06 (2)
Giải hệ (1) và (2) thu được x = 0,02 và y = 0,02
Ca2+ + CO32- → CaCO3↓
BĐ: 0,03 0,02 (mol)
PƯ: 0,02 ← 0,02 → 0,02 (mol)
Khối lượng kết tủa thu được là: mCaCO3 = 0,02.100 = 2 gam
Câu 13:
Hoàn thành sơ đồ phản ứng sau (ghi rõ điều kiện, xúc tác nếu có):
 Xem đáp án
Xem đáp án
Phương pháp giải:
Dựa vào tính chất hóa học của nitơ và hợp chất của nitơ để hoàn thành dãy chuyển hóa.
Giải chi tiết:
(1) NH4Cl + NaOH → NaCl + NH3 + H2O
(2) 4NH3 + 3O2 2N2 + 6H2O
(3) N2 + O2 2NO
(4) 2NO + O2 → 2NO2
(5) 4NO2 + O2 + 2H2O → 4HNO3
(6) HNO3 + NaOH → NaNO3 + H2O
(7) 2NaNO3 2NaNO2 + O2
(8) 3HNO3 + Na3PO4 → 3NaNO3 + H3PO4
Câu 14:
Cho dung dịch HCl vào dung dịch Na2SiO3.
 Xem đáp án
Xem đáp án
Khi cho dung dịch HCl vào dung dịch Na2SiO3 thu được kết tủa không màu dưới dạng keo:
2HCl + Na2SiO3 → 2NaCl + H2SiO3 ↓
Câu 15:
Cho dung dịch Ba(HCO3)2 vào dung dịch NaHSO4.
 Xem đáp án
Xem đáp án
Cho dung dịch Ba(HCO3)2 vào dung dịch NaHSO4 xuất hiện kết tủa trắng và sủi bọt khí không màu:
Ba(HCO3)2 + 2NaHSO4 → BaSO4↓+ Na2SO4 + 2H2O + 2CO2 ↑
Câu 16:
Hòa tan hoàn toàn 25,6 gam hỗn hợp A gồm Cu và Fe2O3 vào dung dịch HNO3 2M (dư 20% so với lượng cần phản ứng) thu được dung dịch B và 2,24 lít NO (đktc) là sản phẩm khử duy nhất.
a. Viết phương trình phản ứng hóa học xảy ra.
b. Tính phần trăm khối lượng Fe2O3 trong hỗn hợp A?
c. Tính thể tích dung dịch HNO3 ban đầu?
d. Lấy dung dịch B đem cô cạn rồi nung tới khối lượng không đổi thì thu được m gam chất rắn. Tính giá trị của m?
 Xem đáp án
Xem đáp án
a. PTHH:
(1) 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
(2) Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
b. nNO = 2,24 : 22,4 = 0,1 mol
Áp dụng định luật bảo toàn electron ta có: 2nCu = 3nNO => nCu = 1,5nNO = 1,5.0,1 = 0,15 mol
=> mFe2O3 = m hỗn hợp – mCu = 25,6 – 0,15.64 = 16 gam => nFe2O3 = 16 : 160 = 0,1 mol
=> %mFe2O3 = (16 : 25,6).100% = 62,5%
c.
Theo PTHH (1) và (2): nHNO3 pư = 8nCu/3 + 6nFe2O3 = 8.0,15/3 + 6.0,1 = 1 mol
=> nHNO3 bđ = nHNO3 pư.120/100 = 1,2 mol
d. Dung dịch B gồm có: Cu(NO3)2 (0,15 mol) và Fe(NO3)3 (0,1 mol)
Nung hỗn hợp đến khối lượng không đổi:
2 Cu(NO3)2 2 CuO + 4 NO2 + O2
0,15 → 0,15
4 Fe(NO3)3 2 Fe2O3 + 12 NO2 + 3O2
0,1 → 0,05
=> m chất rắn = mCuO + mFe2O3 = 0,15.80 + 0,05.160 = 20 gam
