Bài tập nitric acid
-
1172 lượt thi
-
25 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
nNO= 0,2 mol
Quá trình cho – nhận e:
\[\mathop M\limits^0 \, \to \mathop M\limits^{ + n} \,\, + \,ne{\rm{\;\;\;\;\;\;}}\,\,\,\,\,\,\,\,{\rm{\;\;\;}}\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O\]
\[\frac{{0,6}}{n}\;\;{\rm{ }}\; \leftarrow \;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;0,6\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}0,6\;{\rm{ }}\; \leftarrow \;{\rm{ }}\;0,2\]
\[ = >\,\,\frac{{19,2}}{M} = \frac{{0,6}}{n}\,\, = >\,\,M = 32n\]
Với n = 2 =>M = 64 =>M là Cu
Đáp án cần chọn là: B
Câu 2:
Hoà tan hết 5,4 gam kim loại M trong HNO3dư được 8,96 lít khí đktc gồm NO và NO2, dX/H2 = 21. Tìm M biết rằng N+2và N+4là sản phẩm khử của N+5
 Xem đáp án
Xem đáp án
Gọi nNO= x mol; nNO2= y mol
=>nhỗn hợp khí= x + y = 0,4 mol (1)
\[\bar M = \frac{{30x + 46y}}{{x + y}} = 21.2\](2)
Từ (1) và (2) =>x = 0,1; y = 0,3
Quá trình cho – nhận e:
\[\begin{array}{*{20}{c}}{}&{\mathop M\limits^0 \, \to \mathop M\limits^{ + n} \,\, + \,ne;\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O}\\{}&{\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} \,\,\, + {\rm{\;1}}e \to \mathop {\,N}\limits^{ + 4} \,{O_2}}\end{array}\]
Bảo toàn e: ne cho = ne nhận= 3.nNO+ nNO2= 0,6
\[ = >\,\,\frac{{5,4}}{M}.n = 0,6\,\, = >\,\,M = 9n\]
Với n = 3 =>M = 27 =>M là Al
Đáp án cần chọn là: B
Câu 3:
 Xem đáp án
Xem đáp án
Gọi số mol của Al và Fe lần lượt là x và y mol
=>mhỗn hợp= 27x + 56y = 11 (1)
Quá trình cho – nhận e:
\[Al \to \mathop {Al}\limits^{ + 3} \,\,\,\, + \,\,\,3e{\rm{\;\;\;\;\;\;}}\,\,\,\,\,\,\,\,{\rm{\;\;}}\]
\[\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O\]
\[Fe\, \to \mathop {\,Fe}\limits^{ + 3} \,\,\, + \,\,\,3e\]
Bảo toàn e: 3.nAl + 3.nFe= 3.nNO=>x + y = 0,3 (2)
Từ (1) và (2) =>x = 0,2; y = 0,1
=>mAl= 0,2.27 = 5,4 gam; mFe= 0,1.56 = 5,6 gam
Đáp án cần chọn là: B
Câu 4:
 Xem đáp án
Xem đáp án
Xét quá trình cho – nhận e:
\[Al \to \mathop {Al}\limits^{ + 3} \,\, + \,3e{\rm{\;}}\]
\[{\rm{\;}}\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O\]
\[\,\,\mathop {2N}\limits^{ + 5} \,\,\, + {\rm{\;8}}e \to \mathop {\,{N_2}}\limits^{ + 1} \,O\]
Bảo toàn e: 3.nAl= 3.nNO+ 8.nN2O=>nAl = (3.0,01 + 8.0,015) / 3 = 0,05 mol
=>m = 0,05.27 = 1,35 gam
Đáp án cần chọn là: C
Câu 5:
Cho 6,4 gam Cu tan vừa đủ trong 200ml dung dịch HNO3thu được khí X gồm NO và NO2, dX/H2 = 18 (không còn sản phẩm khử nào khác của N+5). Nồng độ mol/lít của dung dịch HNO3đã dùng là
 Xem đáp án
Xem đáp án
nCu= 0,1 mol
Gọi số mol của NO và NO2lần lượt là x và y mol
Xét quá trình cho – nhận e:
\[Cu \to \mathop {Cu}\limits^{ + 2} \,\, + \,2e\]
\[\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O\]
\[\mathop N\limits^{ + 5} \,\,\, + {\rm{\;1}}e \to \mathop {\,N}\limits^{ + 4} \,{O_2}\]
Bảo toàn e: 2.nCu= 3.nNO+ nNO2=>3x + y = 0,2 (1)
\[{\bar M_X} = \frac{{30x + 46y}}{{x + y}} = 18.2\,\,\,\,(2)\]
Từ (1) và (2) =>x = 1/18 mol; y = 1/30 mol
Bảo toàn nguyên tố N: nHNO3 phản ứng = nNO3 (trong muối)+ nNO+ nNO2= 0,1.2 + 1/18 + 1/30 = 13/45 mol
=>CM HNO3= 13/9 M
Đáp án cần chọn là: D
Câu 6:
 Xem đáp án
Xem đáp án
Bước 1: Tính ne cho
Bảo toàn e: ne cho= ne nhận= 3.nNO+ nNO2= 3.0,01 + 0,04 = 0,07 mol
Bước 2: Tính mmuối
- n
NO3 (trong muối)= ne cho= 0,07 mol⟹ mNO3= 62.0,07 = 4,34 gam
- mmuối= mkim loại+ mNO3= 1,35 + 4,34 = 5,69 gam
Đáp án cần chọn là: C
Câu 7:
Hòa tan hoàn toàn 8,9 gam hỗn hợp gồm Mg và Zn bằng lượng vừa đủ 500 ml dung dịch HNO31M. Sau khi các phản ứng kết thúc, thu được 1,008 lít khí N2O (đktc, khí duy nhất) và dung dịch X chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
nN2O= 0,045 mol
Gọi số mol của Mg và Zn lần lượt là x và y mol =>mhỗn hợp = 24x + 65y = 8,9 (1)
Giả sử trong X chứa muối NH4NO3(a mol)
Xét quá trình cho – nhận e:
\[\begin{array}{*{20}{c}}{}&{Mg \to \mathop {Mg}\limits^{ + 2} \,\, + \,2e{\rm{\;\;\;\;\;\;}}\,\,\,\,\,\,\,\,{\rm{\;\;}}\mathop {2N}\limits^{ + 5} \,\,\, + {\rm{\;8}}e \to \mathop {\,N}\limits^{ + 1} {\,_2}O}\\{}&{Zn \to \mathop {Zn}\limits^{ + 2} \,\, + \,2e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} \,\,\, + 8e \to \mathop {\,N}\limits^{ - 3} \,{H_4}}\end{array}\]
Bảo toàn e: 2.nMg+ 2.nZn= 8.nN2O+ 8.nNH4NO3=>2x + 2y = 0,36 + 8a (2)
nNO3 (trong muối)= ne cho= 2x + 2y mol
Bảo toàn nguyên tố N: nHNO3= nNO3 (trong muối)+ 2.nN2O+ 2.nNH4NO3
=>0,5 = 2x + 2y + 2.0,045 + 2a (3)
Từ (1), (2) và (3) =>x = 0,1; y = 0,1; a = 0,005
=>mmuối= mkim loại + mNO3 (trong muối KL) + mNH4NO3= 8,9 + 62.(2.0,1 + 2.0,1) + 80.0,005 = 34,1 gam
Đáp án cần chọn là: B
Câu 8:
Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3loãng dư thấy không có khí bay ra và trong dung dịch chứa 113,4 gam Zn(NO3)2và 8 gam NH4NO3. Phần trăm khối lượng Zn trong X là
 Xem đáp án
Xem đáp án
nZn(NO3)2= 0,6 mol; nNH4NO3 = 0,1 mol
ZnO tác dụng với HNO3không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa
Bảo toàn e: 2.nZn= 8.nNH4NO3=>nZn= 4.0,1 = 0,4 mol
Bảo toàn nguyên tố Zn: nZn(NO3)2= nZn+ nZnO=>nZnO= 0,6 – 0,4 = 0,2 mol
\[ = >\,\,{\rm{\% }}{m_{Zn}} = \frac{{0,4.65}}{{0,4.65 + 0,2.81}}.100{\rm{\% }} = 61,61{\rm{\% }}\]
Đáp án cần chọn là: C
Câu 9:
 Xem đáp án
Xem đáp án
nMg= 0,28 mol; nMgO= 0,02 mol
MgO tác dụng với HNO3không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa
Ta có: nMg(NO3)2= nMg+ nMgO= 0,28 + 0,02 = 0,3 mol =>mMg(NO3)2= 44,4 gam < 46
=>muối khan chứa Mg(NO3)2và NH4NO3
=>nNH4NO3= 0,02 mol
Quá trình cho – nhận e:
\[\begin{array}{*{20}{c}}{}&{\mathop M\limits^0 \,g \to \mathop {Mg}\limits^{ + 2} \,\, + \,2e{\rm{\;\;\;\;\;\;}}\,\,\,{\rm{\;\;}}\mathop N\limits^{ + 5} \,\,\, + {\rm{\;n}}e \to X}\\{}&{\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} \,\,\, + {\rm{\;8}}e \to \mathop {\,N}\limits^{ - 3} \,{H_4}}\end{array}\]
Bảo toàn e: 2.nMg= n.nX+ 8.nNH4NO3=>2.0,28 = 0,04.n + 8.0,02 =>n = 10
=>X là N2
Đáp án cần chọn là: B
Câu 10:
 Xem đáp án
Xem đáp án
Muối thu được là Fe(NO3)30,27 mol
Coi hỗn hợp ban đầu gồm Fe và O
Bảo toàn nguyên tố Fe: nFe(NO3)3= nFe= 0,27 mol
=>mO= 20,88 – 0,27.56 = 5,76 gam =>nO= 0,36 mol
=>nFe: nO= 0,27 : 0,36 = 3 : 4 =>oxit sắt là Fe3O4
Xét quá trình cho – nhận e:
\[\begin{array}{*{20}{c}}{}&{Fe \to \mathop {Fe}\limits^{ + 3} \,\, + \,3e{\rm{\;\;\;\;\;\;}}\,\,\,\,{\rm{\;\;}}\mathop {\,\,N}\limits^{ + 5} \,\,\, + {\rm{\;n}}e \to X}\\{}&{\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop O\limits^0 \,\,\, + {\rm{\;2}}e \to \mathop O\limits^{ - 2} \,}\end{array}\]
Bảo toàn e: 3.nFe= n.nX + 2.nO=>3.0,27 = n.0,03 + 2.0,36 =>n = 3
=>X là NO
Đáp án cần chọn là: B
Câu 11:
 Xem đáp án
Xem đáp án
Xét quá trình cho – nhận e:
\[\begin{array}{*{20}{c}}{}&{Fe{S_2} \to \,\,F{e^{3 + }} + \,\,2\mathop S\limits^{ + 6} \,\,\, + \,\,15e\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} \,\,\, + \,\,1e\,\, \to \,\,\mathop N\limits^{ + 4} \,{O_2}}\\{}&{0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,1,5\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,1,5\,\,\,\, \to \,\,\,\,1,5}\end{array}\]
=>VNO2= 1,5.22,4 = 33,6 lít
Đáp án cần chọn là: C
Câu 12:
Cho 29 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 950 ml dung dịch HNO31,5M, thu được dung dịch chứa m gam muối và 5,6 lít hỗn hợp khí X (đktc) gồm NO và N2O. Tỉ khối của X so với H2là 16,4. Giá trị của m là
 Xem đáp án
Xem đáp án
Gọi nNO= a mol; nN2O= b mol =>nX= a + b = 0,25 mol (1)
\[{\bar M_X} = \frac{{30a + 44b}}{{a + b}} = 16,4.2\](2)
Từ (1) và (2) =>a = 0,2; b = 0,05
Giả sử phản ứng tạo ra NH4NO3x mol
Bảo toàn e: ne cho= ne nhận= 3.nNO+ 8.nN2O+ 8.nNH4NO3= 3.0,2 + 8.0,05 + 8a
=>nNO3 (trong muối)= ne cho= 1 + 8a
Bảo toàn nguyên tố N: nHNO3= nNO+ 2.nN2O+ nNO3 (trong muối)+ 2.nNH4NO3
=>1,425 = 0,2 + 2.0,05 + 1 + 8a + 2a =>a = 0,0125 mol
=>mmuối= mkim loại+ mNO3 (trong muối)+ mNH4NO3= 29 + (1 + 8.0,0125).62 + 0,0125.80 = 98,2 gam
Đáp án cần chọn là: A
Câu 13:
 Xem đáp án
Xem đáp án
nCu= 0,3 mol; nNaNO3= 0,5 mol; nHCl= 1 mol
3Cu + 8H+ +2NO3-→ 3Cu2++ 2NO + 4H2O
Xét \[\frac{{{n_{Cu}}}}{3} = \frac{{0,3}}{3} = 0,1;\,\,\,\,\frac{{{n_{{H^ + }}}}}{8} = \frac{1}{8} = 0,125;\,\,\,\,\frac{{{n_{NO_3^ - }}}}{2} = \frac{{0,5}}{2} = 0,25\]
=>Cu hết, H+và NO3-còn dư
=>nNO= 2/3.nCu= 0,2 mol =>VNO= 4,48 lít
Đáp án cần chọn là: B
Câu 14:
 Xem đáp án
Xem đáp án
- nS= 0,15 mol; nHNO3= 1 mol
S + 6HNO3→ 6NO2+ H2SO4+ 2H2O
0,15 → 0,9 → 0,15
=>dung dịch sau phản ứng gồm H2SO40,15 mol và HNO30,1 mol
=>nH+ = 0,4 mol; nNO3-= 0,1 mol
- Cu + 4H+ +2NO3-→ Cu2++ 2NO2+ 2H2O
0,05 ← 0,2 ← 0,1
=>mCu= 3,2 gam
Đáp án cần chọn là: A
Câu 15:
Thí nghiệm 1:Cho 6,4 gam Cu phản ứng với 120 ml dung dịch HNO31M được a lít NO.
Thí nghiệm 2:Cho 6,4 gam Cu phản ứng với 120 ml dung dịch HNO31M và H2SO40,5M được b lít NO.
Biết NO là sản phẩm khử duy nhất của N+5. Mối liên hệ giữa a và b là
 Xem đáp án
Xem đáp án
3Cu + 8H+ +2NO3-→ 3Cu2++ 2NO + 4H2O
TN1: nCu= 0,1 mol; nHNO3= 0,12 mol
Xét\[\frac{{{n_{Cu}}}}{3} = \frac{{0,1}}{3};\,\,\,\,\frac{{{n_{{H^ + }}}}}{8} = \frac{{0,12}}{8} = 0,015;\,\,\,\,\frac{{{n_{NO_3^ - }}}}{2} = \frac{{0,12}}{2} = 0,06\]
=>H+hết, Cu và NO3-dư =>phản ứng tính theo H+
nNO (1)= 1/4.nH+ = 1/4.0,12 = 0,03 mol
TN2: nCu= 0,1 mol; nH+= 0,24 mol; nNO3-= 0,12 mol
Xét \[\frac{{{n_{Cu}}}}{3} = \frac{{0,1}}{3};\,\,\,\,\frac{{{n_{{H^ + }}}}}{8} = \frac{{0,24}}{8} = 0,03;\,\,\,\,\frac{{{n_{NO_3^ - }}}}{2} = \frac{{0,12}}{2} = 0,06\]
=>H+hết, Cu và NO3-dư =>phản ứng tính theo H+
nNO (2)= 1/4.nH+ = 1/4.0,24 = 0,06 mol
=>nNO (2) = 2.nNO (1) =>b = 2a
Đáp án cần chọn là: B
Câu 16:
 Xem đáp án
Xem đáp án
Al + 0,62 mol HNO3→ Al(NO3)3+ khí X
Nếu muối chỉ có mAl(NO3)3= < 8m → muối có cả NH4
NO3Al(NO3)3+ 4NaOH → NaAlO2+ NaNO3+ 2H2O
NH4NO3+ NaOH → NaNO3+ NH3+ H2O
Ta có nNaOH = 0,646 = \[\frac{m}{{27}}.4 + \frac{{8m - 7,89m}}{{80}} \to {\rm{ }}m{\rm{ }} = 4,32{\rm{ }}g\] → Al: 0,16 mol và NH4NO3: 0,006 mol
Al → Al+3+ 3e N+5+8e → N-3
N+5+ (5-x) e → N+X
Bảo toàn e có 3.nAl= 8nNH4+ (5-x).nN(+x)→ 0,48 = 8.0,006 + (5-x).nN(+x)
Bảo toàn N có nN(+x)+ 2nNH4NO3+ 3nAl= nHNO3→ nN(+x)= 0,62 – 2.0,006 – 3.0,16 = 0,128
→ x = 1,625
A sai vì cả 2 khí N đều có số oxh >1,625
B sai vì tạo khí H2
C đúng
D sai vì cả 2 khí đều có số oxh nhỏ hơn 1,625
Đáp án cần chọn là: C
Câu 17:
 Xem đáp án
Xem đáp án
Xét hỗn hợp khí Y có N2O : x mol và H2: y mol
Có nY= 0,25 = x + y mol
Và mY= MY . nY= 13,6.2.0,25 = 6,8 g = 44x + 2y
Nên x = 0,15 mol và y = 0,1 mol
Xét phản ứng Mg tác dụng với NaNO3và NaHSO4thì
4Mg + 10H++ 2NO3-→ 4Mg+2 + 5H2O + N2O
Mg +2H+→ Mg+2+ H2
Ta có 4nN2O+ nH2= 4.0,15 + 0,1 = 0,7 mol < nMg
= 0,9 nên phản ứng có tạo ra NH4+:4Mg + 10H++ NO3-→ 4Mg+2 + 3H2O + NH4+
nên nNH4+= (0,9 – 0,7 ) : 4 =0,05 mol
Bảo toàn nguyên tố N có nNaNO3= 2nN2O+ nNH4=2.0,15 + 0,05 = 0,35 mol
Bảo toàn nguyên tố H có nNaHSO4= 10nN2O+ 2nH2+ 10nNH4= 10.0,15 + 0,1.2 + 0,05.10 = 2,2 mol
Sau phản ứng dung dịch X thu được có Mg+2: 0,9 mol; NH4+: 0,05 mol; Na+: 2,55 mol và SO42- : 2,2 mol
=>mmuối= mion= 0,9.24 + 0,05.18 + 2,55.23 + 2,2.96 = 292,35
Câu 18:
 Xem đáp án
Xem đáp án
Khi cho dung dịch Z tác dụng với BaCl2dư thì kết tủa thu được là BaSO4
\[ \to {n_{BaS{O_4}}} = \frac{{166,595}}{{233}} = 0,715\,\,mol\]
Bảo toàn gốc \[SO_4^{2 - } \to {n_{{H_2}S{O_4}}} = 0,715\,\,mol\]
Khi cho Z tác dụng với NaOH vừa đủ thu được khí là NH3
\[{n_{N{H_3}}} = \frac{{0,56}}{{22,4}} = 0,025\,\,mol \to {n_{NH_4^ + }} = 0,025\,\,mol\]
Bảo toàn điện tích cho dung dịch Z:
\[2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} + {n_{N{a^ + }}} = 2{n_{SO_4^{2 - }}}\]
Mà \[{n_{NaOH}} = 2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} = 1,285\,\,mol\]
\[ \to 1,285 + {n_{N{a^ + }}} = 2.0,715 \to {n_{N{a^ + }}} = 0,145mol\]
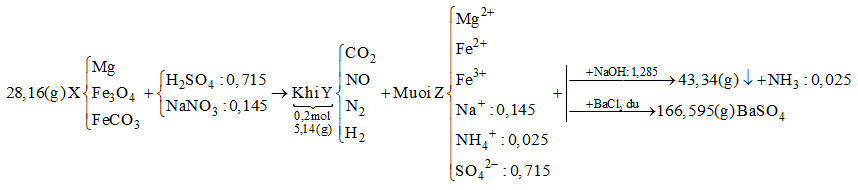
Ta có:
\[{n_{O{H^ - }{\kern 1pt} {\kern 1pt} (trong{\kern 1pt} {\kern 1pt} hidroxit)}} + {n_{NH_4^ + }} = {n_{NaOH}} \to {n_{O{H^ - }{\kern 1pt} {\kern 1pt} (trong{\kern 1pt} {\kern 1pt} hidroxit)}} = 1,285 - 0,025 = 1,26\,\,mol\]
Bảo toàn khối lượng:
\[{m_{Fe}} + {m_{Mg}} + {m_{O{H^ - }{\kern 1pt} {\kern 1pt} (trong{\kern 1pt} {\kern 1pt} hidroxit)}} = 43,34 \to {m_{Fe}} + {m_{Mg}} + 1,26.17 = 43,34\]
\[ \to {m_{Fe}} + {m_{Mg}} = 21,92g\]
Bảo toàn khối lượng cho dung dịch Z:
\[{m_{Mg}} + {m_{Fe}} + {m_{Na}} + {m_{NH_4^ + }} + {m_{SO_4^{2 - }}} = 21,92 + 0,145.23 + 0,025.18 + 0,715.96 = 94,345g\]
Bảo toàn khối lượng cho phản ứng:
\[{m_X} + {m_{{H_2}S{O_4}}} + {m_{NaN{O_3}}} = {m_Z} + {m_Y} + {m_{{H_2}O}}\]
\[ \to 28,16 + 0,715.98 + 0,145.85 = 94,345 + 5,14 + {m_{{H_2}O}}\]
\[ \to {m_{{H_2}O}} = 14,07g \to {n_{{H_2}O}} = 0,615\,\,mol\]
Bảo toàn nguyên tố H :\[2{n_{{H_2}S{O_4}}} = 2{n_{{H_2}}} + 4{n_{NH_4^ + }} + 2{n_{{H_2}O}}\]
\[ \to 2.0,715 = 2{n_{{H_2}}} + 4.0,025 + 2.0,615 \to {n_{{H_2}}} = 0,05\,\,mol\]
Đặt số mol của CO2, NO và N2lần lượt là x, y, z
\[ \to x + y + z + 0,05 = 0,2 \to x + y + z = 0,15\](*)
Tổng khối lượng Y là 5,14 \[ \to 44x + 30y + 28z + 0,05.2 = 5,14\]
\[ \to 44x + 30y + 28z = 5,04\](**)
Bảo toàn nguyên tố N :
\[{n_{NaN{O_3}}} = {n_{NO}} + 2{n_{{N_2}}} + {n_{NH_4^ + }} \to 0,145 = y + 2z + 0,025\]
\[ \to y + 2z = 0,12\](***)
Từ (*), (**) và (***) → x = 0,04; y = 0,01; z = 0,04
\[ \to {n_{FeC{O_3}}} = 0,04\,\,mol\]
Gọi số mol của Mg và Fe3O4lần lượt là a và b
\[ \to 24a + 232b + 116.0,04 = 28,16 \to 24a + 232b = 23,52\](1)
Vì tổng khối lượng của Mg và Fe trong hỗn hợp X là 21,92g
\[ \to 24a + 56.(3b + 0,04) = 21,92 \to 24a + 168b = 19,68\](2)
Từ (1) và (2) → a = 0,4; b = 0,06
\[ \to {\rm{\% }}{m_{Mg}} = \frac{{0.4.24}}{{28,16}}.100{\rm{\% }} = 34,09{\rm{\% }}\]
Đáp án cần chọn là: A
Câu 19:
 Xem đáp án
Xem đáp án
PT ion rút gọn: 3Cu + 8H++ 2NO3- → 3Cu2+ + 2NO↑ + 4H2O
ban đầu: 0,24 0,6 (mol)
pư: 0,09←0,24 →0,06 (mol)
sau: 0,09 0,54 (mol)
PT ion rút gọn: Cu + 2Fe3+→ Cu2++ 2Fe2+
0,1 ← 0,2 (mol)
\[ = >{\rm{ }}\sum {\rm{ }}{n_{Cu}}\; = {\rm{ }}0,09{\rm{ }} + {\rm{ }}0,1{\rm{ }} = {\rm{ }}0,19{\rm{ }}\left( {mol} \right)\]
=>mCu= 0,19.64 = 12,16 (g)
Đáp án cần chọn là: C
Câu 20:
 Xem đáp án
Xem đáp án
X + HNO3→ Muối + NO + H2O
BTKL: mH2O= mX+ mHNO3- m muối - mNO= 18,6 + 0,98.63 - 68,88 - 0,1.30 = 8,46 gam
=>nH2O= 0,47 mol
BTNT "H": nHNO3= 4nNH4++ 2nH2O =>0,98 = 4nNH4+ + 2.0,47 =>nNH4+ = 0,01 mol
BTNT "N": nHNO3= nNO3- + nNH4+ + nNO=>0,98 = nNO3- + 0,01 + 0,1 =>nNO3- = 0,87 mol
BTNT "O": nO(X) + 3nHNO3= 3nNO3- + nNO+ nH2O
=>nO(X) + 3.0,98 = 3.0,87 + 0,1 + 0,47 =>nO(X) = 0,24 mol
=>m = mKL= mX- mO(X) = 18,6 - 0,24.16 = 14,76 gam
Đáp án cần chọn là: A
Câu 21:
 Xem đáp án
Xem đáp án
Đặt số mol Al và Fe trong X là x mol thì mX= 27x + 56x = 2,49
→ x = 0,03 mol
+) X + 0,17 mol HCl
2 Al + 6HCl → 2AlCl3+ 3H2
Fe + 2HCl → FeCl2+ H2
→ Dd Y thu được có AlCl3: 0,03 mol; FeCl2: 0,03 mol; HCl: 0,02 mol
+) Y + 0,2 mol AgNO3thì :
3Fe2++ 4H++ NO3-→ 3Fe3++ 2H2O + NO
0,015 mol ← 0,02 mol
Ag++ Cl-→ AgCl
0,17 0,17 0,17 (mol)
\[{n_{F{e^{2 + }}}}\]còn lại = 0,015
nAg+ còn lại = 0,03n
Fe2++ Ag+→ Fe3+ + Ag
0,015 0,03
=>\[{n_{F{e^{2 + }}}}\]phản ứng hết trước
=>\[{n_{F{e^{2 + }}}} = {n_{Ag}} = 0,015mol\]
→ mrắn= mAgCl+ mAg= 0,17.143,5 + 0,015.108 = 24,395 + 1,62= 26,015 g
→ gần nhất với 26,0 g
Đáp án cần chọn là: D
Câu 22:
Cho m gam hỗn hợp G gồm Mg và Al có tỉ lệ mol 4 : 5 vào dung dịch HNO320%. Sau khi các kim loại tan hết có 6,72 lít hỗn hợp X gồm NO, N2O, N2bay ra (đktc) và được dung dịch T. Thêm một lượng O2vừa đủ vào X, sau phản ứng được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch KOH dư, có 4,48 lít hỗn hợp khí Z đi ra (đktc). Tỉ khối của Z đối với H2bằng 20. Nếu cho dung dịch NaOH vào dung dịch T thì lượng kết tủa lớn nhất thu được là (m + 39,1) gam. Biết HNO3dùng dư 20% so với lượng cần thiết. Nồng độ phần trăm của Al(NO3)3trong T gần nhất với
 Xem đáp án
Xem đáp án
Khi thêm O2vừa đủ vào Y thu được các khí NO2, N2O, N2. Dẫn qua dung dịch KOH dư thì NO2bị hấp thụ khí còn lại là N2O và N2.
=>nNO= nNO2= 0,3 – 0,2 = 0,1 mol
Áp dụng đường chéo cho hỗn hợp Z:
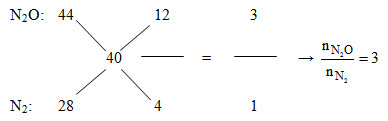
Mà nN2O+ nN2= nZ= 0,2 mol =>nN2O= 0,15 và nN2= 0,05
Đặt: nMg= 4x và nAl = 5x (mol) =>nMg(OH)2= 4x và mAl(OH)3= 5x
m kết tủa max = mKL+ mOH-=>m + 39,1 = m + 17(4x.2 + 5x.3) =>x = 0,1
=>nMg= 0,4 mol và nAl = 0,5 mol
Ta thấy: 2nMg + 3nAl >3nNO+ 8nN2O+ 10nN2=>Có tạo muối NH4NO3
Bảo toàn e: 2nMg + 3nAl = 3nNO + 8nN2O+ 10nN2+ 8nNH4NO3
=>2.0,4 + 3.0,5 = 3.0,1 + 8.0,15 + 10.0,05 + 8nNH4NO3
=>nNH4NO3= 0,0375 mol
Công thức tính nhanh: nHNO3 pư= 4nNO+ 10nN2O + 12nN2 + 10nNH4NO3= 2,875 mol
=>nHNO3 bđ= 2,875 + 2,875.(20/100) = 3,45 mol
=>m dd HNO3 = 3,45.63.(100/20) = 1086,75 gam
m dd sau pư = mMg+ mAl + m dd HNO3 – mNO– mN2O– mN2
= 0,4.24 + 0,5.27 + 1086,75 – 0,1.30 – 0,15.44 – 0,05.28 = 1098,85 gam
Ta có: nAl(NO3)3= nAl= 0,5 mol
→ %mAl= (0,5.213/1098,85).100% = 9,69% gần nhất với 9,7%
Đáp án cần chọn là: D
Câu 23:
 Xem đáp án
Xem đáp án
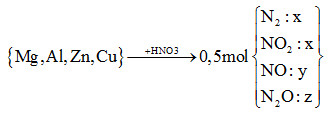
nHNO3 = 12nN2 + 2nNO2 + 4nNO+ 10nN2O
= 12x + 2x + 4y + 10z = 14x + 4y +10z (*)
*nZ = 2x + y + z = 0,5 mol (1)
*mZ= nZ.MZ=>28x + 44x + 30y + 44z = 0,5.8,9.4
=>74x + 30y + 44z = 17,8 (2)
\[\mathop \to \limits^{\frac{3}{7}(2) - \frac{{62}}{7}(1)} 14x + 4y + 10z = 3,2\]
(*) và (**) =>nHNO3= 3,2 mol
Đáp án cần chọn là: C
Câu 24:
 Xem đáp án
Xem đáp án
Do Fe dư nên tạo thành muối Fe2+
nFe= (20 – 3,2)/56 = 0,3 mol
BTe ta có: 2nFe= 3nNO=>nNO= 2.0,3/3 = 0,2 mol
=>V = 4,48 lít
Đáp án cần chọn là: C
Câu 25:
 Xem đáp án
Xem đáp án
Chỉ có Cu phản ứng với HNO3sinh ra khí.
Sử dụng định luật bảo toàn e ta có: 2nCu= nNO2=>nNO2= 2.0,1 = 0,2 mol
=>V = 4,48 lít
Đáp án cần chọn là: C
