Trắc nghiệm chuyên đề Hóa 12 Chủ đề 6: Tính lưỡng tính của nhôm có đáp án
-
1330 lượt thi
-
13 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Rót 100 ml dung dịch NaOH 3,5M vào 100 ml dung dịch AlCl3 1M thu được m gam kết tủa. Tính m?
 Xem đáp án
Xem đáp án
Ta có: nNaOH = 0,35 mol, nAlCl3 = 0,1 mol
Vận dụng tỉ lệ T
nOH- = 0,35 mol, nAl3+ = 0,1 mol

→ m↓ = 0,05 . 78 = 3,9 g
hoặc T = 3,5 nên
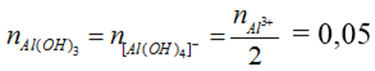
Câu 2:
Cho 450 ml dung dịch KOH 2M tác dụng với 100 ml dung dịch Al2(SO4)3 1M được dung dịch X. Tính nồng độ mol/l các chất trong dung dịch X?
 Xem đáp án
Xem đáp án
nOH- = 0,9 mol, nAl3+ = 0,2 mol
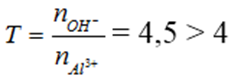
→ Tạo [Al(OH)4]- và OH- dư
Dung dịch X có
Câu 3:
Cho 0,5 lít dung dịch NaOH tác dụng với 300ml dung dịch Al2(SO4)3 0,2M thu được 1,56g kết tủa. Tính nồng độ mol/lít của dung dịch NaOH. Biết các phản ứng xảy ra hoàn toàn.
 Xem đáp án
Xem đáp án
Số mol Al3+ = 0,12 mol.
Số mol Al(OH)2 = 0,02 mol < số mol Al3+ nên có 2 trường hợp xảy ra.
+ TH1: Al3+ dư → Chỉ tạo Al(OH)3 nên số mol OH- = 3 . 0,02 = 0,06 mol.
→ CM(NaOH) = 0,12M
+ TH2: Al3+ hết → tạo
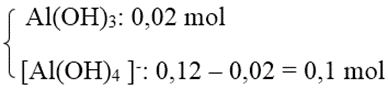
→ Số mol OH- = 3 . 0,02 + 4 . 0,1 = 0,46 mol
→ CM(NaOH) = 0,92M
Câu 4:
Thêm 0,6 mol NaOH vào dd chứa x mol AlCl3 thu được 0,2 mol Al(OH)3. Thêm tiếp 0,9 mol NaOH thấy số mol của Al(OH)3 là 0,5. Thêm tiếp 1,2 mol NaOH nữa thấy số mol Al(OH)3 vẫn là 0,5 mol. Tính x?
 Xem đáp án
Xem đáp án
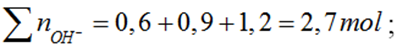
nAl(OH)3 = 0,5
Số mol OH- trong kết tủa là 1,5 mol < 2,7 mol → có tạo [Al(OH)4]-
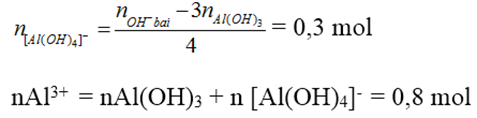
Câu 5:
TN1: Cho a mol Al2(SO4)3 tác dụng với 500ml dung dịch NaOH 1,2M được m gam kết tủa.
TN2: Cũng a mol Al2(SO4)3 tác dụng với 750ml dung dịch NaOH 1,2M thu được m gam kết tủa. Tính a và m?
 Xem đáp án
Xem đáp án
Vì lượng OH- ở 2 thí nghiệm khác nhau mà lượng kết tủa không thay đổi nên:
TN1: Al3+ dư, OH- hết.
Số mol OH- = 0,6 mol → nAl(OH)3 = nOH-/3 = 0,2 mol → m = 15,6 g
TN2: Al3+ và OH- đều hết và có hiện tượng hoà tan kết tủa.
Số mol OH- = 0,9 mol → Tạo
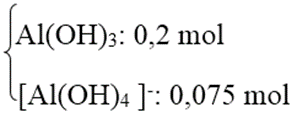
Số mol Al2(SO4)3 = 0,1375 mol = a.
Câu 6:
Cho V lít dung dịch NaOH 0,4M tác dụng với 58,14g Al2(SO4)3 thu được 23,4g kết tủa. Tìm giá trị lớn nhất của V?
 Xem đáp án
Xem đáp án
Đáp án: A
Số mol Al3+ = 0,34 mol.
Số mol Al(OH)3 = 0,3 mol < số mol Al3+ nên có 2 trường hợp xảy ra.
+ TH1: Al3+ dư → Chỉ tạo Al(OH)3 nên số mol OH- = 3 . 0,3 = 0,9 mol.
→ V(dd NaOH) = 2,25 lít = Vmin
+ TH2: Al3+ hết → tạo
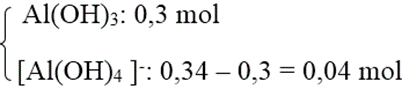
→ Số mol OH- = 3 . 0,3 + 4 . 0,04 = 1,06 mol
→ V(dd NaOH) = 2,65 lít = Vmax.
Câu 7:
Cho 150 cm3 dung dịch NaOH 7M tác dụng với 100cm3 dung dịch Al2(SO4)3 1M. Hãy xác định nồng độ mol của NaOH trong dung dịch sau phản ứng.
 Xem đáp án
Xem đáp án
Đáp án: C
Ta có: nNaOH = 7.0,15 = 1,05 mol; nAl2(SO4)3 = 1.0,1 = 0,1 mol
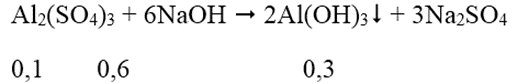
Al(OH)3 + NaOH → Na[Al(OH)4]
Sau phản ứng có 0,2 mol Na[Al(OH)4] và 0,25 mol NaOH dư.
Nồng độ mol của Na[Al(OH)4] = 0,2/(0,15 + 0,1) = 0,8M
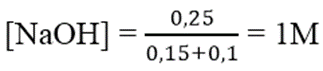
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án: C
Ta có: nOH- = nNaOH = 0,7 mol
nAl3+ = 2.0,1 = 0,2 mol
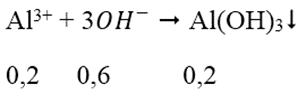
→ nOH- dư = 0,7 - 0,6 = 0,1 mol
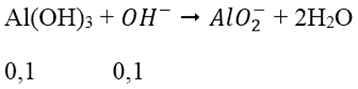
→ nAl(OH)3 còn = 0,2 - 0,1 = 0,1 mol
Câu 9:
Cho 100ml dung dịch AlCl3 1M tác dụng với 200ml dung dịch NaOH. Kết tủa tạo thành được làm khô và nung đến khối lượng không đổi cân nặng 2,55g. Tính nồng độ dung dịch NaOH ban đầu.
 Xem đáp án
Xem đáp án
Đáp án: B
Số mol AlCl3 là nAlCl3 = 0,1.1 = 0,1 (mol)
Số mol Al2O3 là nAl2O3 = 2,55/102 = 0,025 (mol)
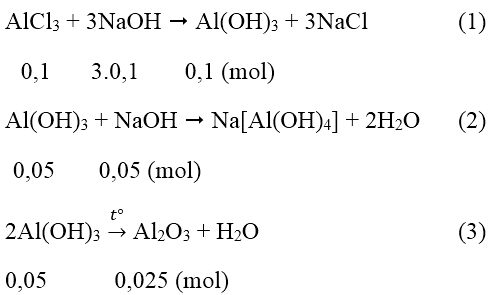
Theo pt (3) ta thấy số mol Al(OH)3 còn lại là 0,05 mol
Như vậy đã có: 0,1 - 0,05 = 0,05 mol Al(OH)3 đã bị hòa tan.
Từ (1) và (2) số mol NaOH = 3.0,1 + 0,05 = 0,35 (mol)
Nồng độ mol/l CM(NaOH) = 0,35/0,2 = 1,75M
Câu 10:
Cho V lít dung dịch Ba(OH)2 0,5M vào 200 ml dung dịch Al(NO3)3 0,75M thu được 7,8 g kết tủa. Vậy V có giá trị là:
 Xem đáp án
Xem đáp án
Đáp án: D
nBa(OH)2 = 0,5V → nOH- = 1V (mol)
nAl3+ = nAl(NO3)3 = 0,75.0,2 = 0,15 (mol)
nAl(OH)3 = 7,8/78 = 0,1 mol
Trường hợp 1: lượng OH- chỉ đủ tạo 0,1 mol kết tủa:
nOH- = 3.nAl(OH)3 = 0,3 mol
V = 0,3 (l)
Trường hợp 2: lượng OH- dư, hòa tan một phần kết tủa
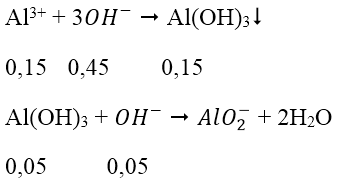
* Cách khác áp dụng nhanh công thức cho 2 trường hợp:
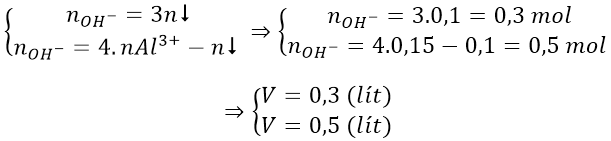
Câu 11:
Hòa tan hết 0,81 gam bột nhôm vào 550ml dung dịch HCl 0,2M thu được dung dịch A. Tính thể tích dung dịch NaOH 0,5M cần thêm vào dung dịch A để thu được lượng kết tủa lớn nhất.
 Xem đáp án
Xem đáp án
Đáp án: A
Số mol Al = 0,81/27 = 0,03 (mol); số mol HCl = 0,55.0,2 = 0,11 (mol)
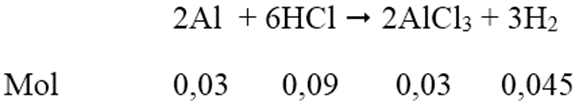
Dung dịch A thu được gồm AlCl3 = 0,03 mol; HCl = 0,11 - 0,09 = 0,02 mol.
Để có lượng kết tủa lớn nhất:
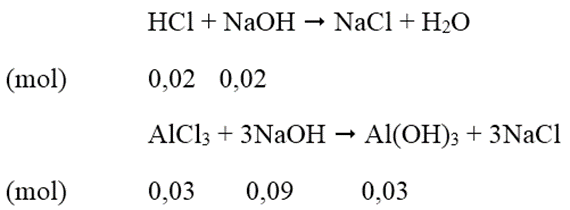
Thể tích dung dịch NaOH cần dùng = (0,02+0,09)/0,5 = 0,22 (lít)
Câu 12:
Cho 200ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M; lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là:
 Xem đáp án
Xem đáp án
Đáp án: D
Ta có: nAlCl3 = 1,5.0,2 = 0,3 mol; nAl(OH)3 = 15,6/78 = 0,2 mol
Thể tích NaOH lớn nhất khi kết tủa sinh ra cực đại, bị NaOH hòa tan 1 phần còn 15,6 (g).
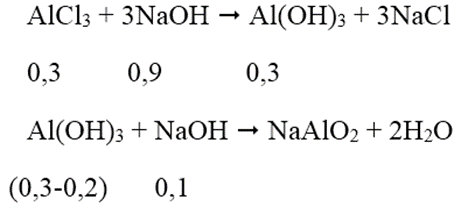
Theo phương trình phản ứng, ta có: nNaOH = 0,9 + 0,1 = 1 mol
→ VNaOH = 1/0,5 = 2 lít
Câu 13:
Cho hỗn hợp gồm Na và Al có tỉ lệ mol tương ứng là 1 : 2 vào nước dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án: B
Ta có: nH2 = 0,896/22,4 = 0,04 mol
Gọi: nAl = x mol → nAl = 2x mol
Phản ứng:
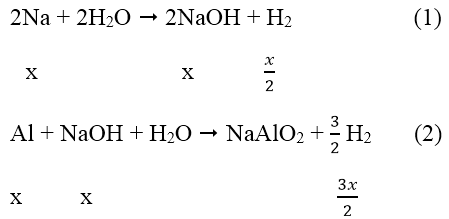
Sau các phản ứng còn m(g) chất rắn không tan, đó là khối lượng của Al dư.
Theo phản ứng (1), (2)
→ mAl ban đầu = 2x = 0,2.2 = 0,4 mol
Mà: nAl phản ứng = nNaOH = x = 0,2 mol → nAl dư = 0,4 - 0,2 = 0,2 mol
→ mAl = 0,2.27 = 5,4 (g)
