Trắc nghiệm chuyên đề Hóa 12 Chủ đề 1:Tính chất chung của kim loại có đáp án
Trắc nghiệm chuyên đề Hóa 12 Chủ đề 1:Tính chất chung của kim loại có đáp án
-
1416 lượt thi
-
27 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Ion M2+, X- đều có cấu hình electron ở lớp ngoài cùng là 3s23p6. Hãy cho biết phân tử được tạo bởi M2+ và X-?
 Xem đáp án
Xem đáp án
+ M → M2+ + 2e ⇒ M có cấu hình electron là:
1s22s22p63s23p64s2 (ZM = 20 ⇒ Ca)
+ X + 1e → X- ⇒ X có cấu hình electron là:
1s22s22p63s23p5 (ZX = 17) ⇒ X là Cl ⇒ phân tử CaCl2.
Câu 2:
Nguyên tố Cu có số hiệu nguyên tử là 29, lớp electron ngoài cùng có 1e. hãy cho biết:
Cấu hình electron của nguyên tử Cu và của các ion Cu+, Cu2+.
 Xem đáp án
Xem đáp án
Cấu hình electron của nguyên tử Cu và của các ion Cu+, Cu2+
Cu: 1s22s22p63s23p63d104s1
Cu+: 1s22s22p63s23p63d10
Cu2+: 1s22s22p63s23p63d9
Câu 3:
Nguyên tố Cu có số hiệu nguyên tử là 29, lớp electron ngoài cùng có 1e. hãy cho biết:
Vị trí của Cu trong bảng tuần hoàn.
 Xem đáp án
Xem đáp án
Vị trí Cu: nằm ở ô số 29, chu kì 4 nhóm IB.
Câu 4:
Ion R+ có cấu hình electron là 1s22s22p6. Hãy xác định vị trí của nguyên tố R trong bảng hệ thống tuần hoàn.
 Xem đáp án
Xem đáp án
Từ R → R+ + 1e ⇒ R có cấu hình electron là: 1s22s22p63s1
Có 3 lớp electron nên thuộc chu kì 3, có electron cuối cùng thuộc phân lóp s nên thuộc nhóm A và có 1 electron hóa trị nên thuộc nhóm I.
Câu 5:
Hãy sắp xếp các cặp oxi hóa khử sau đây theo thứ tự tăng dần tính oxi hóa của các ion kim loại:
(1): Fe2+/Fe (2): Pb2+/Pb (3): 2H+/H2 (4): Ag+/Ag
(5): Na+/Na (6): Fe3+/Fe2+ (7): Cu2+/Cu
 Xem đáp án
Xem đáp án
Đáp án D
Câu 6:
Cation X2+ có cấu hình electron phân lớp ngoài cùng là 3p6. Hãy xác định vị trí của nguyên tố X trong bảng hệ thống tuần hoàn.
 Xem đáp án
Xem đáp án
Đáp án: A
Từ X → X2+ + 2e ⇒ R có cấu hình electron là: 1s22s22p63s23p64s2: có 4 lớp electron nên thuộc chu kì 4; có electron cuối cùng thuộc phân lớp s nên thuộc nhóm A và có 2 electron hóa trị nên thuộc nhóm II.
Câu 7:
Có thể dùng axit nào sau đây để hòa tan hoàn toàn hỗn hợp gồm: Al, Fe, Pb, Ag?
 Xem đáp án
Xem đáp án
Đáp án: B
Câu 9:
Cho 2 phương trình ion rút gọn
M2+ + X → M + X2+
M + 2X3+ → M2+ + 2X2+
Nhận xét nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án: D
Câu 10:
Có thể dùng dung dịch muối nào sau đây để hòa tan hoàn toàn hỗn hợp gồm: Al, Fe, Pb, Cu?
 Xem đáp án
Xem đáp án
Đáp án: C
Câu 13:
Có dung dịch FeSO4 lẫn CuSO4. Phương pháp đơn giản nhất để loại tạp chất là:
 Xem đáp án
Xem đáp án
Đáp án: B
Câu 20:
Cho các kim loại sau: Li, Mg, Al, Zn, Fe, Ni. Có bao nhiêu kim loại tác dụng với HCl và Cl2 thu được cùng một muối ?
 Xem đáp án
Xem đáp án
Đáp án: D
Câu 21:
Một học sinh tiến hành thí nghiệm: Nhúng một thanh đồng vào dung dịch AgNO3, sau một lúc nhúng tiếp một thanh sắt vào dung dịch này đến phản ứng hoàn toàn. Sau khi thí nghiệm kết thúc, học sinh đó rút ra các kết luận sau :
(I) Dung dịch thu được sau phản ứng có màu xanh nhạt.
(II) Khối lượng thanh đồng bị giảm sau phản ứng.
(III) Khối lượng thanh sắt tăng lên sau phản ứng.
Kết luận không đúng là
 Xem đáp án
Xem đáp án
Đáp án: A
Câu 22:
Hoà tan hoàn toàn a gam hỗn hờp gồm FeO và Fe2O3 (tỉ lệ mol 1:1) vào dung dịch HCl. Thêm tiếp b gam Cu vào dung dịch thu được ở trên thấy Cu tan hoàn toàn. Mối quan hệ giữa a và b là
 Xem đáp án
Xem đáp án
Đáp án: A
phản ứng hoà tan hoàn toàn FeO và Fe2O3 ( tỉ lệ mol 1:1) vào dung dịch HCl
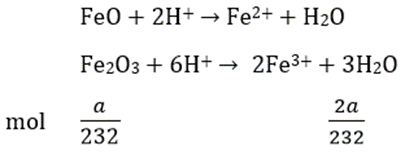
Hoà tan Cu vào dung dịch trên:
Cu + 2Fe3+ → Cu2+ + 2Fe2+
Khi Cu tan hoàn toàn tức là
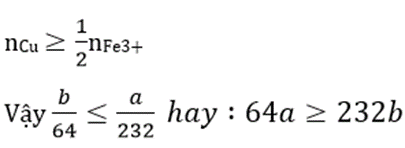
Câu 23:
Có các phản ứng như sau:
1. Fe + 2H+ → Fe2+ + H2
2. Fe + Cl2 → FeCl2
3. AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag
4. Ca + FeCl2 dung dịch → CaCl2 + Fe
5. Zn + 2FeCl3 → ZnCl2 + 2FeCl2
6. 3Fe dư + 8HNO3 loãng →3Fe(NO3)2 + 2NO + 4H2O
Trong các phản ứng trên, số phản ứng viết không đúng là
 Xem đáp án
Xem đáp án
Đáp án: B
phản ứng 2,4 không đúng
Câu 24:
Cho các phát biểu sau:
1. Có thể dùng lưu huỳnh để khử độc thủy ngân.
2. Có thể dùng thùng bằng kẽm để vận chuyển HNO3 dặc, nguội.
3. Ngay cả ở nhiệt độ cao, magie không tác dụng với nước.
4. Bạc để lâu trong không khí có thể bị hoá đen do chuyển thành Ag2S.
Trong các phát biểu trên, số phát biếu đứng là
 Xem đáp án
Xem đáp án
Đáp án: B
phát biểu 1,4 đúng
Câu 25:
Cho sơ đồ phản ứng của kim loại M với HNO3 như sau:
M + HNO3 → M(NO3)n + NxOy + H2O
Sau khí cân bằng PTHH, hệ số tối giản của HNO3 là
 Xem đáp án
Xem đáp án
Đáp án: D
