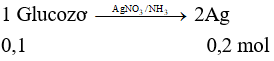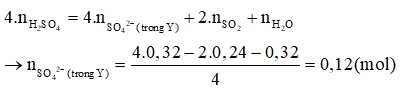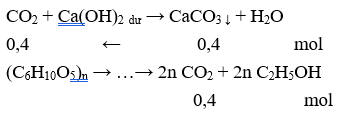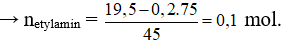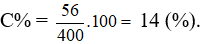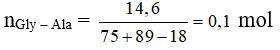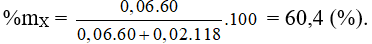Đề thi Hóa học 12 Học kì 1 chọn lọc, có đáp án - Đề 2
-
2141 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Kim loại nào sau đây tác dụng được với nước ở nhiệt độ thường?
 Xem đáp án
Xem đáp án
Đáp án C
Na là kim loại kiềm nên tác dụng được với nước ở ngay nhiệt độ thường.
2Na + 2 → 2NaOH + ↑
Câu 2:
Kim loại có nhiệt độ nóng chảy cao nhất là
 Xem đáp án
Xem đáp án
Đáp án C
W có nhiệt độ nóng chảy cao nhất ().
Câu 3:
Chất nào sau đây thuộc loại chất béo?
 Xem đáp án
Xem đáp án
Đáp án B
Chất béo là Trieste của glixerol với axit béo.
Câu 4:
Polietilen (PE) được sử dụng làm chất dẻo. PE được tạo ra bằng phản ứng trùng hợp chất nào sau đây
 Xem đáp án
Xem đáp án
Đáp án D
PE được tạo ra bằng phản ứng trùng hợp etilen ().
Câu 7:
Phương trình hóa học nào sau đây sai?
 Xem đáp án
Xem đáp án
Đáp án A
Tính khử của Cu < Fe, do đó phản ứng A không xảy ra.
Câu 8:
Hợp chất nào dưới đây thuộc loại amino axit ?
 Xem đáp án
Xem đáp án
Đáp án C
Amino axit là hợp chất hữu cơ tạp chức, phân tử chứa đồng thời nhóm amino () và nhóm cacboxyl (COOH).
→ là amino axit.
Câu 9:
Trong các ion sau đây, ion nào có tính oxi hóa mạnh nhất?
 Xem đáp án
Xem đáp án
Đáp án C
Ta có tính oxi hóa: .
Câu 10:
Kim loại nào sau đây không tan trong dung dịch HCl?
 Xem đáp án
Xem đáp án
Đáp án B
Cu đứng sau H trong dãy hoạt động hóa học nên không tác dụng được với HCl.
Câu 11:
Glucozơ thuộc loại monosaccarit, nó được dùng làm thuốc tăng lực cho người già, trẻ em và người ốm. Glucozơ có công thức là
 Xem đáp án
Xem đáp án
Đáp án D
Glucozơ:
Câu 12:
Cho các kim loại sau: Na, K, Fe, Mg. Kim loại có tính khử mạnh nhất là?
 Xem đáp án
Xem đáp án
Đáp án C
Thứ tự dãy hoạt động hóa học của kim loại: K, Na, Mg, Al ….
Câu 14:
Cho m gam Fe tác dụng hoàn toàn với lượng dư dung dịch HCl thu được 2,24 lít khí (đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Bảo toàn electron có:
2. → = 0,1 mol.
= 0,1.56 = 5,6 gam.
Câu 15:
Thủy phân este nào sau đây (trong dung dịch NaOH vừa đủ) thu được natri axetat và ancol?
 Xem đáp án
Xem đáp án
Đáp án D
Câu 16:
Polime nào sau đây thuộc loại polime thiên nhiên?
 Xem đáp án
Xem đáp án
Đáp án D
Tinh bột là polime thiên nhiên.
Câu 17:
Cho y gam kim loại M vào dung dịch dư, sau phản ứng hoàn toàn khối lượng phần dung dịch tăng thêm y gam. Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án B
Do thêm kim loại M vào dung dịch , khối lượng dung dịch tăng đúng bằng khối lượng kim loại phản ứng nên sau phản ứng không thu được kết tủa cũng không có khí thoát ra.
Vậy M là Cu.
Câu 18:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án A
PVC được điều chế bằng phản ứng trùng hợp vinyl clorua.
B sai vì tơ visco thuộc loại tơ bán tổng hợp.
C sai vì amilozơ có cấu trúc mạch không phân nhánh.
Câu 19:
Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may làm vỡ nhiệt kế thủy ngân thì dùng chất nào sau đây để khử độc thủy ngân?
 Xem đáp án
Xem đáp án
Đáp án A
Thủy ngân phản ứng với lưu huỳnh ở ngay nhiệt độ thường.
Hg + S → HgS.
Câu 20:
Cho phản ứng: aAl + bHN → cAl + dNO + eO. Các hệ số a, b, c, d, e là những số nguyên, tối giản. Tổng (a + b) bằng
 Xem đáp án
Xem đáp án
Đáp án A
Al + 4HN → Al + NO + 2O
→ a + b = 1 + 4 = 5.
Câu 22:
Dung dịch chất nào sau đây làm quỳ tím chuyển sang màu xanh?
 Xem đáp án
Xem đáp án
Đáp án C
Etylamin: có tính bazơ nên làm quỳ tím chuyển sang màu xanh.
Câu 23:
Thực hiện phản ứng tráng bạc hoàn toàn dung dịch chứa 18,0 gam glucozơ, thu được tối đa m gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
→ m = 0,2.108 = 21,6 gam.
Câu 24:
Thí nghiệm nào sau đây thu được muối sắt (III) sau khi phản ứng kết thúc?
 Xem đáp án
Xem đáp án
Đáp án B
Vậy cho Fe vào HN loãng, dư thu được muối sắt (III).
Câu 25:
Xà phòng hóa hoàn toàn 0,1 mol chất béo X thu được glixerol và hỗn hợp muối gồm 30,6 gam COONa và 60,8 gam COONa. Cho 17,72 gam X tác dụng với lượng dư dung dịch nước brom, số mol brom tối đa phản ứng là
 Xem đáp án
Xem đáp án
Đáp án D
Ta có: COONa: 0,1 mol; COONa: 0,2 mol
Vậy X là:
+ 2 →
Xét 17,72 gam X → = 0,02 mol → = 2. = 0,04 (mol).
Câu 26:
Có 2 kim loại X, Y thỏa mãn các tính chất sau:
Kim loại X, Y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
Mg vừa tác dụng với HCl, vừa tác dụng với HN đặc, nguội.
Cu không tác dụng với HCl nhưng tác dụng với HN đặc, nguội.
Câu 27:
Hòa tan hoàn toàn m gam hỗn hợp X gồm Al, Cu và FeS vào dung dịch chứa 0,32 mol (đặc), đun nóng, thu được dung dịch Y (chất tan chỉ gồm các muối trung hòa) và 0,24 mol S (là chất khí duy nhất). Cho 0,25 mol NaOH phản ứng hết với dung dịch Y, thu được 7,63 gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Bảo toàn H có = 0,32 mol.
Bảo toàn O có:
Cho NaOH phản ứng hết với Y, sau phản ứng dung dịch thu được chứa: : 0,25 mol; : 0,12 mol; Al x mol.
Bảo toàn điện tích → x = 0,25 – 2.0,12 = 0,01 (mol)
– 4.nAl = 0,25 – 4.0,01 = 0,21 (mol)
= 7,63 – 0,21.17 = 4,06 gam.
Bảo toàn S có:
=
→ = 0,24 + 0,12 – 0,32 = 0,04 mol
→ m = + + = 4,06 + 0,04.32 + 0,01.27 = 5,61 gam.
Câu 28:
Lên men m gam tinh bột để sản xuất ancol etylic (hiệu suất cả quá trình là 80%). Toàn bộ lượng sinh ra hấp thụ hoàn toàn vào dung dịch nước vôi trong dư thu được 40,0 gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Giả sử H = 100% → = 0,2/n (mol) → = m = 0,2/n .162n = 32,4 gam.
Do H = 80% nên m = 32,4/80% = 40,5 gam.
Câu 29:
Thủy phân hoàn toàn m gam este đơn chức X trong dung dịch NaOH vừa đủ. Sau phản ứng thu được 8,2 gam muối và 4,6 gam ancol etylic. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Este X có dạng: RCOO
RCOO+ NaOH (0,1) → RCOONa + OH (0,1 mol)
Bảo toàn khối lượng có:
= = 8,2 + 4,6 – 0,1.40 = 8,8 gam.
Câu 30:
Cho các phát biểu sau:
(a) Trong công nghiệp, saccarozơ được chuyển hóa thành glucozơ dùng để tráng gương, tráng ruột phích.
(b) Phân tử Val-Ala có 8 nguyên tử cacbon.
(c) Saccarozơ tham gia phản ứng thủy phân trong môi trường kiềm.
(d) Dung dịch anbumin phản ứng với trong môi trường kiềm.
(e) Xenlulozơ là thành phần chính tạo nên lớp màng tế bào thực vật, là bộ khung của cây cối.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án B
(a) (b) (d) (e) đúng
(c) sai vì Saccarozơ tham gia phản ứng thủy phân trong môi trường axit hoặc xúc tác enzim
Câu 31:
Cho kim loại Fe lần lượt phản ứng với các dung dịch: NaCl. Số trường hợp có phản ứng hóa học xảy ra là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 32:
Cho 19,5 gam hỗn hợp X gồm glyxin và etylamin tác dụng vừa đủ với 200 ml dung dịch NaOH 1,0M. Mặt khác, nếu cho 19,5 gam X tác dụng vừa đủ với V ml dung dịch HCl 1,0M, thu được m gam muối. Giá trị của V và m lần lượt là
 Xem đáp án
Xem đáp án
Đáp án D
Gọi số mol của glyxin và etylamin lần lượt là x và y mol.
Khi cho X vào NaOH chỉ có glyxin phản ứng.
= 0,2 mol
Cho X tác dụng với NaCl thì cả glyxin và etylamin phản ứng:
= 0,2 + 0,1 = 0,3 mol → = 0,3/1 = 0,3 lít = 300ml.
Bảo toàn khối lượng có: = 19,5 + 0,3.36,5 = 30,45 gam.
Câu 33:
Nhúng thanh Fe vào dung dịch CuS. Sau một thời gian, quan sát thấy hiện tượng gì?
 Xem đáp án
Xem đáp án
Đáp án B
Fe + CuS→ FeS + Cu
Hiện tượng: Dung dịch nhạt màu dần, có lớp kim loại màu đỏ bám ngoài đinh sắt
Câu 34:
Cho vào ống nghiệm 3 - 4 giọt dung dịch CuS5% và 2 ml dung dịch NaOH 10%. Lắc nhẹ, gạn bỏ phần dung dịch, giữ lại kết tủa Cu. Tiếp tục nhỏ 2 ml dung dịch chất X nồng độ 1% vào ống nghiệm, lắc nhẹ, thu được dung dịch màu xanh lam. X không thể là
 Xem đáp án
Xem đáp án
Đáp án D
Metanol (COH) không phản ứng với Cu.
Câu 35:
Cho 3,36 gam bột sắt vào 300 ml dung dịch CuS 0,05M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 36:
Đốt cháy 5,64 gam hỗn hợp gồm Mg, Al trong khí dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 25,52 gam hỗn hợp muối. Thể tích khí (đktc) đã phản ứng là
 Xem đáp án
Xem đáp án
Đáp án C
Bảo toàn khối lượng có: = 25,52 – 5,64 = 19,88 gam
→ = 19,88/71 = 0,28 mol, = 0,28.22,4 = 6,272 lít.
Câu 37:
Cho 39 gam kim loại Kali vào 362 gam nước thu được dung dịch X. Nồng độ phần trăm của chất tan trong dung dịch X là
 Xem đáp án
Xem đáp án
Đáp án B
= 1.56 = 56 gam.
= 39 + 362 – 0,5.1 = 400 gam.
Câu 38:
Một α-amino axit X (trong phân tử có một nhóm - và một nhóm -COOH). Cho 21,36 gam X phản ứng với lượng dư dung dịch NaOH, thu được dung dịch chứa 26,64 gam muối. Công thức của X là
 Xem đáp án
Xem đáp án
Đáp án B
Đặt X có dạng: N – R – COOH.
N – R – COOH + NaOH → N – R – COONa + O
Cứ 1 mol X thu được 1 mol muối → khối lượng tăng 22 gam
→ Khối lượng tăng 26,64 – 21,36 = 5,28 gam → = 0,24 mol.
→ = 21,36 : 0,24 = 89. Mà X là α-amino axit nên có CTCT là: N-CH(C)-COOH.
Câu 39:
Thủy phân 14,6 gam Gly-Ala trong dung dịch NaOH dư thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Sau phản ứng thu được 2 muối: N-C-COONa: 0,1 mol và N-CH(C)-COONa: 0,1 mol
= 0,1 (97 + 111) = 20,8 gam.
Câu 40:
Đốt cháy hoàn toàn m gam hỗn hợp E gồm hai este mạch hở X và Y (đều tạo bởi axit cacboxylic và ancol, < 150) thu được 4,48 lít khí . Cho m gam E tác dụng vừa đủ với dung dịch NaOH, thu được một ancol Z và 6,76 gam hỗn hợp muối. Cho toàn bộ Z tác dụng với Na dư, thu được 1,12 lít khí . Phần trăm khối lượng của X trong E là
 Xem đáp án
Xem đáp án
Đáp án C
= 0,2 mol; = 0,05 mol → = 0,1 mol → ≥ 0,1 mol;
= = 0,1 → ≥ 0,1 mol.
= + = = 0,2 mol
→ = 0,1 mol; = 0,1 mol.
→ Ancol có số C = số O; muối có số C = số Na. Vậy ancol là COH (0,1 mol); các muối là HCOONa a mol và b mol
Bảo toàn Na có: a + 2b = = 0,1 mol (1).
= 6,76 gam → 68a + 134b = 6,76 gam (2)
Từ (1) và (2) có a = 0,06 và b = 0,02.
X là HCOOC 0,06 mol và Y là 0,02 mol.