282 Bài tập Đại cương về kim loại cực hay có lời giải (P6)
-
6814 lượt thi
-
42 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 2:
Tiến hành điện phân với điện cực trơ và màng ngăn xốp một dung dịch chứa m gam hỗn hợp CuSO4 và NaCl cho đến khi nước bắt đầu bị điện phân ở cả hai điện cực thì dừng lại. Ở anot thu được 0,896 lít khí (đkc). Dung dịch sau khi điện phân có thể hòa tan tối đa 3,2 gam CuO. Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn A.
Vì dung dịch sau phản ứng hòa tan được CuO -> Có H+
Ta có n(H+ = 2n(CuO) = 0,08 mol -> n(O2) = n(H+/4) = 0,02
Mà n(Cl2) + n(O2) = 0,04 -> n(Cl2) = 0,02 mol
Áp dụng định luật bảo toàn nguyên tố Clo -> n(NaCl) = 2n(NaCl) = 0,04 mol
Áp dụng định luật bảo toàn mol e: n(CuSO4) = 4n(O2) + 2n(Cl2))/2 = 0,06
-> m = 0,06∙160 + 0,04∙58,5 = 11,94 gam
Câu 3:
Điện phân dung dịch chứa hỗn hợp CuSO4 và KCl với điện cực trơ đến khi thấy khí bắt đầu thoát ra ở cả hai điện cực thì dừng lại thấy có 448 ml khí (đktc) thoát ra ở anot. Dung dịch sau điện phân có thể hoà tan tối đa 0,8 gam MgO. Khối lượng dung dịch sau điện phân đã giảm bao nhiêu gam (coi lượng H2O bay hơi là không đáng kể) ?
 Xem đáp án
Xem đáp án
Chọn C
n(MgO) = 0,02; n(khí) = 0,02
Dung dịch sau điện phân có thể hòa tan MgO → có H2SO4
PTHH:
CuSO4 + 2KCl → Cu + Cl2 + K2SO4 1
x---------------------------- x mol
CuSO4 + H2O → Cu + H2SO4 + ½ O2 2
y------------------------------y ----------- y/2 mol
H2SO4 + MgO → MgSO4 + H2O
0,02 -------- 0,02 mol
Ta có hệ phương trình
1 n(khí) = x + y/2 = 0,02
2 n(H2SO4) = y = 0,02
Giải 1 2 có x = 0,01; y = 0,02
→ m(dung dịch giảm) = m(Cu) + m(Cl2) + m(O2) = 2,95 gam
Câu 4:
Tiến hành điện phân dung dịch chứa NaCl 0,4M và Cu(NO3)2 0,5M bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi I = 5 A trong thời gian 8492 giây thì dừng điện phân, ở anot thoát ra 3,36 lít khí (đktc). Cho m gam bột Fe vào dung dịch sau điện phân, kết thúc phản ứng, thấy khí NO thoát ra (sản phẩm khử duy nhất của N+5) và 0,8m gam rắn không tan. Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn B
Giả sử tại anot chỉ có Cl2 ⇒ nCl2 = 0,15 mol ⇒ ne = 0,3 mol < 0,44 mol ⇒ vô lí!.
⇒ khí gồm Cl2 và O2 với x và y mol || nkhí = x + y = 0,15 mol; ne = 2x + 4y = 0,44 mol.
⇒ giải hệ có: x = 0,08 mol; y = 0,07 mol ⇒ nNaCl = 0,16 mol ⇒ nCu(NO3)2 = 0,2 mol.
ne > 2nCu2+ ⇒ H2O bị điện phân tại catot ⇒ nOH– = 0,44 – 0,2 × 2 = 0,04 mol.
H+ + OH– → H2O ⇒ H+ dư 0,07 × 4 – 0,04 = 0,24 mol; nNO3– = 0,4 mol.
Xét Fe + dung dịch sau điện phân: do thu được rắn ⇒ Fe dư ⇒ Fe chỉ lên số oxi hóa +2.
3Fe + 8H+ + 2NO3– → 3Fe2+ + 2NO + 4H2O ⇒ nFe phản ứng = 0,09 mol.
m – 0,09 × 56 = 0,8m ⇒ m = 25,2(g)
Câu 5:
Điện phân dung dịch chứa đồng thời NaCl và CuSO4 (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của các khí trong nước và sự bay hơi của nước) với cường độ dòng điện không đổi. Kết quả thí nghiệm được ghi ở bảng sau:
|
Thời gian điện phân (giây) |
Khối lượng catot tăng (gam) |
Khí thoát ra ở anot |
Dung dịch thu được sau điện phân có khối lượng giảm so với khối lượng dung dịch ban đầu (gam) |
|
1930 |
m |
Một khí duy nhất |
2,70 |
|
7720 |
4m |
Hỗn hợp khí |
9,15 |
|
t |
5m |
Hỗn hợp khí |
11,11 |
Giá trị của t là
 Xem đáp án
Xem đáp án
Chọn C
Do tại 3 thời điểm khối lượng catot đều tăng nên Cu2+ điệp phân chưa hết ở t1 và t2
∙Tại t1 = 1930 giây: ne1 = It1/F = 0,02I
=> nCl2 = 0,01I
n e1 = 2nCu2+ bị đp => 0,02I = 2m/64 1
m dung dịch giảm = mCu + mCl2 => 2,7 = m + 71.0,01I 2
Giải 1 và 2 => m = 1,28; I = 2
∙Tại t2 = 7720 => ne2 = 0,16 mol
Anot:
Cl- -1e → 0,5Cl2
x 0,5x
H2O -2e → 0,5O2 + 2H+
y 0,25y
x+y = 0,16
0,5x.71+0,25y.32+4.1,28 = 9,15
Giải ra ta được x = 0,1; y = 0,06
∙Tại t3 = t: Giả sử nước bị điện phân ở cả 2 điện cực
nH2 = a mol, nO2 = b mol
m dung dịch giảm = mCu + mH2 + mCl2 +mO2 => 11,11 = 5.1,28 + 2a + 0,05.71 + 32b 3
n e anot = ne catot => 2nCu + 2nH2 = 2nCl2 + 4nO2 => 2.0,1 + 2a = 0,05.2 + 4b 4
Giải 3 và 4 thu được: a = 0,02; b = 0,035
n e3 = 2.0,1 + 2.0,02 = 0,24 mol => t = 0,24.96500/2 = 11580 giây
Câu 6:
Cho m gam hỗn hợp E gồm Al (a mol), Zn (2a mol), Fe (a mol), 0,12 mol NaNO3, Fe3O4, Fe(NO3)2 tác dụng hết với dung dịch chứa 1,08 mol H2SO4 thu được dung dịch X chỉ chứa các muối và 0,24 mol hỗn hợp Y chứa hai khí NO, H2 với tổng khối lượng 4,4 gam. Cô cạn dung dịch X thu được (m + 85,96) gam muối. Nếu nhỏ từ từ dung dịch KOH 2M vào dung dịch X đến khi không còn phản ứng nào xảy ra thì vừa hết 1,27 lít dung dịch KOH. Phần trăm khối lượng của đơn chất Fe trong E là?
 Xem đáp án
Xem đáp án
Chọn A
Bảo toàn khối lượng ở phản ứng đầu tiên: mE + mH2SO4 = mX + mY + mH2O
⇒⇒ m + 98 ∙ 1,08 = m + 85,96 + 4,4 + 18 ∙ nH2O ⇒⇒ nH2O = 0,86 mol
● Ta có: nNO + nH2 = 0,24 và 30nNO + 2nH2 = 4,4
⇒⇒ nNO = 0,14 và nH2 = 0,1
Bảo toàn H ta có: 2nH2SO4 = 4nNH4+ + 2nH2 + 2nH2O ⇒⇒ nNH4+ = 0,06 mol
● Ghép cụm ta có: nH2O = 2nNO + 3nNH4+ + nO trong Fe3O4
⇒⇒ nO trong Fe3O4 = 0,4 ⇒⇒ nFe3O4 = nO4nO4 = 0,1 mol
● Bảo toàn N ta có: nNaNO3 + 2nFe(NO3)2 = nNH4+ + nNO ⇒⇒ nFe(NO3)2 = 0,04 mol
● Do X phản ứng với tối đa 2,54 mol KOH nên ta có: 4nAl + 4nZn + x ∙ nFex+ + nNH4+ = 2,54
⇒⇒ 12a + x ∙ nFex+ = 2,48
Mặt khác, bảo toàn điện tích trong X ta có: x ∙ nFex+ + nNa+ + 3nAl3+ + 2nZn2+ + nNH4+ = 2nSO42–
⇒⇒ x ∙ nFex+ + 7a = 1,98
Giải hệ ta được: x ∙ nFex+ = 1,28 và a = 0,1
Vậy nFe = a = 0,1 mol và m = 0,1 ∙ 27 + 0,2 ∙ 65 + 0,1 ∙ 56 + 0,12 ∙ 85 + 0,1 ∙ 232 + 0,04 ∙ 180 = 61,9
⇒⇒ %mFe/E = 0,1∗5661,90,1∗5661,9 ≈ 9,047%
Câu 7:
Tiến hành điện phân dung dịch chứa x mol Cu(NO3)2 và y mol NaCl bằng điện cực trơ, với cường độ dòng điện không đổi I = 5A trong thời gian 2895 giây thì dừng điện phân, thu được dung dịch X. Cho 0,125 mol bột Fe vào dung dịch X, kết thúc phản ứng, thấy thoát ra 0,504 lít khí NO (sản phẩm khử duy nhất ở đktc); đồng thời còn lại 5,43 gam rắn không tan. Tỉ lệ x : y gần nhất là
 Xem đáp án
Xem đáp án
Chọn B
ne = It/F = 5.2895/96500 = 0,15 mol
Do khi cho Fe vào dung dịch điện phân sinh ra khí NO nên H2O ở anot đã bị điện phân tạo H+.
Giả sử dung dịch sau phản ứng không có Cu2+
nFe = 3nNO/2 = 0,03375 mol => mFe pư = 1,89 gam, chất rắn sau phản ứng có khối lượng là 0,125.56 – 1,89 = 5,11 gam (loại)
Vậy dung dịch sau điện phân có chứa Cu2+
Catot :
Cu2+ +2e → Cu
0,15 0,075 mol
Anot :
Cl- - 1e → 0,5Cl2
y 0,5y
H2O - 2e → 0,5O2 + 2H+
0,09 0,09
3Fe + 8H+ +2NO3- → 3Fe2+ + 2NO + 4H2O
0,03375 0,09 0,0225
Fe + Cu2+ → Fe2+ + Cu
x-0,075 x-0,075 x-0,075
m chất rắn = mCu + mFe dư = 64(x-0,075) + 0,125.56 - 56(0,03375+x-0,0075) = 5,43
=> x = 0,115 mol
n e trao đổi (anot) = y+0,09 = 0,15 => y = 0,06
x:y = 1,917
Câu 8:
Tiến hành điện phân (với điện cực trơ , hiệu suất 100%, dòng điện có cường độ không đổi) với dung dịch X gồm 0,2 mol CuSO4 và 0,15 mol HCl, sau một thời gian điện phân thu được dung dịch Y có khối lượng giảm 14,125 gam so với khối lượng dung dịch X. Cho 15 gam bột Fe vào Y đến khi kết thúc các phản ứng thu được m gam chất rắn. Biết các khí sinh ra hòa tan không đáng kể trong nước. Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn A
Khối lượng dung dịch giảm gồm CuCl2: 0,075 mol và CuO : 14,125−0,075.(64+71)/80 = 0,05 mol
Dung dịch Y chứa CuSO4 : 0,2- 0,075- 0,05 = 0,075 mol, H2SO4 : 0,125 mol ( bảo toàn nhóm SO42−
Khi cho 15 gam bột Fe thì xảy ra phản ứng
Fe + H2SO4 → FeSO4 + H2
Fe + CuSO4 → FeSO4 + Cu
Khối lượng chất rắn thu được gồm Cu : 0,075 mol và Fe dư: 15- 0,075. 56- 0,125. 56 = 3,8 gam → m = 0,075. 64 +3,8 = 8,6 gam
Câu 9:
X, Y là 2 axit đơn chức cùng dãy đồng đẳng, T là este 2 chức tạo bởi X, Y với ancol no mạch hở Z. Đốt cháy 8,58 gam hỗn hợp E gồm X, Y, T thì thu được 7,168 lít CO2 (đktc) và 5,22 gam H2O. Mặt khác, đun nóng 8,58 gam E với dung dịch AgNO3/NH3 dư thì thu được 17,28 gam Ag. Tính khối lượng chất rắn thu được khi cho 8,58 gam E phản ứng với 150 ml dung dịch NaOH 1M?
 Xem đáp án
Xem đáp án
Chọn A
Câu 10:
Cho các chất hữu cơ mạch hở. X là axit không no có hai liên kết trong phân tử, Y là axit no đơn chức, Z là ancol no hai chức, T là este của X, Y với Z. Đốt cháy hoàn toàn a gam hỗn hợp M gồm X và T, thu được 0,1 mol CO2 và 0,07 mol H2O. Cho 6,9 gam M phản ứng vừa đủ với dung dịch NaOH, cô cạn dung dịch sau phản ứng thu được hỗn hợp muối khan E. Đốt cháy hoàn toàn E, thu được Na2CO3; 0,195 mol CO2 và 0,135 mol H2O. Phần trăm khối lượng của T trong M có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn A
T là este của X, Y với Z nên X cũng đơn chức.
Muối E gồm XCOONa và YCOONa
→ n(XCOONa) = n(CO2) – n(H2O) = 0,06
Trong 6,9 gam M đặt:
X là CnH2n-2O2 ( u mol)
T là CmH2m-4O4 (v mol)
→ u + v = 0,06 1
m(M) = u14n + 30) + v14m + 60) = 6,9 2
Trong phản ứng đốt cháy:
n(X) + 2n(T) = n(CO2) – n(H2O) = 0,03
→ n(O) = 2n(X) + 3n(T) = 0,06
Áp dụng ĐLBT nguyên tố O → n(O2) = 0,105
Áp dụng ĐLBT khối lượng → m(M) = 2,3 → Trong phản ứng xà phòng hóa đã dùng lượng M nhiều gấp 6,9/2,3 = 3 lần phản ứng cháy.
→ n(CO2) = (nu + mv)/3 = 0,1 3
Giải 12 và 3 → u = 0,03; v = 0,03
nu+ mv = 0,3
→ n +m = 10
Do n ≥ 3 và m ≥ 6 và m≥ n + 3 → n = 3; m = 7 là nghiệm duy nhất.
X là CH2=CH-COOH 0,03)
T là CH2=CH-COO-CH2-CH2-OOC-CH30,03)
→%T = 68,7%
Câu 11:
Cho các chất hữu cơ: X, Y là hai ancol có cùng số nguyên tử cacbon trong phân tử, Z là axit no, mạch hở (MZ > 90) và este T (phân tử chỉ chứa chức este) tạo bởi X, Y với một phân tử Z. Đốt cháy hoàn toàn 0,325 mol hỗn hợp E gồm X, Y, Z và T, thu được 20,16 lít CO2 (đktc) và 17,55 gam H2O. Phần trăm số mol của T trong E gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn B
n(CO2) = 0,9; n(H2O) = 0,975
Số C = nCO2/nE = 2,77
Do Z đa chức và có M(Z) > 90 nên Z ít nhất 3C. Vậy hai ancol phải ít hơn 2,77C, chúng lại cùng C → C2H5OH và C2H4(OH)2 → Z là axit 3 chức và T là este 3 chức, 1 vòng.
Số H = 2nH2O/nE = 6
Do este nhiều hơn 6H nên axit phải có ít hơn 6H.
Vậy E gồm: C2H6Oz = a mol; CH(COOH)3: b mol; CH(COO)2C2H4-COOC2H5: c mol
n(E) = a + b + c = 0,325 mol
n(CO2) = 2a + 4b + 8c = 0,9
n(H2O) = 3a + 2b + 5c = 0,975
→ a = 0,25; b = 0,05; c = 0,025 → %nT = 7,69%
Câu 12:
Hỗn hợp X gồm hai chất hữu cơ no, mạch hở (đều chứa C, H, O), trong phân tử mỗi chất có hai nhóm chức trong số các nhóm –OH, –CHO, –COOH. Cho m gam X phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 4,05 gam Ag và 1,86 gam muối amoni hữu cơ. Cho toàn bộ lượng muối amoni hữu cơ vào dung dịch NaOH (dư, đun nóng), thu được 0,02 mol NH3. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn A
Muối R-(COONH4)z a mol + NaOH --→ az mol NH3 ==> az = 0,02
M muối = R + 62z = 1,86/a = 93z ==> R = 31z
Với z = 2 ==> R = 62 ==> loại
Với z = 1 ==> R = 31 là gốc HO-CH2-
===> CT 2 chát là: HO-CH2-CHO x mol , HO-CH2-COOH y mol
HO-CH2-CHO --→ HO-CH2-COO-NH4 + 4 Ag
x------------------------------x-----------------2x ===> mol Ag = 2x = 0,0375 ===> x = 0,01875
HO-CH2-COOH --→ HO-CH2-COO-NH4
y-----------------------------------y
mol NH3 = mol muối = x + y = 0,02 ===> y = 0,00125
m = 60x + 76y = 1,22
Câu 13:
Ba chất hữu cơ X, Y, Z (50 < MX < MY < MZ) đều có thành phần nguyên tố C, H, O, chứa các nhóm chức đã học. Hỗn hợp T gồm X, Y, Z, trong đó nX = 4(nY + nZ). Đốt cháy hoàn toàn m gam T, thu được 13,2 gam CO2. Mặt khác m gam T phản ứng vừa đủ với 0,4 lít dung dịch KHCO3 0,1M. Cho m gam T phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 56,16 gam Ag. Phần trăm khối lượng của X trong hỗn hợp T là
 Xem đáp án
Xem đáp án
Chọn D
nCO2 = 0,3 mol; nCOOH = nKHCO3 = 0,04 mol; nCHO = nAg ÷ 2 = 0,26 mol.
Ta có ∑nC = nCOOH + nCHO ⇒ không có C ngoài nhóm chức CHO và COOH.
||⇒ X là (CHO)2, Y là OHC-COOH và Z là (COOH)2 với số mol x, y và z.
gt: x = 4.(y + z) || nCHO = 2x + y = 0,26 mol; nCOOH = y + 2z = 0,04 mol.
Giải hệ có: x = 0,12 mol; y = 0,02 mol; z = 0,01 mol ||⇒ %mX = 74,52%
Câu 14:
Đốt cháy 0,15 mol hỗn hợp X gồm metyl acrylat, etylen glicol, axetanđehit và ancol metylic cần dùng a mol O2. Sản phẩm cháy dẫn qua 200 ml dung dịch Ba(OH)2 1M, lọc bỏ kết tủa, cho dung dịch Ca(OH)2 dư vào phần nước lọc thì thu được thêm 53,46 gam kết tủa nữa. Giá trị của a là bao nhiêu?
 Xem đáp án
Xem đáp án
Chọn A
Hỗn hợp gồm: C4H6O2; C2H6O2; C2H4O và CH4O.
Quan sát: 2 thằng đầu cùng H6O2; 2 thằng sau cùng H4O.
Yêu cầu liên quan đến O2 cần đốt ||→ tách bỏ H2O lại thấy sự đặc biệt:
0,15 mol hỗn hợp gồm x mol C + y mol H2O + 0,15 mol H2.
Chuyển qua bài tập CO2 + dung dịch kiềm: vì Ca(OH)2 vào có thêm kết tủa
||→ CO2 + 0,2 mol Ba(OH)2 → BaCO3↓ + Ba(HCO3)2 1.
Theo đó: Ca(OH)2 + Ba(HCO3)2 → CaCO3 + BaCO3 + 2H2O 2;
mtủa (2) = 18 gam ||→ có 0,18 mol Ca(HCO3)2 và 0,18 mol BaCO3. Bảo toàn Ba → nBaCO3 ở 1 = 0,02 mol.
||→ x = ∑nCO2 = 0,02 + 0,18 × 2 = 0,38 mol (theo bảo toàn C ở 1.
Ta có: a = ∑nO2 cần đốt = x + ½.nH2 = 0,38 + 0,15 ÷ 2 = 0,455 mol
Câu 15:
X, Y là hai axit cacboxylic đều đơn chức, mạch hở (trong phân tử X, Y chứa không quá 2 liên kết π và 50 < MX < MY); Z là este được tạo bởi X, Y và etylen glicol. Đốt cháy 13,12 gam hỗn hợp E chứa X, Y, Z cần dùng 0,50 mol O2. Mặt khác 0,36 mol E làm mất màu vừa đủ dung dịch chứa 0,1 mol Br2. Nếu đun nóng 13,12 gam E với 200 ml dung dịch KOH 1M (vừa đủ), cô cạn dung dịch sau phản ứng thu được hỗn hợp F gồm a gam muối A và b gam muối B (MA < MB). Tỉ lệ của a : b gần nhất với giá trị nào sau đây
 Xem đáp án
Xem đáp án
Chọn B
gt ⇒ X không thể là HCOOH. || Quy E về CH3COOH, (CH3COO)2C2H4, CH2 và H2.
với số mol là x, y, z và t || mE = 60x + 146y + 14z + 2t = 13,12(g); nO2 = 2x + 6,5y + 1,5z + 0,5t = 0,5 mol.
nKOH = x + 2y = 0,2 mol || nE/nπ= (x+y)/−t = 0,36/0,1
⇒ giải hệ có: x = 0,16 mol; y = 0,02 mol; z = 0,05 mol; t = – 0,05 mol.
|| Muối gồm 0,2 mol CH3COOK; 0,05 mol CH2 và – 0,05 mol H2. Ghép CH2 và H2 kết hợp điều kiện ≤ 2π.
⇒ A là CH3COOK (0,15 mol) và B là CH2=CHCOOK (0,05 mol) ⇒ a : b = 2,672
Câu 16:
Chia một lượng hỗn hợp X gồm 2 axit hữu cơ (no, đơn chức, mạch hở, đồng đẳng liên tiếp) và ancol etylic thành hai phần bằng nhau:
- Phần 1 cho phản ứng hoàn toàn với Na dư, thu được 3,92 lít H2 (đktc).
- Phần 2 đem đốt cháy hoàn toàn rồi cho toàn bộ sản phẩm sục vào bình đựng dung dịch Ba(OH)2 dư, thấy khối lượng bình đựng tăng 56,7 gam và có 177,3 gam kết tủa.
Công thức của axit có phân tử khối lớn hơn và thành phần % về khối lượng của nó trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Chọn D
Xét ½ hỗn hợp X có : CnH2nO2 : a (mol) ; C2H5OH : b (mol) → a + b = 2n(H2) = 0,35 (mol)
n(CO2) = n(BaCO3) = 0,9 = an + 2b
m(CO2) + m(H2O) = 56,7 gam → m(H2O) = 56,7 – 0,9*44 = 17,1 → n(H2O) = 0,95
n(C2H5OH) = b = n(H2O) – n(CO2) = 0,95 – 0,9 = 0,05 → a = 0,3 → n =2,67
→ Hai axit là : C2H4O2 : x mol và C3H6O2 : y mol
Ta có hpt :
(1) x + y = 0,3
(2) 2x + 3y = 0,9 – 0,05*2 = 0,8
Giải (1) và (2) → x = 0,1 và y = 0,2
→ %C3H6O2 = 64,07%
Câu 17:
Chất hữu cơ X có công thức phân tử C10H8O4, trong phân tử chỉ chứa một loại nhóm chức. Biết 1 mol X tác dụng vừa đủ với 3 mol NaOH tạo thành dung dịch Y gồm 2 muối (trong đó có một muối có KLPT < 100 đvC), một anđehit no, đơn chức, mạch hở và H2O. Cho dung dịch Y phản ứng hết với dung dịch AgNO3/NH3 dư, đun nóng thì thu được m gam kết tủa. Giá trị của m gần nhất với
 Xem đáp án
Xem đáp án
Chọn B
X tác dụng với NaOH tỷ lệ 1 : 3 tạo muối và anđehit → X là este 2 chức, có 1 chức nối trực tiếp với vòng benzen. Mà dung dịch tạo 2 muối trong đó có 1 muối M < 100 → Axit tạo este đơn chức.
→ X : HCOOC6H4COOCH=CH2 + NaOH → HCOONa + NaOC6H4COONa + CH3CHO
Y + AgNO3 /NH3 → 4Ag
→ m = 432 gam
Câu 18:
Hợp chất X có công thức C6H10O5 (trong phân tử không chứa nhóm -CH2-). Khi cho X tác dụng với NaHCO3 hoặc với Na thì số mol khí sinh ra luôn bằng số mol X đã phản ứng. Từ X thực hiện các phản ứng sau (theo đúng tỉ lệ mol):
(1) X Y + H2O
(2) X + 2NaOH 2Z + H2O
(3) Y + 2NaOH Z + T + H2O
(4) 2Z + H2SO4 2P + Na2SO4
(5) T + NaOH Na2CO3
(6) Q + H2O G
Biết rằng X, Y, Z, T, P, Q, G đều là các hợp chất hữu cơ mạch hở. Trong các phát biểu sau:
(a) P tác dụng với Na dư thu được số mol H2 bằng số mol P phản ứng.
(b) Q có khả năng thúc cho hoa quả mau chín.
(c) Hiđro hóa hoàn toàn T (Ni, to) thì thu được Z.
(d) G có thể dùng để sản xuất “xăng sinh học”.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn C
Gọi công thức của X là RCOOCH2R’ → ancol Z là R’CH2OH
Xét T:
R’CH2OH + 1/2O2 → R’CHO + H2O
R’CH2OH + O2 → R’COOH + H2O
Trong 1/3 T có: R’CHO: x mol; R’COOH: y mol; R’CH2OH dư: z mol; H2O: x +y mol
+) Phần 1 + AgNO3/NH3 → n(Ag) = 2n(R’CHO) = 0,2 mol → x = 0,1 mol
+) Phần 2 + NaHCO3 → n(CO2) = n(R’COOH) = 0,1 mol → y =0,1 mol
+) Phần 3 + Na → n(H2) = ½ n(R’COOH) + ½ n(R’CH2OH) + ½ n(H2O) → z = 0,1 mol
Mặt khác: 25,8 gam chất rắn = m(R’COONa) + m(R’CH2OH) + m(NaOH)
→ 25,8 = 0,1*(R’+44+23) + 0,1*(R’+14+16+23) + 0,2*40 → R’ = 29 (C2H5)
Câu 19:
Chất hữu cơ Z có công thức phân tử C17H16O4, không làm mất màu dung dịch brom. Z tác dụng với NaOH theo phương trình sau: Z + 2NaOH 2X + Y. Trong đó Y hòa tan Cu(OH)2 tạo thành dung dịch có màu xanh lam đặc trưng. Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Chọn D
%C/X = 12 × 7 ÷ 144 = 7: 12
Câu 20:
X là axit no, đơn chức; Y là axit không no, có một liên kết đôi C C, có đồng phân hình học; Z là este hai chức tạo thành từ X, Y và một ancol no (tất cả các chất đều mạch hở). Đốt cháy hoàn toàn 9,52 gam E chứa X, Y, Z thu được 5,76 gam H2O. Mặt khác, 9,52 gam E có thể phản ứng tối đa với dung dịch chứa 0,12 mol NaOH, sản phẩm sau phản ứng có chứa 12,52 hỗn hợp các chất hữu cơ. Cho các phát biểu sau:
(a) Phần trăm khối lượng của X trong E là 12,61%.
(b) Số mol của Y trong E là 0,06 mol.
(c) Khối lượng của Z trong E là 4,36 gam.
(d) Tổng số nguyên tử (C, H, O) trong Z là 24.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn D
Gọi X: CxH2xO2 (a mol); Y: CyH2y-2O2 (b mol); Z: CzH2z-4O4 (c mol
n(H2O) = ax + b(y-1) + c(z-2) = 0,32
m(E) = a(14x+32) + b(14y+30) + c(14z+60) = 9,52
n(NaOH) = a+b+2c= 0,12
Áp dụng ĐLBT khối lượng cho phản ứng với NaOH → n(H2O) = a+b = 0,1
→ a = 0,02; b = 0,08; c = 0,01; ax+by+cz = 0,42
→ 2x+8y+z = 42 → chỉ có x = 1; y = 4; z = 8 là nghiệm thỏa mãn
X là HCOOH: 0,02; Y là CH3CH=CH-COOH: 0,08; Z là CH3-CH=CH-COOC3H6-OOCH: 0,01
Câu 21:
Thủy phân hết m gam hỗn hợp X gồm một số este được tạo bởi axit đơn chức và ancol đơn chức bằng một lượng dung dịch NaOH vừa đủ rồi cô cạn thu được a gam muối và b gam hỗn hợp ancol. Đốt cháy a gam hỗn hợp muối thu được hỗn hợp khí Y và 7,42 gam Na2CO3. Cho toàn bộ hỗn hợp khí Y sinh ra qua bình đựng dung dịch Ca(OH)2 dư thu được 23 gam kết tủa đồng thời thấy khối lượng bình tăng 13,18 gam so với ban đầu. Đun b gam hỗn hợp ancol sinh ra với H2SO4 đặc ở 1400C thu được 4,34 gam hỗn hợp các ete. Các phản ứng xảy ra hoàn toàn. Giá trị m gần giá trị nào nhất sau đây?
 Xem đáp án
Xem đáp án
Chọn D
Thủy phân hết m gam hỗn hợp X gồm một số este được tạo bởi axit đơn chức và ancol đơn chức
→ Gọi công thức của X là RCOOR’
Vì Ca(OH)2 dư nên n(CO2) = nkt = 0,23 mol
Có m bình tăng = m(CO2) + m(H2O)
→ n(H2O) = (13,18 – 0,23.44)/18 = 0,17 (mol)
Có n(Na2CO3) = 0,07 mol → n(NaOH) = 0,14 mol
Muối thu được dạng RCOONa: 0,14 mol → mmuối = mC + mH + mO + mNa
→ mmuối = 12.(0,23 + 0,07) + 0,17.2 + 0,14.2.16 + 0,14.23 = 11,64 (gam)
Vì este đơn chức nên nancol = naxit = 0,14 mol
Khi tham gia phản ứng tạo ete luôn có n(H2O) = 0,5 ; tổng nancol = 0,07 mol
→ mancol = mete + m(H2O) = 4,34 + 0,07.18 = 5,6 gam
Bảo toàn khối lượng → meste = mmuối + mancol - mNaOH
→ meste = 11,64 + 5,6 – 0,14.40 = 11,64 gam
Câu 22:
Đốt cháy 16,92 gam hỗn hợp A gồm 3 este X, Y, Z đều mạch hở (trong đó Y và Z có cùng số nguyên tử C) bằng lượng O2 vừa đủ thì thu được 11,88 gam nước. Mặt khác, đun nóng 16,92 gam A trong 240 ml dung dịch NaOH 1M vừa đủ, cô cạn dung dịch sau phản ứng thu được hỗn hợp B gồm 2 muối và hỗn hợp D gồm 2 ancol đồng đẳng kế tiếp. Đun nóng hỗn hợp D với H2SO4 đặc ở 140oC thì thu được 5,088 gam hỗn hợp 3 ete (hiệu suất ete hóa của mỗi ancol đều là 80%). Phần trăm khối lượng của X trong hỗn hợp A là
 Xem đáp án
Xem đáp án
Chọn D
n(ancol) = n(NaOH) = 0,24 mol → n(ancol phản ứng) = 0,24*80% = 0,192 mol
→ n(este) = n(H2O) =0,096 → m(ancol phản ứng) = m(ete) + m(H2O) = 6,816
→ M (ancol) = 35,5 → 2 ancol là CH3OH (0,18 mol) và C2H5OH (0,06 mol)
Trong E: n(H2O) = 0,66 mol → n(H) = 1,32 n(O) = 2n(NaOH) = 0,48 → n(C) = 0,66
Vậy đốt E thu được sản phẩm có n(CO2) = n(H2O) → E chứa các este no, đơn chức.
Số C = 0,66/0,24 = 2,75 → X là HCOOCH3
TH1: Y và Z đều có dạng RCOOC2H5
n(X) = 0,18, n(Y) + n(Z) = 0,06
n(CO2) = 0,18*2 + 0,06n = 0,66 → n = 5 (Loại vì Y, Z trùng nhau)
TH2: X là HCOOCH3 (a), Y là RCH2COOCH3 (b) và Z là RCOOC2H5 (0,06)
→ n(CH3OH) = a + b =0,18 mol
→ m(khí) = 2a + (R+15)b + (R+1)*0,06 = 0,24*9 → Rb + 13b + (R+1)*0,06 = 1,8
→ 0,06(R+1) < 1,8 → R < 29 → R = 15 → a = 0,15 và b = 0,03
Vậy các chất trong R:
X: HCOOCH3 (0,15 mol); Y: C2H5COOCH3 (0,03 mol); Z: CH3COOC2H5 (0,06)
%X = 53,19%
Câu 23:
Điện phân dung dịch X gồm FeCl2 và MgCl2 (có màng ngăn), sự phụ thuộc khối lượng của dung dịch X theo thời gian được biểu diễn theo đồ thị sau:
Giá trị x là
 Xem đáp án
Xem đáp án
Chọn C
Tại y (s)
Tại 1,5y (s)
Tại 2,5y (s)
Câu 24:
Điện phân dung dịch AgNO3 với điện cực trơ, cường độ dòng điện I = 2A. Sau thời gian t giây, khối lượng dung dịch giảm là a gam và catot chỉ thu được kim loại. Sau thời gian 2t giây khối lượng dung dịch giảm (a + 5,36) gam (biết a > 5,36) và thu được dung dịch X. Biết dung dịch X hòa tan tối đa được 3,36 gam Fe (sản phẩm khử của N+5 chỉ là NO). Coi lượng nước bay hơi trong quá trình điện phân không đáng kể, bỏ qua sự hoàn tan của khí trong nước. Giá trị của t là
 Xem đáp án
Xem đáp án
Chọn D.
Dung dịch X chứa HNO3
Þ (trường hợp tạo Fe2+)
Þ AgNO3: 0,16 mol
Tại thời điểm t (s) thu được Ag là x mol Þ ne (1) = x và a = 108x + 0,25x.32 (1)
Tại thời điểm 2t (s) thu được: Ag (0,16 mol) và
Þ a + 5,36 = 0,16.108 + (2x – 0,16) + 32.0,5x
Từ (1), (2) suy ra: x = 0,12 Þ t = 5790 (s).
Câu 25:
Hòa tan hoàn toàn m gam hỗn hợp Cu(NO3)2 và KCl vào H2O thu được dung dịch X. Điện phân dung dịch X (với điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) trong thời gian t giờ thu được 1,12 lít (đktc) khí ở anot. Nếu điện phân trong thời gian 3,5t giờ thì thu được 2,8 lít (đktc) khí ở anot và thu được dung dịch Y. Cho 20 gam bột Fe vào Y, sau khi các phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất của N+5) và 16,4 gam hỗn hợp kim loại. Biết hiệu suất điện phân là 100%, các khí không tan trong dung dịch. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn A.
Tại thời điểm t (s) tại anot thu được khí Cl2 (0,05 mol) Þ ne (1) = 0,1 mol
Tại thời điểm 3,5t (s) tại anot có:
và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
Khi cho Y tác dụng với Fe thì: nFe pư =
=
Chất rắn thu được gồm Fe dư và Cu Þ 20 – 56.(a + 0,075) + 64a = 16,4 Þ a = 0,075
Vậy dung dịch X gồm Cu(NO3)2 (0,25 mol) và KCl (0,15 mol) Þ m = 58,175 (g).
Câu 26:
Điện phân dung dịch X chứa KCl và CuSO4 bằng dòng điện một chiều có cường độ không đổi 5A (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch). Toàn bộ khí sinh ra trong quá trình điện phân (ở cả hai điện cực) theo thời gian được biểu diễn bằng đồ thị sau:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn A
Tại x(s)
Tại y(s)
Tại z(s)
Câu 27:
Hòa tan hết hỗn hợp gồm Cu và Fe3O4 trong dung dịch chứa 0,6 mol HCl, thu được dung dịch X. Tiến hành điện phân dung dịch X bằng điện cực trơ với cường độ dòng điện không đổi. Quá trình điện phân được biểu diễn theo đồ thị sau:
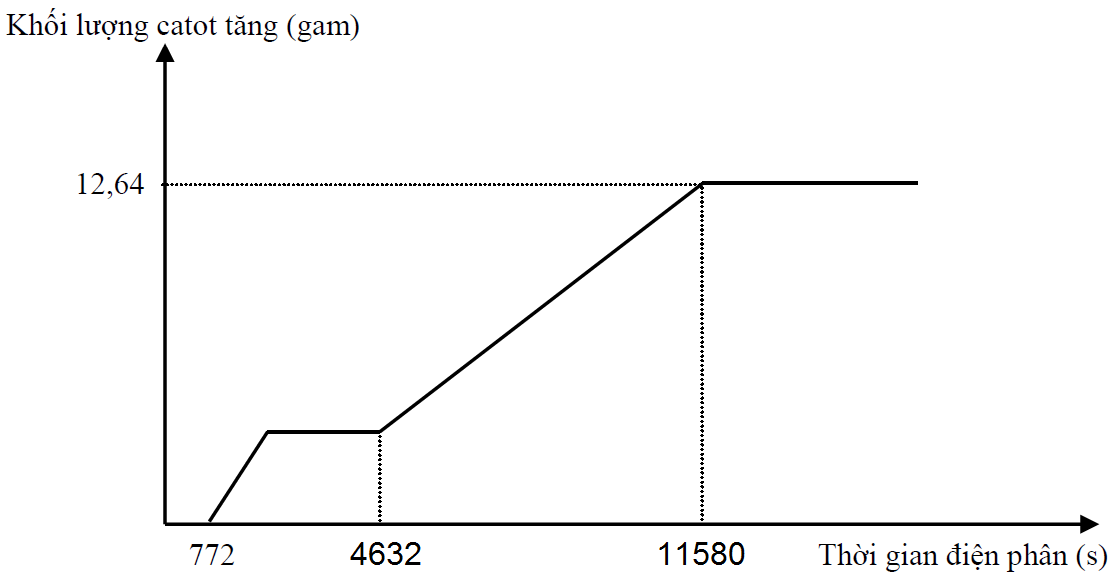
Nếu cho dung dịch AgNO3 đến dư vào X, kết thúc phản ứng thấy thoát ra V lít khí NO(đktc, sản phẩm khử duy nhất của N+5). Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn A.
Dung dịch X chứa H+(x mol), Fe2+ (y mol), Fe3+ (z mol), Cu2+ (t mol), Cl- (0,6 mol)
Tại thời điểm t1 = 772 (s): Fe3+ điện phân hết chuyển thành Fe2+ Þ ne (1) = z
Tại thời điểm t2 = 4632 (s): Cu2+, H+ điện phân hết Þ ne (2) = x + z + 2t
Tại thời điểm t3 = 11580 (s): Fe2+ điện phân hết Þ ne (3) = x + 2y + 3z + 2t và 56(y + z) + 64t = 12,64 (2)
+ Với t2 = 6t1 Þ x + z + 2t = 6z (3)
+ Với t3 = 15t1 Þ x + 2y + 3z + 2t = 15z. Thay (1) vào Þ z = 0,04
Từ (1), (2), (3) suy ra: x = 0,12 ; y = 0,14 ; t = 0,04
Khi cho AgNO3 đến dư vào X thì:
Câu 28:
Hòa tan m gam hỗn hợp CuSO4 và KCl vào nước thu được dung dịch X. Điện phân dung dịch X với cường độ dòng điện không đổi (điện cực trơ, màng ngăn xốp). Thể tích khí (V) thoát ra theo thời gian (t) được biểu diễn theo đồ thị sau:
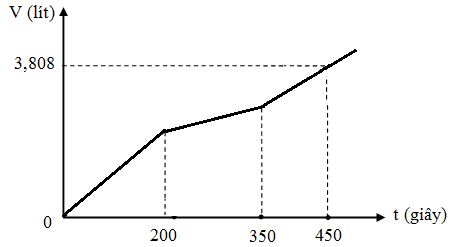
Nếu dừng điện phân ở thời điểm 250 giây thu được dung dịch Y. Nhúng thanh nhôm (dư) vào Y, sau khi phản ứng hoàn toàn, khối lượng dung dịch Y thay đổi như thế nào?
 Xem đáp án
Xem đáp án
Chọn A.
Tại thời điểm t = 200 (s): chỉ có khí Cl2 (x mol) tại anot Þ ne (1) = 2x mol
Tại thời điểm t = 350 (s): có khí Cl2 (x mol) và O2 Þ ne (2) = 3,5x mol nCu = 1,75x
Tại thời điểm t = 450 (s): có khí Cl2 (x mol), O2, H2 Þ ne (3) = 4,5x mol
Tại thời điểm t = 250 (s) Þ ne = 0,2 mol Þ
Dung dịch Y có chứa H+ (0,04 mol); Cu2+ (0,04 mol)
Khi cho Y tác dụng với Al thì: mdd giảm
Câu 29:
Hòa tan hết hỗn hợp gồm Cu và Fe3O4 trong dung dịch chứa 0,6 mol HCl, thu được dung dịch X. Tiến hành điện phân dung dịch X bằng điện cực trơ với cường độ dòng điện không đổi. Quá trình điện phân được biểu diễn theo đồ thị sau:
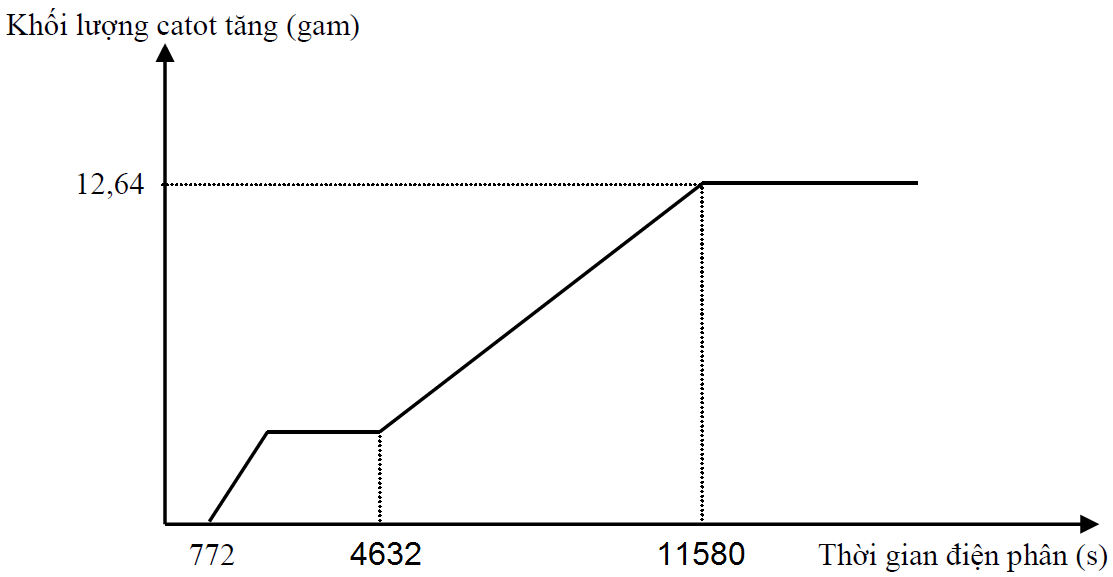
Nếu cho dung dịch AgNO3 đến dư vào X, kết thúc phản ứng thấy khí NO thoát ra (sản phẩm khử duy nhất của N+5), đồng thời thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn B.
Dung dịch X chứa H+(x mol), Fe2+ (y mol), Fe3+ (z mol), Cu2+ (t mol), Cl- (0,6 mol)
Tại thời điểm t1 = 772 (s): Fe3+ điện phân hết chuyển thành Fe2+ Þ ne (1) = z
Tại thời điểm t2 = 4632 (s): Cu2+, H+ điện phân hết Þ ne (2) = x + z + 2t
Tại thời điểm t3 = 11580 (s): Fe2+ điện phân hết Þ ne (3) = x + 2y + 3z + 2t và 56(y + z) + 64t = 12,64 (2)
+ Với t2 = 6t1 Þ x + z + 2t = 6z (3)
+ Với t3 = 15t1 Þ x + 2y + 3z + 2t = 15z. Thay (1) vào Þ z = 0,04
Từ (1), (2), (3) suy ra: x = 0,12 ; y = 0,14 ; t = 0,04
Khi cho AgNO3 đến dư vào X thì:
Kết tủa thu được là AgCl (0,6 mol) và Ag (0,03 mol) Þ m = 91,5 (g)
Câu 30:
Hòa tan m gam hỗn hợp CuSO4 và KCl vào nước thu được dung dịch X. Điện phân dung dịch X với cường độ dòng điện không đổi (điện cực trơ, màng ngăn xốp). Thể tích khí (V) thoát ra theo thời gian (t) được biểu diễn theo đồ thị sau:
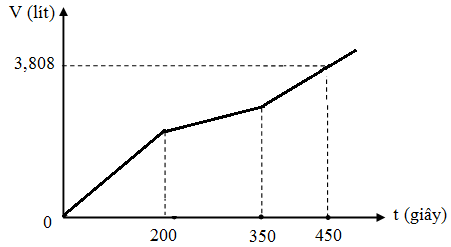
Nếu dừng điện phân ở thời điểm 250 giây rồi đem nhúng thanh nhôm (dư) vào dung dịch, sau khi phản ứng hoàn toàn, khối lượng thanh nhôm thay đổi như thế nào?
 Xem đáp án
Xem đáp án
Chọn A
Tại thời điểm t = 200 (s): chỉ có khí Cl2 (x mol) tại anot Þ ne (1) = 2x mol
Tại thời điểm t = 350 (s): có khí Cl2 (x mol) và O2 Þ ne (2) = 3,5x mol nCu = 1,75x
Tại thời điểm t = 450 (s): có khí Cl2 (x mol), O2, H2 Þ ne (3) = 4,5x mol n
Tại thời điểm t = 250 (s) Þ ne = 0,2 mol Þ
Dung dịch Y có chứa H+ (0,04 mol); Cu2+ (0,04 mol)
Khi cho Y tác dụng với Al thì: mAl tăng
Câu 31:
Tiến hành điện phân dung dịch chứa a mol KCl và b mol CuSO4 với điện cực trơ, màng ngăn xốp; cường độ dòng điện không đổi I = 7,5A, trong thời gian t = 4632 giây, thu được dung dịch X; đồng thời ở anot thoát ra 0,12 mol hỗn hợp khí. Nếu thời gian điện phân là 1,5t giây thì tổng số mol khí thoát ra ở hai cực là 0,215 mol. Giả sử trong quá trình điện phân nước bay hơi không đáng kể, hiệu suất điện phân đạt 100%, các khí sinh ra không tan trong nước, bỏ qua sự thủy phân của muối. Cho các phát biểu liên quan đến bài toán:
(a) Tổng khối lượng hai muối trước điện phân là 35,48 gam.
(b) Nếu thời gian điện phân là 1,25t giây thì nước đã điện phân ở cả hai điện cực.
(c) Giá trị của a, b lần lượt là 0,12 và 0,25.
(d) Dung dịch X chỉ có hai chất tan.
(e) Đến thời điểm 1,5t giây, số mol H+ sinh ra ở anot là 0,32 mol.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
Chọn B.
Tại thời điểm t = 4632 giây ta có: ne = 0,36 mol
+ Khí thoát ra ở anot là Cl2 và O2 với
Tại thời điểm t = 6948 giây ta có: ne = 0,54 mol
+ Khí thoát ra ở anot là Cl2 (0,06 mol) và
và khí ở catot H2 với = nkhí cả 2 điện cực – nkhí ở anot = 0,05 mol b = 0,22 mol
(a) Sai, Tổng khối lượng hai muối trước điện phân là 44,14 gam.
(b) Đúng, Tại thời điểm t = 5790 giây ta có: ne = 0,45 mol mà nên tại thời gian này thì nước đã điện phân ở cả 2 điện cực.
(c) Sai, Giá trị của b là 0,22.
(d) Sai, Dung dịch X chứa 3 chất tan K2SO4, H2SO4 và CuSO4 dư.
(e) Sai, Đến thời điểm 6948 giây, số mol H+ sinh ra ở anot là 0,42 mol.
Câu 32:
Điện phân 1 lít dung dịch X gồm Cu(NO3)2 0,6M và FeCl3 0,4M đến khi anot thoát ra 17,92 lít khí (đktc) thì dừng lại. Lấy catot ra khỏi bình điện phân, khuấy đều dung dịch để phản ứng xẩy ra hoàn toàn thì thu được dung dịch Y. Giả thiết kim loại sinh ra đều bám lên catot, sản phẩm khử của N+5 (nếu có) là NO duy nhất. Giá trị (mX - mY) gần nhất là
 Xem đáp án
Xem đáp án
Chọn A.
Tại anot có khí Cl2 và O2 thoát ra với
Tại catot lúc này có:
Dung dịch còn lại sau khi lấy catot ra khỏi bình điện phân chứa Fe2+ dư (0,2 mol); H+ (0,8 mol); NO3– (1,2 mol), lúc này tiếp tục xảy ra phản ứng oxi hóa khử nên = 0,8 – = 8/15 mol
Dung dịch Y chứa Fe3+ (0,2 mol); H+ dư (8/15 mol) và NO3– (1,2 mol). Vậy ()
Câu 33:
Tiến hành điện phân dung dịch X chứa hỗn hợp CuSO4 và KCl (điện cực trơ, màng ngăn xốp) với cường độ dòng điện không đổi thu được kết quả như bảng sau:
|
Thời gian điện phân (giây) |
Tổng số chất khí thoát ra ở hai điện cực |
Tổng thể tích khí thoát ra ở hai điện cực (lít) |
|
t |
1 |
1,344 |
|
2t |
2 |
2,24 |
|
3t |
x |
V |
|
4t |
3 |
5,152 |
Giả sử hiệu suất của phản ứng điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn B.
Tại thời điểm t (s) có khí Cl2 (0,06 mol) Þ ne (1) = 0,12 mol
Tại thời điểm 2t (s) có 2 khí Cl2 (x mol) và O2 (y mol) Þ
Tại thời điểm 4t (s) có 3 khí H2 (a mol); Cl2 (0,08 mol) và O2 (b mol) Þ ne (4) = 0,48 mol
Tại thời điểm 3t (s) Þ ne (3) = 0,36 mol có
Câu 34:
Tiến hành điện phân dung dịch chứa 0,25 mol Cu(NO3)2 và 0,18 mol NaCl bằng điện cực trơ, màng ngăn xốp với cường độ dòng điện không đổi tới khi khối lượng dung dịch giảm 21,75 gam thì dừng điện phân. Cho m gam bột Fe vào dung dịch sau điện phân, kết thúc phản ứng, thấy thoát ra khí NO (sản phẩm khử duy nhất) và còn lại 0,75m gam chất rắn không tan. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn A
Ta có . Các quá trình điện phân diễn ra như sau:
|
Tại catot |
Tại anot |
|
Cu2+ + 2e → Cu a mol 2a mol → a mol
|
2Cl- → Cl2 + 2e 0,18 mol 0,09 mol 0,18 mol H2O → 4H+ + O2 + 4e 4b mol ← b mol → 4b mol |
Xét khối lượng giảm sau điện phân ta có:
Dung dịch sau điện phân chứa: Na+, H+ (0,24 mol) và NO3- (0,5 mol) và Cu2+ (0,04 mol)
Khi cho dung dịch sau điện phân tác dụng với Fe dư thì:
Câu 35:
Điện phân dung dịch X gồm FeCl2 và MgCl2 (có màng ngăn), sự phụ thuộc khối lượng của dung dịch X theo thời gian được biểu diễn theo đồ thị sau:
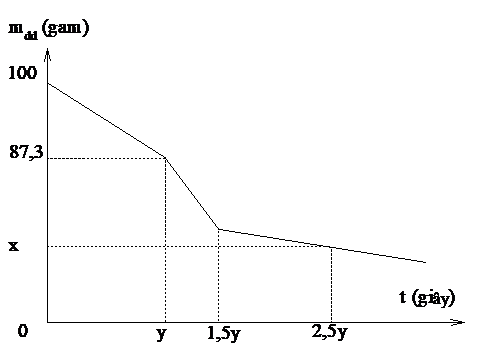
Giá trị x là
 Xem đáp án
Xem đáp án
Chọn B.
Xét đoạn (100 – 87,3): FeCl2 điện phân hết Þ
Xét đoạn (y – 1,5y): MgCl2 điện phân hết (MgCl2 + 2H2O ® Mg(OH)2 + Cl2 + H2)
Xét đoạn (1,5y – 2,5y): H2O điện phân (2H2O ® H2 + O2)
Câu 36:
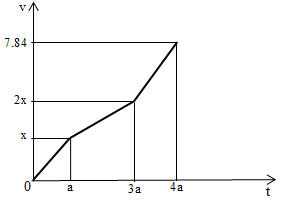
Điện phân dung dịch X chứa Cu(NO3)2 và NaCl với điện cực trơ thấy thể tích khí thoát ra ở cả 2 điện cực (V lít) và thời gian điện phân (t giây) phụ thuộc nhau như trên đồ thị bên.
Nếu điện phân dung dịch trong thời gian 2,5a giây rồi cho dung dịch sau điện phân tác dụng với lượng Fe dư (NO là sản phẩm khử duy nhất của N+5) thì lượng Fe tối đa đã phản ứng có giá trị gần nhất là
 Xem đáp án
Xem đáp án
Chọn D.
Tại t = a (s) : có khí Cl2 thoát ra tại anot Þ
(đặt b = x/22,4)
Tại t = 3a (s) : có khí Cl2, O2 thoát ra tại anot mà
Tại t = 4a (s) : có khí Cl2, O2 thoát ra tại anot và khí H2 thoát ra tại catot.
Thay (2) thay vào (1): x = 2,24.
Tại t = 2,5a (s) : có khí Cl2 (0,1 mol), O2 thoát ra tại anot và tại có Cu
Khi cho Fe tác dụng với dung dịch sau điện phân thì:
Câu 37:
Điện phân dung dịch chứa đồng thời NaCl và CuSO4 (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan các khí trong nước và sự bay hơi nước) với cường độ dòng điện không đổi. Kết quả của thí nghiệm ghi ở bảng sau:
|
Thời gian điện phân (giây) |
Khối lượng catot tăng (gam) |
Khí thoát ra ở anot |
Khối lượng dung dịch sau điện phân giảm (gam) |
|
t1 = 965 |
m |
Một khí |
2,70 |
|
t2 = 3860 |
4m |
Hỗn hợp khí |
9,15 |
|
t3 |
5m |
Hỗn hợp khí |
11,11 |
Tỷ lệ t3 : t1 có giá trị là
 Xem đáp án
Xem đáp án
Chọn A.
Tại t1 = 965s
Tại t2 = 3860s Þ ne = 0,16 mol Þ có khí Cl2 (x mol) và O2 (y mol).
Tại t3 (s) Þ 5m = 6,4 = mCu Þ Ở catot có khí H2 (a mol) và ở anot có khí Cl2 (0,05 mol); O2 (b mol)
mà mdd giảm = 11,11 = 6,4 + 0,05.71 + 2a + 32b (1) và 2a + 0,1.2 = 4b + 0,05.2 (2)
Giải hệ (1), (2) suy ra: a = 0,02 ; b = 0,035 Þ ne = 0,24 mol Þ t3 = 11580s. Vậy t3 : t1 = 12.
Câu 38:
Điện phân (điện cực trơ, màng ngăn xốp, cường độ dòng điện không đổi) V lít dung dịch X chứa đồng thời R(NO3)2 0,45M (R là kim loại hóa trị không đổi) và NaCl 0,4M trong thời gian t giây, thu được 0,3 mol hỗn hợp khí ở anot. Nếu thời gian điện phân là 2t giây thì thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 400 ml dung dịch chứa KOH 0,75M và NaOH 1 M, không sinh ra kết tủa. Biết hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của V gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn A.
+ Tại thời điểm t (s): Anot có hai khí thoát ra là Cl2 (0,2V mol) và O2 (x mol)
với 0,2V + x = 0,3 (1) và
+ Tại thời điểm 2t (s):
Anot: có hai khí thoát ra là Cl2 (0,2V mol) và O2 với
Catot: Cu2+ đã điện phân hết và H2O đã điện phận tại catot sinh ra khí H2 (y mol)
Dung dịch sau điện phân trung hoà với được với bazơ Þ
Ta có: = + 0,5 = Þ 2y + 0,5 = 4.(0,1V + 2x) (3)
Từ (1), (2), (3) ta suy ra: V = 1 lít.
Câu 39:
Tiến hành điện phân dung dịch chứa a mol CuSO4 và b mol NaCl bằng dòng điện một chiều có cường độ 2A (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước). Gọi V là tổng thể tích khí (đktc) thoát ra ở cả hai điện cực. Quá trình điện phân được mô tả theo đồ thị sau:
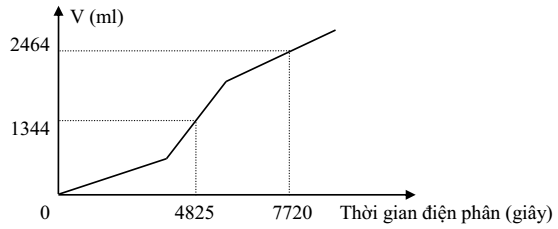
Tỉ lệ a : b là
 Xem đáp án
Xem đáp án
Chọn A.
Tại t = 4825 (s) Þ ne = 0,1 mol
Tại t = 7720 (s) Þ ne = 0,16 mol Þ Tại anot Cl2 (x) và O2 (y) còn catot Cu (0,04) và H2 (z)
Câu 40:
Hòa tan hoàn toàn hỗn hợp gồm CuSO4 và KCl vào H2O, thu được dung dịch X. Điện phân X (có màng ngăn, điện cực trơ, hiệu suất điện phân là 100%) với cường độ dòng điện I = 2A. Sau thời gian t giây, H2O bắt đầu điện phân ở cả hai điện cực thì dừng điện phân, thu được hỗn hợp khí Z (thu được từ cả hai điện cực) có tỉ khối so với H2 là 28,6 và dung dịch Y. Biết Y hòa tan tối đa 5,4 gam Al. Giá trị của t là
 Xem đáp án
Xem đáp án
Chọn C.
Dung dịch Y có chứa OH- Þ
Khí thoát ra ở cả 2 điện cực là H2 và Cl2 với M = 57,2 Þ
Câu 41:
Tiến hành điện phân V lít dung dịch chứa Cu(NO3)2 1M và NaCl 0,5M (điện cực trơ) đến khi khối lượng dung dịch giảm m gam thì dừng điện phân. Cho 9,5 gam Fe vào dung dịch sau điện phân, kết thúc phản ứng thu được 1,12 lít khí NO thoát ra (sản phẩm khử duy nhất) và còn lại 5,7 gam hỗn hợp rắn không tan. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn A.
Khi cho Fe tác dụng với Y thì hỗn hợp rắn gồm Cu và Fe dư.
với nFe pư =
và . Dung dịch Y gồm Cu2+ (0,05); H+ (0,2); Na+ (0,5V) và NO3- (2V)
V = 0,2. Dung dịch ban đầu gồm Cu(NO3)2 (0,2 mol) và NaCl (0,1 mol)
Khối lượng dung dịch giảm: m = 64.(0,2 - 0,05) + 71.0,05 + 32.0,05 = 14,75 (g)
Câu 42:
Điện phân dung dịch X chứa 0,3 mol NaCl và x mol Cu(NO3)2 với điện cực trơ, màng ngăn xốp, sau một thời gian thu được dung dịch Y có khối lượng giảm 28,25 gam so với dung dịch X (lượng nước bay hơi không đáng kể). Cho thanh sắt vào dung dịch Y đến khi các phản ứng xảy ra hoàn toàn, thấy khối lượng thanh sắt giảm 3 gam và thoát ra khí NO (sản phẩm khử duy nhất của N+5). Giá trị của x là
 Xem đáp án
Xem đáp án
Chọn A.
Khí thoát ra tại anot gồm Cl2 (0,15 mol)
và O2 (a mol).
Þ mdd giảm =
64.(0,15 + 2a) + 71.0,15 + 32a = 28,25
Þ a = 0,05.
Dung dịch X gồm NaNO3, HNO3
(4a = 0,2 mol) và Cu(NO3)2 dư (x – 0,25 mol).
Khi cho Fe vào dung dịch X thì:
3Fe + 8HNO3 ® 3Fe(NO3)2 + 2NO + 4H2O ,
Fe + Cu(NO3)2 ® Fe(NO3)2 + Cu (2) , Dmtăng (2) = (64 – 56).(x – 0,25) = 8x – 2 (g)
Theo đề: 4,2 – (8x – 2) = 3 Þ x = 0,4
