ĐGNL ĐH Bách khoa - Vấn đề thuộc lĩnh vực hóa học - Alknene
-
1405 lượt thi
-
32 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Trả lời:
Các đồng phân anken của C4H8
1. CH3-CH2-CH=CH2
2,3. CH3-CH=CH-CH3 (có đphh)
4. (CH3)2C=CH2
Đáp án cần chọn là: B
Câu 2:
 Xem đáp án
Xem đáp án
Trả lời:
Các đồng phân cấu tạo mạch hở của C5H10 là (không xét đphh)
1. C=C-C-C-C
2. C-C=C-C-C
3. C=C(C)-C-C
4. (C)2C=C-C
5. (C)2C-C=C
Đáp án cần chọn là: B
Câu 3:
Cho các chất sau:
CH2=CH–CH2–CH2–CH=CH2;
CH2=CH–CH=CH–CH2–CH3;
CH3–C(CH3)=CH–CH3;
CH2=CH–CH2–CH=CH2;
CH3–CH2–CH=CH–CH2–CH3;
CH3–C(CH3)=CH–CH3–CH3;
CH3–CH2–C(CH3)=C(C2H5)–CH(CH3)2;
CH3-CH=CH-CH3.
Số chất có đồng phân hình học là
 Xem đáp án
Xem đáp án
Trả lời:
Những chất có đồng phân hình học là
CH2=CH–CH=CH–CH2–CH3;
CH3–CH2–CH=CH–CH2–CH3;
CH3-CH=CH-CH3;
CH3–CH2–C(CH3)=C(C2H5)–CH(CH3)2.
Đáp án cần chọn là: A
Câu 4:
 Xem đáp án
Xem đáp án
Trả lời:
Số đồng phân anken bao gồm đồng phân cấu tạo và đồng phân hình học
Các đồng phân cấu tạo mạch hở của C5H10 là:
CH2=CH-CH2-CH2-CH3
CH3-CH=CH-CH2-CH3 (có đphh)
CH2=CH(CH3)-CH2-CH3
(CH3)2C=CH-CH3
(CH3)2CH-CH=CH2
=>C5H10 có 6 đồng phân anken
Đáp án cần chọn là: C
Câu 5:
(1) Anken là hiđrocacbon mà phân tử có chứa 1 liên kết đôi C=C.
(2) Những hiđrocacbon có công thức phân tử là CnH2n là anken.
(3) Anken là hiđrocacbon không no, mạch hở có CTPT CnH2n.
(4) Anken là hiđrocacbon mạch hở có chứa 1 liên kết đôi C=C, còn lại là liên kết đơn.
Những phát biểu đúng là
 Xem đáp án
Xem đáp án
Trả lời:
(1) sai vì nếu phân tử có chứa vòng hoặc liên kết 3 thì không được gọi là anken
(2) sai vì CnH2n có thể là xicloankan
Những phát biểu đúng là
(3) Anken là hiđrocacbon không no, mạch hở có CTPT CnH2n.
(4) Anken là hiđrocacbon mạch hở có chứa 1 liên kết đôi C=C, còn lại là liên kết đơn.
Đáp án cần chọn là: C
Câu 6:
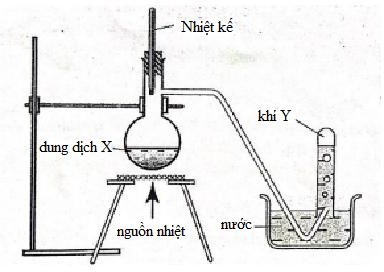
X có thể chứa
 Xem đáp án
Xem đáp án
Trả lời:
Khí Y điều chế bằng phương pháp đẩy nước → Y không tan hoặc ít tan trong nước
A. 2KMnO4 + 16HCl đặc 2KCl + 2MnCl2 + 5Cl2 + 8H2O
→ loại vì Cl2 phản ứng với nước.
B. Không có pư
C. NH4Cl + NaOH → NH3↑ + NaCl + H2O
→ loại vì NH3 tan nhiều trong nước.
D. C2H5OH \[\mathop \to \limits^{{H_2}S{O_4}d,t^\circ } \]C2H4 + H2O
→ chọn vì C2H4 không tan trong nước và không có pư với H2O
Đáp án cần chọn là: D
Câu 7:
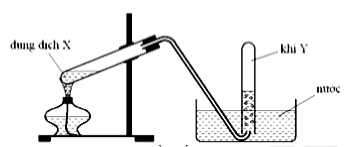
Hình vẽ trên mô tả thí nghiệm điều chế khí nào sau đây ?
 Xem đáp án
Xem đáp án
Trả lời:
C2H5OH \[\mathop \to \limits^{{H_2}S{O_4}d,t^\circ } \]C2H4 + H2O
→ chọn vì C2H4 không tan trong nước và không phản ứng với H2O
Đáp án cần chọn là: C
Câu 8:
 Xem đáp án
Xem đáp án
Trả lời:
nCO2 = 0,1 mol; nH2O = 0,14 mol
Vì đốt cháy hỗn hợp X gồm ankan CH4 và 2 anken C3H6 và C4H8
=>nCH4 = nH2O – nCO2 = 0,14 – 0,1 = 0,04 mol
Bảo toàn C và H: nC (trong X) = nCO2 = 0,1 mol; nH (trong X) = 2.nH2O = 0,28 mol
=>mX = mC + mH = 0,1.12 + 0,28 = 1,48 gam
%mCH4 = 0,04.16 / 1,48 .100% = 43,24%
Đáp án cần chọn là: C
Câu 9:
 Xem đáp án
Xem đáp án
Trả lời:
nCO2 = 1,54 mol; nH2O = 1,58 mol
Ta có: nCH4 = nH2O – nCO2 = 1,58 – 1,54 = 0,04 mol
=>n2 anken = 0,44 – 0,04 = 0,4 mol
Bảo toàn C: nCO2 sinh ra bởi CH4 = nCH4 = 0,04 mol =>nCO2 sinh ra bởi anken = 1,54 – 0,04 = 1,5 mol
=>số C trung bình = nCO2 / nanken = 1,5 / 0,4 = 3,75
=>2 anken là C3H6 và C4H8
Đáp án cần chọn là: B
Câu 10:
Hỗn hợp X gồm 1 ankan và 1 anken. Tỉ khối của X so với H2 là 11,25. Đốt cháy hoàn toàn 4,48 lít X thu được 6,72 lít CO2 (các thể tích khí đo ở đktc). Công thức của ankan và anken lần lượt là
 Xem đáp án
Xem đáp án
Trả lời:
Bước 1: Xác định ankan trong X
\[{n_X} = \frac{{4,48}}{{22,4}} = 0,2\left( {mol} \right)\]
\[{n_{C{O_2}}} = \frac{{6,72}}{{22,4}} = 0,3\left( {mol} \right)\]
\[\overline C = \frac{{{n_{C{O_2}}}}}{{{n_X}}} = \frac{{0,3}}{{0,2}} = 1,5\]
→ Ankan phải là CH4.
Bước 2: Tính số mol của ankan, anken, số nguyên tử C của anken
Đặt
\[\left\{ {\begin{array}{*{20}{c}}{C{H_4}:{a^{mol}}}\\{{C_n}{H_{2n}}:{b^{mol}}}\end{array}} \right.\]
\[ \to \left\{ {\begin{array}{*{20}{c}}{{n_X} = a + b = 0,2\,\,(1)}\\{{n_{C{O_2}}} = a + nb = 0,3\,\,(2)}\\{{{\overline M }_X} = \frac{{16a + 14nb}}{{0,2}} = 11,25.2 = 22,5\,\,(3)}\end{array}} \right.\]
Giải hệ (1) (2) và (3) → a = 0,15; b = 0,05 và nb = 0,15 → n = 3.
Bước 3: Xác định ankan, anken
Vậy hỗn hợp chứa CH4 và C3H6.
Đáp án cần chọn là: D
Câu 11:
(1) CH4 + O2 \[\mathop \to \limits^{xt,t^\circ } \]CH2O + H2O
(2) 2C4H10 + 5O2 \[\mathop \to \limits^{xt,t^\circ } \]4C2H4O2 + 2H2O
(3) 2C2H6 + 12O2 \[\mathop \to \limits^{xt,t^\circ } \]3C + 9CO2 + 6H2O
(4) C3H8 + 5O2 \[\mathop \to \limits^{xt,t^\circ } \]3CO2 + 4H2O
Số phản ứng thuộc loại phản ứng oxi hóa không hoàn toàn là
 Xem đáp án
Xem đáp án
Trả lời:
Các phản ứng oxi hóa không hoàn toàn là (1), (2) và (3) vì số oxi hóa của C trong sản phẩm chưa đạt tối đa
Đáp án cần chọn là: A
Câu 12:
 Xem đáp án
Xem đáp án
Trả lời:
Các anken phản ứng được với dung dịch KMnO4 ở ngay điều kiện thường
=>hex-1-en, etilen, propen
Đáp án cần chọn là: B
Câu 13:
Đốt cháy hoàn toàn 0,1 mol anken X thu được CO2 và hơi nước. Hấp thụ toàn bộ sản phẩm cháy bằng 100 gam dung dịch NaOH 21,62% thu được dung dịch mới trong đó nồng độ của NaOH chỉ còn 5%. Công thức phân tử đúng của X là
 Xem đáp án
Xem đáp án
Trả lời:
Gọi công thức của anken là CnH2n
Khi đốt cháy: nCO2 = nH2O = 0,1 n (mol)
nNaOH = 0,5405 mol
n NaOH p/u = 0,1n . 2 = 0,2n mol
=>n NaOH dư = 0,5405 – 0,2n (mol)
m dd sau phản ứng = m CO2 + m H2O + m dd NaOH = 6,2n + 100 (gam)
Ta có:
\[\frac{{\left( {0,5405 - 0,2n} \right).40}}{{6,2n + 100}} = \frac{5}{{100}} \to n = 2\]
CTPT của X là C2H4
Đáp án cần chọn là: A
Câu 14:
Một hỗn hợp A gồm hai hiđrocacbon X, Y liên tiếp nhau trong cùng dãy đồng đẳng. Đốt cháy 11,2 lít hỗn hợp X thu được 57,2 gam CO2 và 23,4 gam H2O. Công thức phân tử của X, Y và khối lượng của X, Y là
 Xem đáp án
Xem đáp án
Trả lời:
nCO2 = nH2O = 1,3 mol
=>Gọi công thức của 2 hiđrocacbon là: \[{C_{\overline n }}{H_{\overline {2n} }}\]
\[\overline n = \frac{{{n_{C{O_2}}}}}{{{n_{hh}}}} = \frac{{1,3}}{{0,5}} = 2,6\]
=>CTPT của 2 chất là C2H4 và C3H6
Gọi số mol C2H4 và C3H6 là a, b (mol)
Ta có:

Đáp án cần chọn là: C
Câu 15:
Đốt cháy hoàn toàn 0,1 mol anken X thu được CO2 và hơi nước. Hấp thụ hoàn toàn sản phẩm bằng 100 gam dung dịch NaOH 21,62% thu được dung dịch mới trong đó nồng độ của NaOH chỉ còn 5%. Công thức phân tử đúng của X là
 Xem đáp án
Xem đáp án
Trả lời:
Gọi công thức của anken là CnH2n
Khi đốt cháy: nCO2 = nH2O = 0,1 n (mol)
nNaOH = 0,5405 mol
n NaOH p/u = 0,1n . 2 = 0,2n mol
=>n NaOH dư = 0,5405 – 0,2n (mol)
m dd sau phản ứng = m CO2 + m H2O + m dd NaOH = 6,2 n + 100 (gam)
Ta có:
\[\frac{{\left( {0,5405 - 0,2n} \right).40}}{{6,2n + 100}} = \frac{5}{{100}} \to n = 2\]
CTPT của X là C2H4
Đáp án cần chọn là: A
Câu 16:
 Xem đáp án
Xem đáp án
Trả lời:
Xiclobutan cộng H2 mở vòng tạo butan
2-metylpropen cộng H2 tạo thành 2-metylpropan
but-1-en cộng H2 tạo thành butan
cis-but-2-en cộng H2 tạo thành butan
2-metylbut-2-en cộng H2 tạp thành 2-metylbutan
=>Dãy các chất cộng H2 cho cùng 1 sản phẩm là: xiclobutan, but-1-en, cis-but-2-en
Đáp án cần chọn là: A
Câu 17:
 Xem đáp án
Xem đáp án
Trả lời:
Hexan không tan trong nước và không phản ứng với dung dịch brom
Hex-1-en không tan trong nước và phản ứng được với dung dịch brom =>làm mất màu dung dịch
Đáp án cần chọn là: D
Câu 18:
 Xem đáp án
Xem đáp án
Trả lời:
Theo bài ra, tổng số mol 2 anken là 0,15, tổng khối lượng là 7,7
Đặt phân tử khối trung bình của anken là X, dễ dàng có X = 7,7 : 0,15 = 51,33
=>C3H6 và C4H8
Đặt số mol 2 chất lần lượt là a và b, ta có:
a + b = 0,15 và 42a + 56b = 7,7
=>a = 0,05 và b = 0,1
\[ \Rightarrow \% {V_{{C_3}{H_6}}} = \frac{{0,05}}{{0,05 + 0,1}}.100\% = 33,33\% ;\% {V_{{C_4}{H_8}}} = 66,67\% \]
Đáp án cần chọn là: C
Câu 19:
 Xem đáp án
Xem đáp án
Trả lời:
Do dẫn qua Brom dư nên =>anken bị giữ lại, thể tích còn lại 1/2
=>Vanken = Vankan =>nA = nB và %Vankan = %Vanken = 50%
Khối lượng Y bằng 15/29 khối lượng X =>29.mY = 15.mX
=>29.nA.MA = 15.(nA.MA + nB.MB)
=>14.MA = 15.MB
=>MA = 30 (C2H6)
MB = 28 (C2H4)
Đáp án cần chọn là: D
Câu 20:
Hỗn hợp khí X gồm 1 ankan và 1 anken. Cho 1,68 lit khí X cho qua dung dịch brom làm mất màu vừa đủ dung dịch chứa brom thấy còn lại 1,12 lit khí. Mặt khác nếu đốt cháy hoàn toàn 1,68 lit khí X rồi cho sản phẩm cháy đi qua bình đựng dung dịch nước vôi trong dư thu được 12,5 gam kết tủa. Công thức phân tử của các hiđrocacbon lần lượt là:
 Xem đáp án
Xem đáp án
Trả lời:
Theo bài ra ta có nhỗn hợp = 0,075 mol =>nankan = 0,05 mol => nanken = 0,025 mol
nCaCO3 = 0,125 = nCO2 => ¯¯¯nn¯= 0,125 / 0,075 = 1,67 =>Ankan là CH4
\[ \Rightarrow n = \frac{{0,125 - 0,05.1}}{{0,025}} = 3\]
=>anken là C3H6
Đáp án cần chọn là: B
Câu 21:
Cho hỗn hợp X gồm etilen và H2 có tỉ khối so với H2 bằng 4,25. Dẫn X qua bột niken nung nóng (hiệu suất phản ứng 75%) thu được hỗn hợp Y. Tỉ khối của Y so với H2 (các thể tích đo ở cùng điều kiện) là
 Xem đáp án
Xem đáp án
Trả lời:
Giả sử lấy 1 mol hỗn hợp X. Gọi nC2H4 = x mol; nH2 = y mol
=>x + y = 1 (1)
\[{\overline M _X} = \frac{{28x + 2y}}{{x + y}} = 4,25.2(2)\]
Từ (1) và (2) =>x = 0,25 mol; y = 0,75 mol
C2H4 + H2 → C2H6
=>hiệu suất phản ứng tính theo C2H4
=>nC2H4 phản ứng = nhỗn hợp khí giảm = 0,25.0,75 = 0,1875 mol
=>nY = 1 – 0,1875 = 0,8125 mol
Áp dụng công thức:
\[\frac{{{{\overline M }_X}}}{{{{\overline M }_Y}}} = \frac{{{n_Y}}}{{{n_X}}} \Rightarrow {\overline M _Y} = \frac{{{n_X}.{{\overline M }_X}}}{{{n_Y}}} = \frac{{1.8,5}}{{0,8125}} = 10,46\]
\[ \Rightarrow {d_{Y/{H_2}}} = 5,23\]
Đáp án cần chọn là: A
Câu 22:
Hỗn hợp khí X gồm H2 và một anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất. Tỉ khối của X so với H2 bằng 9,1. Đun nóng X có xúc tác Ni, sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y không làm mất màu nước brom; tỉ khối của Y so với H2 bằng 13. Công thức cấu tạo của anken là:
 Xem đáp án
Xem đáp án
Trả lời:
Do anken + HBr cho 1 sản phẩm duy nhất
Quan sát đáp án
=>có A và D thỏa mãn vì anken đối xứng cộng HBr thu được sản phẩm duy nhất
=>anken hết, H2 dư =>Y có H2 và ankan
=>Mankan >26 (do MH2 < 26)
Gọi anken là CnH2n (n ≥ 2)
Đặt nX = 1 mol; do mX = m
\[ \Rightarrow \frac{{{n_X}}}{{{n_Y}}} = \frac{{{{\overline M }_X}}}{{{{\overline M }_Y}}}\]
\[ \Rightarrow {n_Y} = 1.\frac{{9,1.2}}{{26}} = 0,7mol\]
=>n = nX - nY = nanken = 1 – 0,7 = 0,3 mol =>nH2 (X) = 0,7
mX = 1.9,1.2 = mH2 + mX =>n = 4
Vậy anken là CH3CH=CHCH3
Đáp án cần chọn là: A
Câu 23:
Cho 4,48 lít hỗn hợp X gồm etan, propan và propen qua dung dịch brom dư, thấy khối lượng bình brom tăng 4,2 gam. Lượng khí còn lại thoát ra khỏi dung dịch đem đốt cháy hoàn toàn thu được 6,48 gam nước. Phần trăm thể tích các chất có trong hỗn hợp X lần lượt là
 Xem đáp án
Xem đáp án
Trả lời:
Khi cho hợp khí qua bình Brom chỉ có propen bị giữ lại
\[ \Rightarrow {m_{B{r_2} \uparrow }} = {m_{propen}} = 4,2gam\]
\[{n_{{C_3}{H_6}}} = \frac{{4,2}}{{42}} = 0,1mol\]
\[\% {V_{{C_3}{H_6}}} = \frac{{0,1}}{{0,2}}.100\% = 50\% \]
Gọi CTPT chung của etan và propan là: \[{C_{\overline n }}{H_{2\overline n + 2}}\]
\[{n_{{C_{\overline n }}{H_{2\overline n + 2}}}} = 0,1mol\]
\[{C_{\overline n }}{H_{2\overline n + 2}} + {O_2} \to \overline n C{O_2} + \left( {\overline n + 1} \right){H_2}O\]
\[{n_{{H_2}O}} = 0,1.\left( {\overline n + 1} \right) = 0,36\]
\[ \Rightarrow \overline n = 2,6\]
\[\frac{{{n_{{C_2}{H_6}}}}}{{{n_{{C_3}{H_8}}}}} = \frac{{3 - 2,6}}{{2,6 - 2}} = \frac{2}{3}\]
\[ \to {n_{{C_2}{H_6}}} = \frac{{2.0,1}}{5} = 0,04mol\]
\[ \to {n_{{C_3}{H_8}}} = \frac{{3.0,1}}{5} = 0,06mol\]
\[\% {V_{{C_2}{H_6}}} = \frac{{0,04}}{{0,2}}.100\% = 20\% \]
\[\% {V_{{C_3}{H_8}}} = \frac{{0,06}}{{0,2}}.100\% = 30\% \]
Đáp án cần chọn là: A
Câu 24:
Biết 0,05 mol hiđrocacbon X mạch hở làm mất màu vừa đủ dung dịch chứa m gam brom cho ra sản phẩm có hàm lượng brom đạt 69,56%. Công thức phân tử của X và giá trị m lần lượt là
 Xem đáp án
Xem đáp án
Trả lời:
Bước 1: Viết PTHH, tính số mol của Br2
CTTQ hiđrocacbon là CnH2n+2-2k (với k là số liên kết π).
PTHH: CnH2n+2-2k + kBr2 → CnH2n+2-2kBr2k
(mol) 0,05 → 0,05k → 0,05
Bước 2: Lập biểu thức tính %mBr2, tìm CTPT của X
Theo đề bài %mBr = 69,56%
\[ \Rightarrow \frac{{80.2k}}{{14n + 2 + 158k}}.100 = 69,56\]
160k = 9,7384n + 1,3912 + 109,9048k
50,0952k = 9,7384n + 1,3912
36k = 7n + 1
k = 1; n = 5 thỏa mãn
CTPT của X là C5H10
Bước 3: Tính mBr2
mBr2 = 0,05.160 = 8 gam.
Đáp án cần chọn là: D
Câu 25:
 Xem đáp án
Xem đáp án
Trả lời:
Ứng dụng không phải của anken là: Nguyên liệu sản xuất vật liệu silicat.
Đáp án cần chọn là: D
Câu 26:
Thể tích monome (đktc) cần dùng để sản xuất 70 tấn PE (H = 80%) là
 Xem đáp án
Xem đáp án
Trả lời:
nCH2=CH2 → (-CH2-CH2-)n
mPE = 70 tấn =>mmonome theo lí thuyết = 70 tấn
=>mmonome thực tế = 70.100/80 = 87,5 tấn = 87,5.106 gam
=>nC2H4 = 3,125.106 mol =>V = 3,125.106.22,4 = 70.106 lít = 70000 m3
Đáp án cần chọn là: A
Câu 27:
Trùng hợp 60 kg propilen thu được m kg polime, biết H = 70%. Giá trị của m là
 Xem đáp án
Xem đáp án
Trả lời:
nCH2=CH-CH3 → (-CH2-CH(CH3)-)n
Theo lí thuyết: mpolime = mpropilen = 60 kg =>mpolime thực tế = 60.70/100 = 42 kg
Đáp án cần chọn là: A
Câu 28:
Cho hình vẽ mô tả thí nghiệm điều chế khí Z từu dung dịch X và chất rắn Y:
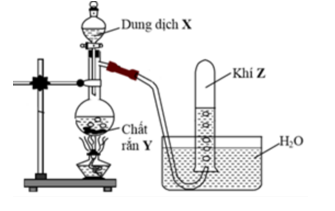
Hình vẽ bên minh họa cho phản ứng nào sau đây ?
 Xem đáp án
Xem đáp án
Trả lời:
A và B sai vì NH3 và HCl là những chất tan tốt trong nước nên không thu khí bằng phương pháp đẩy nước.
C sai vì C2H5OH không phải chất rắn.
D đúng. Chất rắn Y là Zn, dung dịch X là H2SO4 loãng, khí Z là H2 không tan trong nước.
Đáp án cần chọn là: D
Câu 29:
Trùng hợp hoàn toàn 56 lít khí CH3-CH=CH2 (đktc) thì thu được m gam polipropilen (nhựa PP). Giá trị của m là
 Xem đáp án
Xem đáp án
Trả lời:
\[{n_{propen}} = \frac{{56}}{{22,4}} = 2,5mol\]
\[nC{H_3} - CH = C{H_2} \to {\left( { - C{H_2} - CH\left( {C{H_3}} \right) - } \right)_n}\]
\[{n_{pp}} = \frac{{2,5}}{n}mol \to {m_{pp}} = \frac{{2,5}}{n}.42n = 105gam\]
Đáp án cần chọn là: C
Câu 30:
 Xem đáp án
Xem đáp án
Trả lời:
nCH2=CH2 → (-CH2-CH2-)n
Sản phẩm sau trùng hợp tsac dụng với dd Brom dư thì Etilen dư tác dụng với brom
\[ \to {n_{B{r_2}}} = {n_{{C_2}{H_4}}} = 0,225mol\]
\[ \to {n_{{C_2}{H_4}pu}} = 1 - 0,225 = 0,775mol\]
\[H = \frac{{{n_{pu}}}}{{{n_{bd}}}}.100\% = \frac{{0,775}}{1}.100\% = 77,5\% \]
\[{n_{PE}} = \frac{{{n_{{C_2}{H_4}pu}}}}{n} = \frac{{0,775}}{n}\]
\[ \to {m_{PE}} = \frac{{0,775}}{n}.28n = 21,7gam\]
Đáp án cần chọn là: B
Câu 31:
Đun nóng V (ml) ancol etylic 95o với H2SO4 đặc ở 170oC được 3,36 lít khí etilen (đktc). Biết hiệu suất phản ứng là 60% và ancol etylic nguyên chất có d = 0,8 g/ml. Giá trị của V (ml) là
 Xem đáp án
Xem đáp án
Trả lời:
H3C-CH2-OH\[\mathop \to \limits^{{H_2}S{O_{4d}},170^\circ C} \]CH2=CH2 + H2O
\[{n_{{C_2}{H_5}OH\left( {pu} \right)}} = {n_{{C_2}{H_4}}} = 0,15mol\]
\[{n_{{C_2}{H_5}OH\left( {pu} \right)}} = \frac{{0,15}}{{60\% }} = 0,25mol\]
Ta có
\[{n_{{C_2}{H_5}OH\left( {bd} \right)}} = \frac{{V.d.95}}{{100.46}}\]
\[ \to V = \frac{{{n_{{C_2}{H_5}OH\left( {bd} \right)}}.100.46}}{{95.d}} \approx 15,13\]
Đáp án cần chọn là: D
Câu 32:
Cho etan qua xúc tác (ở nhiệt độ cao) thu được một hỗn hợp X gồm etan, etilen, axetilen và H2. Tỷ khối của hỗn hợp X đối với etan là 0,4. Hãy cho biết nếu cho 0,4 mol hỗn hợp X qua dung dịch Br2 dư thì số mol Br2 đã phản ứng là bao nhiêu ?
 Xem đáp án
Xem đáp án
Trả lời:
C2H6 → C2H4 + H2
p/ ứng (mol) a a a
C2H6 → C2H2 + H2
p/ ứng (mol) b b b
hỗn hợp X gồm C2H6 dư (0,4-a-b) mol
C2H4 a mol; C2H2 b mol; H2 (a+b) mol
Ta có:
\[{d_{X/e\,\tan }} = 0,4 \to {M_X} = 12\]
\[\frac{{30}}{{0,4 + a + 2b}} = 12 \to a + 2b = 0,6\left( {mol} \right)\]
\[{n_{B{r_2}}} = {n_{{C_2}{H_4}}} + 2{n_{{C_2}{H_2}}} = a + 2b = 0,6\left( {mol} \right)\]
Đáp án cần chọn là: B
