Chromium và hợp chất của chromium
-
454 lượt thi
-
39 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Chọn phát biểu đúng về phản ứng của crom với phi kim:
 Xem đáp án
Xem đáp án
Trả lời:
B sai vì oxi phản ứng với crom tạo Cr2O3
C sai vì lưu huỳnh có phản ứng với crom ở nhiệt độ cao
D sai vì clo sẽ oxi hóa crom thành CrCl3
Đáp án cần chọn là: A
Câu 2:
Crom thể hiện số oxi hóa nào khi tác dụng với dung dịch HCl và H2SO4 loãng ?
 Xem đáp án
Xem đáp án
Trả lời:
Khi tác dụng với dung dịch HCl và H2SO4 loãng thì crom thể hiện số oxi hóa +2
Đáp án cần chọn là: A
Câu 3:
Nhận xét nào sau đây là không đúng ?
 Xem đáp án
Xem đáp án
Trả lời:
Al + 3HCl → AlCl3 + 3/2H2
Cr + 2HCl → CrCl2 + H2
Đáp án cần chọn là: C
Câu 4:
Điểm giống nhau giữa Al và Cr là
 Xem đáp án
Xem đáp án
Trả lời:
Điểm giống nhau giữa Al và Cr là cùng tác dụng với khí clo tạo ra muối có dạng MCl3.
Đáp án cần chọn là: C
Câu 5:
Dãy kim loại bị thụ động trong axit HNO3 đặc, nguội là
 Xem đáp án
Xem đáp án
Trả lời:
Dãy kim loại bị thụ động trong axit HNO3 đặc, nguội là Fe, Al, Cr.
Đáp án cần chọn là: A
Câu 6:
Phản ứng nào sau đây không đúng? (trong điều kiện thích hợp)
 Xem đáp án
Xem đáp án
Trả lời:
Phản ứng nào sau đây không đúng là 2Cr + 3H2SO4 → Cr2(SO4)3 + 3H2.
Vì Cr phản ứng với H2SO4 loãng sinh ra muối CrSO4 và khí H2
Đáp án cần chọn là: C
Câu 7:
Ứng dụng không phải của crom là
 Xem đáp án
Xem đáp án
Trả lời:
Ứng dụng không phải của crom là: Crom là kim loại nhẹ, nên được sử dụng tạo các hợp kim dùng trong ngành hàng không.
Đáp án cần chọn là: C
Câu 8:
Trong công nghiệp, từ quặng cromit (FeO.Cr2O3) người ta điều chế Cr bằng phương pháp nào sau đây?
 Xem đáp án
Xem đáp án
Trả lời:
Người ta điều chế Cr bằng phương pháp tách quặng rồi thực hiện phản ứng nhiệt nhôm Cr2O3.
Đáp án cần chọn là: B
Câu 9:
Hãy chỉ ra các câu đúng trong các câu sau:
Crom là kim loại có tính khử mạnh hơn Fe.
Crom là kim loại chỉ tạo được oxit bazơ.
Crom có những hợp chất giống với hợp chất giống những hợp chất của S.
Trong tự nhiên crom ở dạng đơn chất.
Phương pháp sản xuất crom là điện phân Cr2O3.
Crom có thể cắt được thủy tinh.
 Xem đáp án
Xem đáp án
Trả lời:
Những câu đúng là
1. Crom là kim loại có tính khử mạnh hơn Fe.
3. Crom có những hợp chất giống với hợp chất giống những hợp chất của S.
6. Crom có thể cắt được thủy tinh.
Đáp án cần chọn là: B
Câu 10:
Chọn phát biểu đúng:
 Xem đáp án
Xem đáp án
Trả lời:
A sai vì CrO không có tính lưỡng tính.
B đúng vì :
+ tính khử: 4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
+ tính bazơ: Cr(OH)2 + 2HCl → CrCl2 + 2H2O
Đáp án cần chọn là: B
Câu 11:
Chọn phát biểu đúng:
 Xem đáp án
Xem đáp án
Trả lời:
A và B sai vì:
- Trong môi trường axit, muối crom(III) có tính oxi hóa và dễ bị khử thành muối crom(II)
- Trong môi trường kiềm, muối crom(III) có tính khử
C sai vì ion Cr3+ không có tính lưỡng tính, chỉ có Cr(OH)3 và Cr2O3 có tính lưỡng tính
Đáp án cần chọn là: D
Câu 12:
Cho dãy các chất : SiO2, Cr(OH)3, CrO3, Zn(OH)2, NaHCO3, Al2O3. Số chất trong dãy tác dụng được với dung dịch NaOH (đặc, nóng) là
 Xem đáp án
Xem đáp án
Trả lời:
SiO2 + 2NaOH → Na2SiO3 + H2O
Cr(OH)3 + NaOH → Na[Cr(OH)4]
2NaOH + Zn(OH)2 → Na2[Zn(OH)4]
NaOH + NaHCO3 → Na2CO3 + H2O
CrO3 + 2NaOH → Na2CrO4 + H2O
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Đáp án cần chọn là: A
Câu 13:
Hiện tượng xảy ra khi nhỏ vài giọt dung dịch H2SO4 vào dung dịch Na2CrO4 là
 Xem đáp án
Xem đáp án
Trả lời:
2CrO42- + 2H+ ⇆ Cr2O72- + H2O
(màu vàng) (màu da cam)
Khi nhỏ từ từ dung dịch H2SO4 vào dung dịch Na2CrO4 thì cân bằng trên chuyển dịch sang phải
=>dung dịch chuyển từ màu vàng sang màu da cam
Đáp án cần chọn là: A
Câu 14:
Cho vào ống nghiệm một vài tinh thể K2Cr2O7, sau đó thêm tiếp khoảng 1 ml nước và lắc đều để K2Cr2O7 tan hết, thu được dung dịch X. Thêm vài giọt dung dịch KOH vào dung dịch X, thu được dung dịch Y. Màu sắc của dung dịch X và Y lần lượt là
 Xem đáp án
Xem đáp án
Trả lời:
Cr2O72- + 2OH- → 2CrO42- + H2O
màu da cam màu vàng
Khi nhỏ từ từ dung dịch KOH vào dung dịch K2Cr2O7 thì cân bằng trên chuyển dịch sang phải
=>dung dịch chuyển từ màu da cam sang màu vàng
Đáp án cần chọn là: A
Câu 15:
Cho phản ứng K2Cr2O7 + HCl → KCl + CrCl3 + Cl2 + H2O. Số phân tử HCl bị oxi hóa là
 Xem đáp án
Xem đáp án
Trả lời:
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
=>số phân tử HCl bị oxi hóa = số nguyên tử Cl tạo Cl2 = 6
Đáp án cần chọn là: B
Câu 16:
Phát biểu nào sau đây là sai ?
 Xem đáp án
Xem đáp án
Trả lời:
Phát biểu sai là: Trong môi trường axit, Zn khử Cr3+ thành Cr
Trong môi trường axit, muối crom(III) có tính oxi hóa và dễ bị khử thành muối crom(II)
Zn + 2Cr3+ → Zn2+ + 2Cr2+ =>B sai
A đúng
C đúng. Photpho bốc cháy khi tiếp xúc với CrO3: 10CrO3 + 6P → 3P2O5 + 5Cr2O3
D đúng. 3Br2 + 2CrO2- + 8OH- → 2CrO42- + 6Br- + 4H2O
Đáp án cần chọn là: B
Câu 17:
Dung dịch FeSO4 làm mất màu dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Trả lời:
Dung dịch FeSO4 có thể làm mất màu dung dịch KMnO4/H2SO4, K2Cr2O7/H2SO4, Br2
Đáp án cần chọn là: D
Câu 18:
Cho các phát biểu sau:
(1) Thêm lượng dư NaOH vào dung dịch K2Cr2O7 thì dung dịch chuyển từ màu da cam sang màu vàng.
(2) Thêm lượng dư NaOH và Cl2 vào dung dịch CrCl2 thì dung dịch từ màu xanh chuyển thành màu vàng.
(3) Thêm từ từ dung dịch NaOH vào dung dịch CrCl3 thấy xuất hiện kết tủa vàng nâu tan lại trong NaOH (dư).
(4) Thên từ từ dung dịch HCl vào dung dịch Na[Cr(OH)4] thấy xuất hiện kết tủa lục xám, sau đó tan lại.
Số câu đúng là
 Xem đáp án
Xem đáp án
Trả lời:
(1) đúng vì : Cr2O72- + 2OH- → 2CrO42- + H2O
màu da cam màu vàng
(2) đúng vì:
2CrCl2 + Cl2 → 2CrCl3
2CrCl3 + 3Cl2 + 16NaOH → 2Na2CrO4 + 12NaCl + 8H2O
(3) sai vì Cr(OH)3 là chất kết tủa màu lục xám
(4) đúng vì Na[Cr(OH)4] + HCl → Cr(OH)3 + NaCl + H2O
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
Đáp án cần chọn là: C
Câu 19:
Cho sơ đồ phản ứng:
\[Cr{O_3}\mathop \to \limits^{ + NaOH} X\mathop \to \limits^{ + {H_2}S{O_4}} Y\mathop \to \limits^{ + HCl} Z \to X\]
X, Y, Z là các hợp chất chứa crom. X, Y, Z lần lượt là:
 Xem đáp án
Xem đáp án
Trả lời:
X phải là Na2CrO4 (Cr6+) do đó loại A và D.
Ở cả ý B và C, Y đều là Na2Cr2O7 nên ta bỏ qua, xét Z:
Na2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O
Phải chọn Z sao cho từ Z điều chế lại được X là Na2Cr2O7 =>chỉ có thể là ý C, Z phải là CrCl3
Đáp án cần chọn là: C
Câu 20:
Cho chất X (CrO3) tác dụng với lượng dư NaOH, thu được hợp chất Y của crom. Đem chất Y cho tác dụng với dung dịch H2SO4 loãng, dư, thu được hợp chất Z của crom. Đem chất Z tác dụng với dung dịch HCl dư, thu được khí T. Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Trả lời:
CrO3 + 2NaOH → Na2CrO4 (Y)+ H2O
→ X có màu đỏ thẫm → C đúng
Y có màu vàng → D sai
2Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
→ Z là Na2Cr2O7 → A đúng
Z + HCl : Na2Cr2O7 + 14HCl → 2NaCl + 2CrCl3 + 7H2O + 3Cl2
→ khí T là Cl2 → B đúng
Đáp án cần chọn là: D
Câu 21:
Dung dịch trong nước của chất nào dưới đây có màu da cam?
 Xem đáp án
Xem đáp án
Trả lời:
A. dung dịch K2Cr2O7 có màu da cam
B. dung dich KCl không có màu
C. dung dich K2CrO4 có màu vàng.
D. dung dich KMnO4 có màu tím
Đáp án cần chọn là: A
Câu 22:
Trong công nghiệp kim loại Cr được điều chế bằng phương pháp nào sau đây?
 Xem đáp án
Xem đáp án
Trả lời:
Trong công nghiệp, Cr được điều chế bằng phương pháp nhiệt nhôm
Cr2O3 + 2Al \[\mathop \to \limits^{t^\circ } \] Cr + Al2O3
Phương pháp này điều chế được Cr có độ tinh khiết từ 97-99%
Đáp án cần chọn là: B
Câu 23:
Hòa tan hết 2,16 gam hỗn hợp Cr và Fe trong dung dịch HCl (loãng), nóng thu được 896 ml khí ở đktc. Lượng crom có trong hỗn hợp là
 Xem đáp án
Xem đáp án
Trả lời:
nH2 = 0,04 (mol)
Gọi số mol của Cr và Fe lần lượt là x, y:
=>52x + 56y = 2,16 (1)
Bảo toàn e: nCr + nFe = nH2 =>x + y = 0,04 (2)
Từ (1) và (2) có:
\[\left\{ {\begin{array}{*{20}{c}}{52x + 56y = 2,16}\\{x + y = 0,04}\end{array}} \right. \Rightarrow \left\{ {\begin{array}{*{20}{c}}{x = 0,02}\\{y = 0,02}\end{array}} \right.\]
=>mCr = 0,02.52 = 1,04 (g)
Đáp án cần chọn là: B
Câu 24:
Cho m gam phèn crom-kali (KCr(SO4)2.12H2O) hoà tan hết vào nước được dung dịch X. Khử hết X cần vừa đủ 0,78 gam bột Zn. Giá trị của m là
 Xem đáp án
Xem đáp án
Trả lời:
M gam phèn KCr(SO4)2.12H2O đem khử bằng 0,012 mol Zn :
2Cr3+ + Zn → 2Cr2+ + Zn2+
0,024 ← 0,012
=>m = 0,024.499 = 11,976 gam
Đáp án cần chọn là: B
Câu 25:
Cho 13,5 gam hỗn hợp các kim loại Al, Cr, Fe tác dụng với lượng dư dung dịch H2SO4 loãng nóng (trong điều kiện không có không khí) thu được dung dịch X và 7,84 lít khí H2 (đktc). Cô cạn dung dịch X (trong điều kiện không có không khí) thu được m gam muối khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Trả lời:
Định luật bảo toàn nguyên tử:
\[{n_{{H_2}}} = 0,35\left( {mol} \right) = {n_{{H_2}S{O_4}}} \to {m_{{H_2}}} = 0,7\left( {gam} \right)\]
\[ \to {m_{{H_2}S{O_4}}} = 34,3\left( {gam} \right)\]
Bảo toàn khối lượng:
Ta có: mMuối = 13,5 + 34,3 – 0,7 = 47,1 (gam)
Đáp án cần chọn là: D
Câu 26:
Thêm 0,02 mol NaOH vào dung dịch chứa 0,01 mol CrCl2 rồi để trong không khí đến phản ứng hoàn toàn. Khối lượng kết tủa thu được là
 Xem đáp án
Xem đáp án
Trả lời:
2NaOH + CrCl2 → Cr(OH)2 + 2KCl
0,02 0,01 0,01
=>nCr(OH)2 = 0,01 mol
Khi để ngoài không khí thì:
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
0,01 0,01
=>mkết tủa = 0,01.103 = 1,03 gam
Đáp án cần chọn là: B
Câu 27:
Lấy 101,05 gam hợp kim gồm có Fe, Cr và Al tác dụng với một lượng dư dung dịch kiềm, thu được 5,04 lít khí (đktc). Lấy bã rắn không tan cho tác dụng với lượng dư axit HCl (khi không có không khí) thu được 39,2 lít khí (đktc). Thành phần phần trăn khối lượng của Cr trong hợp kim là
 Xem đáp án
Xem đáp án
Trả lời:
nH2 = 0,225 (mol)
\[Al + NaOH \to \frac{3}{2}{H_2}\]
0,150,225
Bã rắn còn lại là : Fe, Cr.
Đặt số mol của Fe, Cr lần lượt là : x, y mol.
=>mbã rắn = 101,05 – 0,15.27 = 97 gam
=>56x + 52y = 97 (1)
Bảo toàn e: 2.nFe + 2.nCr = 2.nH2 =>2x + 2y = 3,5 (2)
Từ (1) và (2) =>x = 1,5 mol và y = 0,25 mol
=>%mCr = 12,86%
Đáp án cần chọn là: B
Câu 28:
Cho 18,2 gam hỗn hợp các kim loại Fe, Cr, Cu tác dụng với lượng dư dung dịch H2SO4 loãng, nóng trong điều kiện không có không khí thu được dd Y và chất rắn Z cùng 5,6 lít H2 (đktc). Nếu cho 18,2 gam X tác dụng với lượng dư dd H2SO4 đặc, nguội thu được 1,68 lít khí SO2 (đktc). Tính thành phần phần trăm crom trong hỗn hợp?
 Xem đáp án
Xem đáp án
Trả lời:
Gọi số mol của Fe, Cr, Cu lần lượt là : x, y, z mol
→ 56x + 52y + 64z = 18,2 (1)
n H2 = 0,25 mol , Cu không phản ứng =>2.x + 2y = 0,25. 2 (2)
n SO2 = 0,075 mol, Fe, Cr thụ động : z. 2 = n SO2. 2 = 0,075. 2 (3)
=>x = 0,1; y = 0,15 ; z = 0,075
% mCr =(0,15 . 52) . 100% /18,2 = 42,86 %; % mCu = 26,37%
Đáp án cần chọn là: A
Câu 29:
Muối amoni đicromat bị nhiệt phân theo phương trình :
(NH4)2Cr2O7 \[\mathop \to \limits^{t^\circ } \]Cr2O3 + N2 + 4H2O
Phân hủy hoàn toàn 48 gam muối này thu được 30 gam gồm chất rắn và tạp chất. Phần trăm tạp chất trong muối là
 Xem đáp án
Xem đáp án
Trả lời:
Gọi số mol N2 là x
(NH4)2Cr2O7 \[\mathop \to \limits^{t^\circ } \] Cr2O3 + N2 + 4H2O
x x x
=>Áp dụng định luật bảo toàn khối lượng ta có48 = 30 + 28x + 72x =>x = 0,18 mol =>Khối lượng (NH4)2Cr2O7 là 45,36 (gam)
=>Phần trăm muối là : 94,5%=>Phần trăm tạp chất là : 5,5%
Đáp án cần chọn là: D
Câu 30:
Để oxi hóa hoàn toàn 0,01 mol CrCl3 thành K2CrO4 bằng Cl2 khi có mặt KOH, lượng tối thiểu Cl2 và KOH tương ứng là
 Xem đáp án
Xem đáp án
Trả lời:
2CrCl3 + 16KOH + 3Cl2 → 2K2CrO4 + 12KCl + 8H2O
0,01 → 0,08 → 0,015
Đáp án cần chọn là: B
Câu 31:
Cho từ từ dung dịch NaOH vào dung dịch chứa 9,02 gam hỗn hợp muối Al(NO3)3 và Cr(NO3)3 cho đến khi kết tủa thu được là lớn nhất. Tách kết tủa rồi nung đến khối lượng không đổi thu được 2,54 gam chất rắn. Khối lượng của muối Cr(NO3)3 là
 Xem đáp án
Xem đáp án
Trả lời:
Gọi \[\left\{ {\begin{array}{*{20}{c}}{Al{{\left( {N{O_3}} \right)}_3}:x\left( {mol} \right)}\\{Cr{{\left( {N{O_3}} \right)}_3}:y\left( {mol} \right)}\end{array}} \right.\]
=>213x + 238y = 9,02 (1)
Bảo toàn nguyên tố:
nAl2O3= 0,5.nAl(NO3)3 = 0,5x
nCr2O3 = 0,5. nCr(NO3)3 = 0,5y
=>0,5x.102 + 0,5y.152 = 2,54
=>51x + 76y = 2,54 (2)
Từ (1) và (2) ta có
\[\left\{ {\begin{array}{*{20}{c}}{213x + 238y = 9,02}\\{51x + 76y = 2,54}\end{array}} \right. \Rightarrow \left\{ {\begin{array}{*{20}{c}}{x = 0,02}\\{y = 0,02}\end{array}} \right.\]
=>m Cr(NO3)3 = 0,02.238 = 4,76 (gam)
Đáp án cần chọn là: A
Câu 32:
Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm m gam Al và 4,56 gam Cr2O3 (trong điều kiện không có không khí), sau khi phản ứng kết thúc thu được hỗn hợp X. Cho toàn bộ X vào một lượng dư dung dịch HCl loãng nóng, sau khi các phản ứng xảy ra hoàn toàn thu được 2,016 lít khí H2 (đktc). Còn nếu cho toàn bộ X vào một lượng dư dung dịch NaOH đặc nóng, sau phản ứng kết thúc thì số mol NaOH đã phản ứng là
 Xem đáp án
Xem đáp án
Trả lời:
nCr2O3 = 0,03 mol và nH2 = 0,09 mol
2Al + Cr2O3 → Al2O3 + 2Cr
0,06 0,03 0,03 0,06
Nếu Cr2O3 bị khử hết thì nCr = 0,06 < nH2
=>phải có Al dưVới HCl: nH2 = nCr + 1,5.nAl dư = 0,09 mol
=>nAl dư = 0,02 mol =>nAl ban đầu = 0,08 mol
Bảo toàn nguyên tố Na và Al: nNaOH = nNaAlO2 = nAl ban đầu = 0,08 mol
Đáp án cần chọn là: C
Câu 33:
Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03 mol Cr2O3; 0,04 mol FeO và a mol Al. Sau một thời gian phản ứng, trộn đều, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần một phản ứng vừa đủ với 400 ml dung dịch NaOH 0,1M (loãng). Phần hai phản ứng với dung dịch HCl loãng, nóng (dư), thu được 1,12 lít khí H2 (đktc). Giả sử trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. Phần trăm khối lượng Cr2O3 đã phản ứng là
 Xem đáp án
Xem đáp án
Trả lời:
Xét: Cr2O3 + 2Al -> Al2O3 + 2Cr
0,03 y
x 2x x 2x
0,03 – x y – 2x x 2x
Coi toàn bộ 2 phần của hỗn hợp Y phản ứng 0,08 mol NaOH thu được 0,1 mol H2.
Vì Cr2O3 chỉ tác dụng với NaOH đặc, còn NaOH loãng không được.
Ta có:
Tác dụng với NaOH là Al dư và Al2O3: y – 2x + 2x = 0,08 =>y = 0,08
Tác dụng với Fe: 3.(y – 2x) + 4x = 0,2
=>3y – 2x = 0,2
Vậy x = 0,02 =>0,02/0,03 .100% = 66,67%
Đáp án cần chọn là: D
Câu 34:
Hoà tan hoàn toàn m gam hỗn hợp X gồm Na và K vào dung dịch HCl dư thu được dung dịch Y. Cô cạn dung dịch Y thu được (m + 31,95) gam hỗn hợp chất rắn khan. Hoà tan hoàn toàn 2m gam hỗn hợp X vào nước thu được dung dịch Z. Cho từ từ đến hết dung dịch Z vào 0,5 lít dung dịch CrCl3 1M đến phản ứng hoàn toàn thu được kết tủa có khối lượng là
 Xem đáp án
Xem đáp án
Trả lời:
Ta có trong 2m có số mol OH- là = 1,8
Cr3+ + 3OH- → Cr(OH)3 và Cr3+ + 4OH- → [Cr(OH)4] (tan)
a 3a a b 4b
Ta có a + b = 0,5 và 3a + 4b = 1,8
=>a = 0,2
=> m = 0,2.103 = 20,6g
Đáp án cần chọn là: B
Câu 35:
Thực hiện phản ứng nhiệt nhôm giữa Al và Cr2O3 trong điều kiện không có không khí, sau phản ứng hoàn toàn thu được hỗn hợp X có khối lượng 43,9 gam. Chia X làm 2 phần bằng nhau. Cho phần 1 tác dụng với dung dịch NaOH (dư) thu được 1,68 lít khí (đktc). Phần 2 cho tác dụng vừa đủ với V lít dung dịch HCl 1M (loãng nóng). Giá trị của V là
 Xem đáp án
Xem đáp án
Trả lời:
2Al + Cr2O3 → Al2O3 + 2Cr
2x x x 2x
½ X + NaOH : Do có khí thoát ra nên Al còn, Cr2O3 hết, hỗn hợp X gồm Al2O3, Cr và Al dư
nAl dư 1 phần = 2/3.nH2 = 0,05 mol
=>mX = 27.0,05.2 + 102x + 52.2x = 43,9 =>x = 0,2 mol
½ X + HCl :
Al2O3 + 6HCl → 2AlCl3 + 3H2O
0,1 → 0,6
Cr + 2HCl → CrCl2 + H2
0,2 → 0,4
2Al + 6HCl → 2AlCl3 + 3H2
0,05→ 0,15
=>nHCl = 1,15 mol
=>V ddHCl = 1,15 lít
Đáp án cần chọn là: B
Câu 36:
Chia 31,2 gam hỗm hợp X gồm Cr và Zn, Ni và Al thành hai phần bằng nhau. Hòa tan hết phần 1 trong lượng dư dung dịch HCl loãng nóng thu được 7,28lít H2(đktc). Cho phần 2 tác dụng với khí Cl2 (dư ) đốt nóng , thu được 42,225 gam muối clorua . Phần tram khối lượng của crom trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Trả lời:
½ X + HCl → muối Z (CrCl2 , ZnCl2 , NiCl2 , AlCl3) + H2
=>mZ = 15,6 + 71.7,28 / 22,4 = 38,675 gam
½ X + Cl2 → muối Y (CrCl3 , ZnCl2 , NiCl2 , AlCl3)
Gọi 2a là số mol Cr chứa trong hỗn hợp X
=>a = (mY - mX ) / 35,5 = (42,225 – 38,675 ) / 35,5 = 0,1 mol
=>%Cr = 52.0,1.100% / 15,6 = 33,33%
Đáp án cần chọn là: C
Câu 37:
Nung nóng 46,6 gam hỗn hợp gồm Al và Cr2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn. Chia hỗn hợp thu được sau phản ứng thành hai phần bằng nhau. Phần một phản ứng vừa đủ với 300 ml dung dịch NaOH 1M (loãng). Để hòa tan hết phần hai cần vừa đủ dung dịch chứa a mol HCl. Giá trị của a là
 Xem đáp án
Xem đáp án
Trả lời:
TH1: Al dư, Cr2O3 hết. Chỉ có Al dư và Al2O3 tan trong NaOH =>nAl ban đầu = nNaOH = 0,3 mol
=>nCr2O3 = 0,1
Với HCl, sản phẩm chứa Al3+ (0,3 mol), Cr2+ (0,2 mol) =>nCl- = 1,3 mol
Vậy nHCl = 1,3 mol
TH2: Al hết (x mol), Cr2O3 còn dư (y mol)
=>nNaOH = x + 2y = 0,3
mhh = 27x + 152.(0,5x + y) = 23,3
=>x = 1/54 và y = 19/135
Với HCl, sản phẩm chứa Al3+ (1/54 mol), Cr3+ (2y = 38/135) và Cr2+ (1/54 mol)
=>nCl- = 0,937 mol
Đáp án cần chọn là: B
Câu 38:
Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03 mol Cr2O3; 0,04 mol FeO và a mol Al. Sau một thời gian phản ứng, trộn đều, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần 1 phản ứng vừa đủ với 400 ml dung dịch NaOH 0,1M (loãng). Phần 2 phản ứng với dung dịch HCl loãng, nóng, dư thu được 1,12 lít khí H2 (đktc). Giả sử trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. Phần trăm khối lượng Cr2O3 đã phản ứng là:
 Xem đáp án
Xem đáp án
Trả lời:
- Sau phản ứng chia làm hai phần bằng nhau, vậy mỗi phần tương đương với lượng phản ứng ban đầu là 0,015 mol Cr2O3, 0,02 mol FeO và b mol Al (với b = a/2). Số mol các chất trong mỗi phần của hỗn hợp Y là như nhau. (Al, Al2O3, Cr, Cr2O3, Fe, FeO).
Chú ý: Nhiều HS giải cho rằng FeO phản ứng hết. Điều này có thể không chính xác và không khẳng định được.
- Các chất phản ứng với dd NaOH loãng là Al, Al2O3. Riêng Cr2O3 chỉ phản ứng với dd NaOH đặc
- Các chất phản ứng với dd HCl loãng nóng, tạo H2 là Al, Cr, Fe.
- Vậy xét P1: Al + NaOH và Al2O3 + 2NaOH
x x y 2y
=>Số mol Al ban đầu = x + 2y = nNaOH = 0,04 mol
- Xét các phản ứng nhiệt nhôm
2Al + Cr2O3 → Al2O3 + 2Cr
m m/2 m
2Al + 3FeO → Al2O3 + 3Fe
n 1,5n
- Xét phản ứng với dd HCl, ta có tỉ lệ
Al → 1,5H2 ; Cr → H2; Fe → H2
=>nH2 = 1,5x + m + 1,5n và x = 0,04 – m – n
=>1,5 (0,04 – m – n) + m + 1,5n = 0,05 =>0,06 - 1,5m - 1,5n + m + 1,5n = 0,05
=>0,06 – 0,5m = 0,05 =>m = 0,02
=>Số mol Cr2O3 phản ứng = m/2 = 0,01 mol
=>h = 0,01/0,015*100% = 66,67%.
- Đến đây ta thấy rằng lượng FeO phản ứng không ảnh hưởng tới kết quả phản ứng của Cr2O3.
Gọi x là % Cr2O3 đã phản ứng
0,5a = 0,04
0,5a*3 - 0,015x*2 = 0,05*2
=>a = 0,08 và x = 0,6667
Hoặc: (0,04*3-0,05*2):2*100:0,015 = 66,667%
Đáp án cần chọn là: D
Câu 39:
Thực hiện phản ứng nhiệt nhôm hỗn hợp Al, Fe2O3, Cr2O3 sau một thời gian thu được hỗn hợp chất rắn X. Chia X thành 2 phần bằng nhau. Hòa tan hoàn toàn phần 1 trong dung dịch H2SO4 đặc, nóng dư sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít khí SO2 (sản phẩm khử duy nhất, đktc). Hòa tan hết phần 2 trong 400 ml dung dịch HNO3 2M, thu được dung dịch Y và khí NO (sản phẩm khử duy nhất của N+5). Cho từ từ dung dịch NaOH 1M đến dư vào dung dịch Y thu được kết quả như hình vẽ sau:
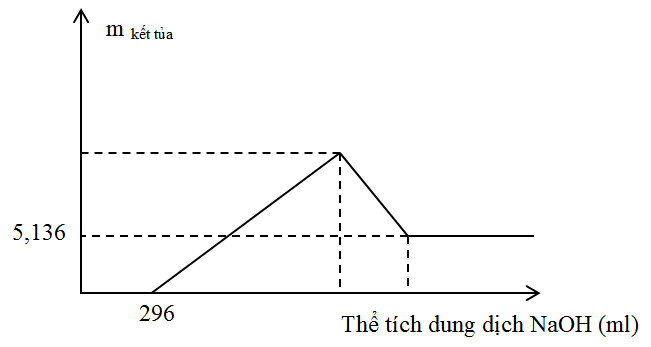
Khối lượng Cr2O3 trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
Trả lời:
Nhìn vào đồ thị ta thấy sau một thời gian kết tủa xuất hiện nên suy ra trong dung dịch Y có chứa H+ dư
=>nH+ dư = 0,296 mol
Khi thêm NaOH khối lượng kết tủa không đổi và bằng 5,136 gam =>mFe(OH)3 = 5,136 gam
=>nFe(OH)3 = 0,048 mol
Quy đổi mỗi phần thành: Al (x mol); Fe (0,048 mol); Cr (y mol); O (x mol)
=>nFe2O3 = 0,5.0,048 = 0,024 (mol); nCr2O3 = 0,5y (mol)
+ Ta có: nO = 3nFe2O3 + 3nCr2O3 =>z = 3.0,024 + 3.0,5y (1)
+ BTe quá trình phần 1 tác dụng với H2SO4 đặc nóng dư:
3nAl + 3nFe + 3nCr = 2nO + 2nSO2 =>3x + 3.0,048 + 3y = 2z + 0,09.2 (2)
+ Phần 2 tác dụng với HNO3:
Thành phần dung dịch Y
\[\left\{ {\begin{array}{*{20}{c}}{A{l^{3 + }}:x}\\{F{e^{3 + }}:0,048}\\{C{r^{3 + }}:x}\\{{H^ + }du:0,296}\\{\mathop \to \limits^{BTDT} NO_3^ - :3x + 3y + 0,44}\end{array}} \right.\]
Do 2 phần có khối lượng bằng nhau nên ta suy ra lượng e trao đổi của SO2 bằng lượng e trao đổi của NO
=>2nSO2 = 3nNO =>nNO = 2/3.nSO2 = 2/3.0,09 = 0,06 mol
BTNT "N": nHNO3 pư = nNO3- + nNO =>0,8 = 3x + 3y + 0,44 + 0,06 (3)
Giải hệ (1) (2) (3) được x = 0,06; y = 0,04; z = 0,132
Trong mỗi phần ta có: nCr = y = 0,04 =>nCr2O3 = 0,02 mol =>mCr2O3 = 3,04 gam
=>mCr2O3 (hh đầu) = 6,08 gam
Đáp án cần chọn là: C
