ĐGNL ĐH Bách khoa - Vấn đề thuộc lĩnh vực hóa học - Benzen và ankylbenzen
-
1094 lượt thi
-
32 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Cho các công thức :
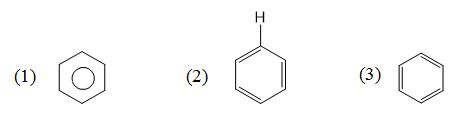
Công thức cấu tạo nào là của benzen ?
 Xem đáp án
Xem đáp án
Trả lời:
Các cấu tạo của benzen là (1) ; (2) và (3).
Đáp án cần chọn là: D
Câu 2:
Ankylbenzen là hiđrocacbon có chứa
 Xem đáp án
Xem đáp án
Trả lời:
Ankylbenzen là hiđrocacbon có chứa gốc ankyl và một vòng benzen.
Đáp án cần chọn là: D
Câu 3:
Câu nào đúng nhất trong các câu sau đây ?
 Xem đáp án
Xem đáp án
Trả lời:
A sai vì benzen có mạch vòng
B sai vì benzen không no
C sai vì benzen chỉ chứa C và H =>là hiđrocacbon
D đúng. Benzen là một hiđrocacbon thơm.
Đáp án cần chọn là: D
Câu 4:
Chất nào sau đây không thể chứa vòng benzen ?
 Xem đáp án
Xem đáp án
Trả lời:
Chất không thể chứa vòng benzen là C6H8 vì độ bất bão hòa k = (2.6 + 2 – 8) / 2 = 3 < 4
Đáp án cần chọn là: B
Câu 5:
Một bạn học sinh đã viết 5 công thức cấu tạo :
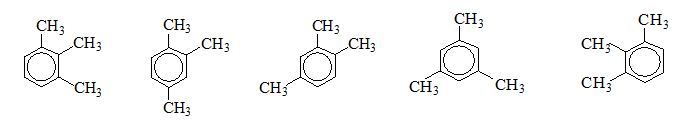
Bạn đó đã viết được bao nhiêu đồng phân
 Xem đáp án
Xem đáp án
Trả lời:

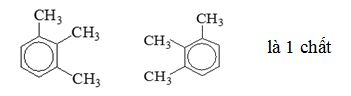
=>có tất cả 3 chất
Đáp án cần chọn là: C
Câu 6:
Cho các chất :
(1) C6H5–CH3
(2) p-CH3–C6H4–C2H5
(3) C6H5–C2H3
(4) o-CH3–C6H4–CH3
Dãy gồm các chất là đồng đẳng của benzen là :
 Xem đáp án
Xem đáp án
Trả lời:
Dãy gồm các chất là đồng đẳng của benzen là : D. (1) ; (2) và (4).
(3) không phải vì nhánh –C2H3 không no
Đáp án cần chọn là: D
Câu 7:
Hoạt tính sinh học của benzen, toluen là :
 Xem đáp án
Xem đáp án
Trả lời:
Hoạt tính sinh học của benzen, toluen là : Gây hại cho sức khỏe.
Đáp án cần chọn là: A
Câu 8:
Phản ứng nào sau đây không xảy ra ?
 Xem đáp án
Xem đáp án
Trả lời:
Benzen chỉ phản ứng với Br2 khan và xúc tác Fe; không phản ứng với Br2 trong dung dịch.
Đáp án cần chọn là: C
Câu 9:
Cho sơ đồ:
\[Axetilen\mathop \to \limits^{C,600^\circ C} X\mathop \to \limits^{HN{O_3}d/{H_2}S{O_4}d} Y\mathop \to \limits^{C{l_2},Fe,t^\circ } Z\]
CTCT phù hợp của Z là:
 Xem đáp án
Xem đáp án
Trả lời:
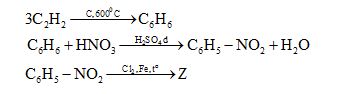
Do NO2 hút e mạnh lên sẽ định hướng thế vào vị trí meta
=>Z là m-Cl-C6H4-NO2
Đáp án cần chọn là: C
Câu 10:
Toluen + Cl2 (as) xảy ra phản ứng :
 Xem đáp án
Xem đáp án
Trả lời:
Toluen + Cl2 (as) xảy ra phản ứng thế ở nhánh, khó khăn hơn CH4 do tác động của vòng benzen
Đáp án cần chọn là: C
Câu 11:
Sản phẩm chính khi oxi hóa các ankylbenzen bằng KMnO4 /H+ là :
 Xem đáp án
Xem đáp án
Trả lời:
Sản phẩm chính khi oxi hóa các ankylbenzen bằng KMnO4 /H+ là : C6H5COOH.
Đáp án cần chọn là: A
Câu 12:
Ứng dụng nào benzen không có :
 Xem đáp án
Xem đáp án
Trả lời:
Ứng dụng không phải của benzen là : dùng trực tiếp làm dược phẩm
Đáp án cần chọn là: D
Câu 13:
Lượng clobenzen thu được khi cho 15,6 gam C6H6 tác dụng hết với Cl2 (xúc tác bột Fe) với hiệu suất phản ứng đạt 80% là :
 Xem đáp án
Xem đáp án
Trả lời:
\[{n_{{C_6}{H_6}\left( {pu} \right)}} = \frac{{15,6}}{{78}}.80\% = 0,16\,mol\]
Phương trình phản ứng :
C6H6 + Cl2 \[\mathop \to \limits^{t^\circ ,Fe} \]C6H5Cl + HCl (1)
mol: 0,16 0,16
Vậy khối lượng clobenzen thu được là : 0,16.112,5= 18 gam.
Đáp án cần chọn là: C
Câu 14:
Hỗn hợp gồm 1 mol C6H6 và 1,5 mol Cl2. Trong điều kiện có xúc tác bột Fe, to, hiệu suất 100%. Sau phản ứng thu được chất gì ? bao nhiêu mol ?
 Xem đáp án
Xem đáp án
Trả lời:
Tỉ lệ mol: \[\frac{{{n_{C{l_2}}}}}{{{n_{{C_6}{H_6}}}}} = 1,5\]
⇒ phản ứng tạo ra hỗn hợp hai sản phẩm là C6H5Cl và C6H4Cl2.
Phương trình phản ứng :
C6H6 + Cl2 to,Fe−−−→→to,Fe C6H5Cl + HCl (1)
mol: x x x x
C6H6 + 2Cl2 to,Fe−−−→→to,Fe C6H4Cl2 + 2HCl (2)
mol: y 2y y 2y
Theo giả thiết ta có:
\[\left\{ {\begin{array}{*{20}{c}}{x + y = 1}\\{x + 2y = 1,5}\end{array}} \right. \Rightarrow \left\{ {\begin{array}{*{20}{c}}{x = 0,5}\\{y = 0,5}\end{array}} \right.\]
Vậy sau phản ứng thu được 0,5 mol C6H5Cl ; 1,5 mol HCl ; 0,5 mol C6H4Cl2.
Đáp án cần chọn là: D
Câu 15:
Một hợp chất hữu cơ X có vòng benzen có CTĐGN là C3H2Br và M = 236. Gọi tên hợp chất này biết rằng hợp chất này là sản phẩm chính trong phản ứng giữa C6H6 và Br2 (xúc tác Fe).
 Xem đáp án
Xem đáp án
Trả lời:
Đặt CTPT của hợp chất X là (C3H2Br)n suy ra (12.3+2+80).n = 236 =>n = 2.
=>công thức phân tử của X là C6H4Br2
Vì hợp chất X là sản phẩm chính trong phản ứng giữa C6H6 và Br2 (xúc tác Fe) nên theo quy tắc thế trên vòng benzen ta thấy X có thể là o- đibrombenzen hoặc p-đibrombenzen.
Đáp án cần chọn là: A
Câu 16:
TNT (2,4,6- trinitrotoluen) được điều chế bằng phản ứng của toluen với hỗn hợp gồm HNO3 đặc và H2SO4 đặc, trong điều kiện đun nóng. Biết hiệu suất của toàn bộ quá trình tổng hợp là 80%. Lượng TNT (2,4,6- trinitrotoluen) tạo thành từ 230 gam toluen là
 Xem đáp án
Xem đáp án
Trả lời:
Phương trình phản ứng:
C6H5CH3 + 3HNO3 \[\mathop \to \limits^{{H_2}S{O_4}d,t^\circ } \]C6H2(NO2)3CH3 + 3H2O (1)
gam: 92 → 227
gam: 230.80% → x
Theo phương trình và giả thiết ta thấy khối lượng TNT (2,4,6-trinitrotoluen) tạo thành từ 230 gam toluen với hiệu suất 80% là :
\[x = \frac{{230.80\% .227}}{{92}} = 454\,gam\]
Đáp án cần chọn là: C
Câu 17:
Tính chất nào sau đây không phải của ankylbenzen
 Xem đáp án
Xem đáp án
Trả lời:
Các ankylbenzen là chất không màu, không tan trong nước nhưng tan nhiều trong dung môi hữu cơ, có mùi thơm nhẹ và là chất độc.
Đáp án cần chọn là: B
Câu 18:
ứng dụng nào benzen không có
 Xem đáp án
Xem đáp án
Trả lời:
Benzen không dùng trực tiếp làm dược phẩm.
Đáp án cần chọn là: D
Câu 19:
Đốt cháy hoàn toàn một thể tích hơi hợp chất hữu cơ A cần 10 thể tích oxi (đo cùng điều kiện nhiệt độ và áp suất), sản phẩm thu được chỉ gồm CO2 và H2O với tỉ lệ khối lượng là 44 : 9. Biết MA < 150. A có công thức phân tử là :
 Xem đáp án
Xem đáp án
Trả lời:
Từ giả thiết = 44 : 9 suy ra:
\[{n_{C{O_2}}}:{n_{{H_2}O}} = 1:0,5 \Rightarrow {n_C}:{n_H} = 1:1\]
A có thể có hoặc không có oxi, đặt công thức phân tử của A là CxHxOy.
Phương trình phản ứng :
CxHxOy + \[\left( {\frac{{5x}}{4} - \frac{y}{2}} \right)\mathop \to \limits^{t^\circ } \]xCO2 + \[\frac{x}{2}\]2 H2O (1)
mol: 1 → \[\left( {\frac{{5x}}{4} - \frac{y}{2}} \right)\]
Theo (1) và giả thiết ta có:
\[\left( {\frac{{5x}}{4} - \frac{y}{2}} \right) = 10 \Rightarrow \left\{ {\begin{array}{*{20}{c}}{x = 8}\\{y = 0}\end{array}} \right.\]
Vậy công thức phân tử của A là C8H8.
Đáp án cần chọn là: C
Câu 20:
A, B, C là ba chất hữu cơ có %C, %H (theo khối lượng) lần lượt là 92,3% và 7,7%, tỉ lệ khối lượng mol tương ứng là 1: 2 : 3. Từ A có thể điều chế B hoặc C bằng một phản ứng. C không làm mất màu nước brom. Đốt 0,1 mol B rồi dẫn toàn bộ sản phẩm cháy qua bình đựng dung dịch nước vôi trong dư. Khối lượng dung dịch tăng hoặc giảm bao nhiêu gam ?
 Xem đáp án
Xem đáp án
Trả lời:
Theo giả thiết ta thấy A, B, C có cùng công thức đơn giản nhất.
\[{n_H} = \frac{{92,3}}{{12}}:\frac{{7,7}}{1} = 1:1\]
Công thức đơn giản nhất của A, B, C là CH.
Từ A có thể điều chế B hoặc C bằng một phản ứng; C không làm mất màu nước brom nên A là C2H2, B là C4H4; C là C6H6 (benzen).
Sơ đồ đốt cháy B :
C4H4 O2,to−−−→→O2,to 4CO2 + 2H2O (1)
mol: 0,1 → 0,4 → 0,2
Dẫn toàn bộ sản phẩm cháy vào bình đựng nước vôi trong dư thì xảy ra phản ứng :
CO2 + Ca(OH)2 → CaCO3 + H2 O (2)
mol: 0,4 → 0,4
mkết tủa = 0,4.100 = 40 gam =>mdung dịch giảm = 40 – 21,2 =18,8 gam
Đáp án cần chọn là: C
Câu 21:
Cho các chất: (1) benzen, (2) toluen, (3) xiclohexan, (4) hex-5-trien, (5) xilen, (6) cumen. Dãy gồm các hiđrocacbon thơm là
 Xem đáp án
Xem đáp án
Trả lời:
Các hidrocacbon thơm gồm benzen; toluen; xilen; cumen.
Đáp án cần chọn là: B
Câu 22:
\[{C_2}{H_2} \to A \to B \to n - brombenzen\]. A và B lần lượt là
 Xem đáp án
Xem đáp án
Trả lời:
![\[{C_2}{H_2} \to A \to B \to n - brombenzen\]. A và B lần lượt là (ảnh 1)](https://video.vietjack.com/upload2/images/1650083553/1650083734-image9.png)
Đáp án cần chọn là: A
Câu 23:
\[{C_2}{H_2} \to A \to B \to o - brombenzen\]. Công thức của A và B lần lượt là
 Xem đáp án
Xem đáp án
Trả lời:
![\[{C_2}{H_2} \to A \to B \to o - brombenzen\]. Công thức của A và B lần lượt là (ảnh 1)](https://video.vietjack.com/upload2/images/1650083553/1650083734-image10.png)
Đáp án cần chọn là: B
Câu 24:
Cho 100 ml benzen (d = 0,879 g/ml) tác dụng với một lượng vừa đủ brom lỏng (xúc tác bột Fe, đun nóng) thu được 80 ml brombenzen (d = 1,495 g/ml). Hiệu suất brom hóa đạt
 Xem đáp án
Xem đáp án
Trả lời:
\[{n_{{C_6}{H_6}}} = \frac{{100.0,879}}{{78}} = 1,127\left( {mol} \right)\]
\[{n_{{C_6}{H_6}Br}} = \frac{{80.1,495}}{{157}} = 0,762\left( {mol} \right)\]
\[ \Rightarrow H = \frac{{0,762}}{{1,127}}.100\% = 67,6\% \]
Đáp án cần chọn là: A
Câu 25:
 Xem đáp án
Xem đáp án
Trả lời:
C6H6 + nHNO3 → C6H6-n(NO2)n + nH2O
C6H6-n(NO2)n → ½ nN2
Mol: 0,14n0,14n ← 0,07
\[M = 78 + 45n = \frac{{14,1n}}{{0,14}} \to n = 1,4\]
Phân tử khối hơn kém 45u → hơn kém nhau 1 nhóm -NO2
→ C6H5NO2 và C6H4(NO2)2
Đáp án cần chọn là: A
Câu 26:
Đề hiđro hóa etylbenzen ta được stiren, trùng hợp stiren ta được polistiren với hiệu suất chung 80%. Khối lượng etylbenzen cần dùng để sản xuất 10,4 tấn polistiren là
 Xem đáp án
Xem đáp án
Trả lời:
\[{C_6}{H_5}{C_2}{H_5} \to {C_6}{H_5}CH = C{H_2}\]
\[ \to \frac{1}{n}{\left( {CH\left( {{C_6}{H_5}} \right) - C{H_2} - } \right)_n}\]
\[{n_{polistiren}} = \frac{{10,4}}{{104n}}{.10^3} = \frac{{100}}{n}\left( {mol} \right)\]
\[ \to {n_{ety{\mathop{\rm lbenzen}\nolimits} \left( {pu} \right)}} = n.n{}_{polistiren} = 100\left( {mol} \right)\]
\[ \to {n_{ety{\mathop{\rm lbenzen}\nolimits} \left( {bd} \right)}} = \frac{{100.106}}{{80\% }} = 13,{25.10^3}\left( g \right)\]
Đáp án cần chọn là: C
Câu 27:
Thể tích không khí (đktc) cần dùng để đốt cháy hoàn toàn 0,1 mol benzen là (biết trong không khí O2 chiếm 20% thể tích)
 Xem đáp án
Xem đáp án
Trả lời:
\[{C_6}{H_6} + \frac{{15}}{2}{O_2}\mathop \to \limits^{t^\circ } 6C{O_2} + 3{H_2}O\]
Mol 0,1 →0,75
\[ \to {V_{kk}} = \frac{{{V_{{O_2}}}}}{{20\% }} = \frac{{0,75.22,4}}{{20\% }} = 84\left( {lit} \right)\]
Đáp án cần chọn là: A
Câu 28:
 Xem đáp án
Xem đáp án
Trả lời:
\[{n_{C{O_2}}} = 0,1\left( {mol} \right);{n_{{H_2}O}} = 0,05\left( {mol} \right)\]
\[ \Rightarrow {m_O} = 1,3 - 0,1.12 - 2.0,05 = 0\left( {gam} \right)\]
=>A là hidrocacbon.
C : H = 1:1 =>gọi CT của A là (CH)n
\[3 < {d_{A/{O_2}}} < 3,5 \to 96 < {M_A} < 112\]
=>96 < 13n < 112
=>7,4 < n < 8,6 =>n = 8
=>CTPT của A là C8H8
Đáp án cần chọn là: B
Câu 29:
Đốt cháy hết 9,18 gam 2 đồng đẳng kế tiếp thuộc dãy của benzen A, B thu được H2O và 30,36 gam CO2, Công thức phân tử của A và B lần lượt là
 Xem đáp án
Xem đáp án
Trả lời:
Gọi CTPT chung là \[{C_{\overline n }}{H_{2\overline n - 6}}\]
\[{n_{C{O_2}}} = 0,69\left( {mol} \right) \to {n_{{C_n}{H_{2n - 6}}}} = \frac{{{n_{C{O_2}}}}}{{\overline n }} = \frac{{0,69}}{{\overline n }}\]
\[M = 14\overline n - 6 = \frac{{9,18\overline n }}{{0,69}} \to \overline n = 8,6\]
=>CTPT của A và B là C8H10 và C9H12
Đáp án cần chọn là: B
Câu 30:
 Xem đáp án
Xem đáp án
Trả lời:
\[\% C:\% H = 92,3\% ;7,7\% \to {n_C}:{n_H} = 1:1\]
=>CTPT đơn giản nhất là (CH)n
Tỉ lệ số mol là 1:2:3, từ A có thể điều chế B hoặc C bằng 1 phản ứng; C khống làm mất màu nước brom
=>A là C2H2, B là C4H4, C là C6H6
Đốt 0,1 mol C4H4
\[ \to \left\{ {\begin{array}{*{20}{c}}{{n_{C{O_2}}} = 4{n_B} = 0,4\left( {mol} \right)}\\{{n_{{H_2}O}} = 2{n_B} = 0,2\left( {mol} \right)}\end{array}} \right.\]
\[ \to {m_{C{O_2}}} + {m_{{H_2}O}} = 21,2\left( {gam} \right)\]
\[{m_{CaC{O_3}}} = 0,4.100 = 40\left( {gam} \right)\]
Khối lượng bình giảm
\[ = {m_{CaC{O_3}}} - \left( {{m_{C{O_2}}} + {m_{{H_2}O}}} \right) = 18,8\left( {gam} \right)\]
Đáp án cần chọn là: C
Câu 31:
Đốt cháy hoàn toàn 0,1 mol hỗn hợp gồm X gồm C6H14 và CxHx (CxHx có vòng benzen) thu được 15,68 lít khí CO2 (đktc) và 9,9 gam nước. Nếu cho hỗn hợp trên vào dung dịch Br2 dư thì CxHx tác dụng hoàn toàn với m gam Br2 . Giá trị của m là
 Xem đáp án
Xem đáp án
Trả lời:
Bước 1: Tính số mol C6H14 và CxHx
- nCO2 = 0,7 mol; nH2O = 0,55 mol.
- Gọi số mol C6H14 và CxHx lần lượt là a và b (mol).
+ nX = a + b = 0,1 (1)
+ BTNT C ⟹ nCO2 = 6a + xb = 0,7 (2)
+ BTNT H ⟹ 2nH2O = 14a + xb ⟹ 14a + xb = 1,1 (3)
Từ (1), (2) và (3) ⟹ a = 0,05 ; b = 0,05 và x = 8.
Bước 2: Xác định CTPT và CTCT của X
- CxHx là C8H8 và có CTCT là C6H5CH=CH2 (chứa vòng benzen).
Bước 3: Tính m
- PTHH: C6H5CH=CH2 + Br2 ⟶ C6H5CHBr-CH2Br.
Theo PTHH ⟹ nBr2 = nC8H8 = 0,05 mol.
- Vậy mBr2 = 0,05.160 = 8 gam.
Đáp án cần chọn là: C
Câu 32:
Bước 1: Cho vào ống nghiệm khô khoảng 5 ml benzen và 2 ml brom nguyên chất, lắc nhẹ ống nghiệm.
Bước 2: Để yên ống nghiệm trong 3 phút.
Bước 3: Cho tiếp một ít bột sắt vào ống nghiệm trên rồi lắc nhẹ liên tục trong 3 phút.
(Trong quá trình làm thí nghiệm, tránh ánh sáng chiếu trực tiếp vào chất lỏng trong ống nghiệm bằng cách bọc bên ngoài ống nghiệm một tờ giấy tối màu.)
Cho các phát biểu sau:
(1) Sau bước 1, có sự phân tách chất lỏng trong ống nghiệm thành hai lớp.
(2) Ở bước 2, trong suốt quá trình màu của dung dịch trong ống nghiệm không thay đổi.
(3) Ở bước 3, màu của dung dịch nhạt dần.
(4) Ở bước 3, thêm bột sắt là để làm xúc tác cho phản ứng giữa benzen và brom xảy ra.
(5) Sản phẩm hữu cơ chủ yếu thu được sau bước 3 là 1,2,3,4,5,6-hexabromxiclohexan).
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Trả lời:
(1) sai, vì Br2 và C6H6 đều không phân cực nên tan trong nhau tạo dung dịch đồng nhất.
(2) đúng, vì khi chưa có mặt bột Fe thì phản ứng không xảy ra.
(3) đúng, vì C6H6 + Br2 (nâu đỏ) \[\mathop \to \limits^{Fe} \]C6H5Br (không màu) + HBr.
(4) đúng.
(5) sai, C6H6 + Br2 \[\mathop \to \limits^{Fe} \]C6H5Br (brom benzen) + HBr.
Vậy có 3 phát biểu đúng.
Đáp án cần chọn là: C
