Đề thi cuối kì 2 Hóa 12 có đáp án (Đề 7)
-
11678 lượt thi
-
40 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên liệu chính dùng để sản xuất nhôm làquặng boxit (Al2O3.2H2O).
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khi nhúng cặp kim loại vào dung dịch axit → xảy ra ăn mòn điện hóa: kim loại có tính khử mạnh hơn bị phá hủy trước.
→ Có 1 cặp kim loại trong đó Fe bị phá huỷ trước là: Fe và Sn.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là:A
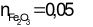 (mol).
(mol).
Phương trình hóa học:
Fe2O3+ 2Al  Al2O3+ 2Fe.
Al2O3+ 2Fe.
0,050,1 (mol)
→ mAl= 0,1×27 = 2,7 (gam).
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
So sánh tính khử: K >Na >Ca >Cr >Fe .
→ Cr là kim loại có tính khử mạnh hơnFe.
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Chất không có tính chất lưỡng tính làAlCl3.
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nước cứng là nước có chứa nhiều các ion Ca2+và Mg2+.
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Để bảo vệ vỏ tàu biển bằng thép người ta thường gắn vỏ tàu (phần ngoài ngâm dưới nước) những tấm kim loạikẽm. Kết quả là kẽm bị nước biển ăn mòn thay cho thép.
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
nX= 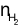 = 0,05 (mol)
= 0,05 (mol)
→ MX= 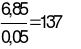 (đvC) → X là kim loại bari (Ba).
(đvC) → X là kim loại bari (Ba).
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hai dung dịch đều tác dụng được với Fe là: CuSO4và HCl.
Phương trình hóa học:
Fe + CuSO4→ FeSO4+ Cu↓
Fe + 2HCl → FeCl2+ H2↑
Loại A vì Fe không tác dụng với dung dịch MgCl2.
Loại C vì Fe không tác dụng với dung dịch ZnCl2.
Loại D vì Fe không tác dụng với dung dịch CaCl2.
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Chỉ có kim loại Zn tan trong dung dịch HCl:
Zn +2HCl → ZnCl2+ H2↑.
→ nZn= 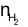 = 0,2 (mol)
= 0,2 (mol)
→ m = mCu= 15 – 0.2×65 = 2 (gam).
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cấu hình electron của Fe (Z = 26): [Ar]3d64s2.
Kim loại Fe nhường 2 electron để tạo thành ion Fe2+.
→ Cấu hình electron của ion Fe2+là [Ar] 3d6.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Bảo toàn e: nNO= nFe= 0,1 (mol)
→ VNO= 0,1×22,4 = 2,24 (lít).
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phương pháp nhiệt luyện thường dùng để điều chế những kim loại có độ hoạt động trung bình, nghĩa là khử ion kim loại trong hợp chất ở nhiệt độ cao bằng các chất khử như C, CO, H2… hoặc các kim loại hoạt động.
→ Hai kim loại có thể điều chế bằng phương pháp nhiệt luyện là Fe và Cu.
Ví dụ: CuO + CO  Cu + CO2.
Cu + CO2.
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Công thức thạch cao sống: CaSO4.2H2O;
thạch cao nung: CaSO4.H2O hoặc CaSO4.0.5H2O;
thạch cao khan: CaSO4.
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phương trình hóa học:
2NH3+ 2CrO3 Cr2O3+ N2+ 3H2O.
Cr2O3+ N2+ 3H2O.
→ 1 phân tử NH3tác dụng với 1 phân tử CrO3.
Câu 17:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Kim loại kiềm thổ (IIA) gồm: Be, Mg, Ca, Sr, Ba.
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên liệu sản xuất gang là quặng sắt oxit (thường dùng hematit đỏ (Fe2O3); ngoài ra còn có quặng hematit nâu (Fe2O3.nH2O); quặng manhetit (Fe3O4)).
→ Quặng pirit sắt (FeS2) không dùng để sản xuất gang.
Câu 19:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Kim loại có nhiệt độ nóng chảy thấp nhất là Hg (– 39oC), cao nhất là W (3410oC).
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Tính khử tăng dần: Fe < Al < Mg
Câu 21:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phương trình hóa học:
Mg + 2HCl → MgCl2+ H2↑
Fe3O4+ 8HCl → 2FeCl3+ FeCl2+ 4H2O
Cu + 2FeCl3→ CuCl2+ 2FeCl2
nMg= 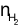 = 0,1 (mol); mCu (dư) = 18 (gam).
= 0,1 (mol); mCu (dư) = 18 (gam).
Gọi số mol Fe3O4và Cu phản ứng lần lượt là x, y.
→ 232x + 64y + 0,1×24 + 18 = 50
→ 232x + 64y = 29,6 (1)
Bảo toàn electron:
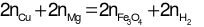
→ 2y + 2×0,1 = 2x + 2×0,1 → x = y (2).
Từ (1) và (2), suy ra: x = y = 0,1.
→ 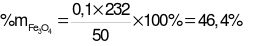 .
.
Câu 22:
Chất Thuốc thử | X | Y | Z | T |
Dung dịch Ca(OH)2 | Kết tủa trắng | Khí mùi khai | Không có hiện tượng | Kêt tủa trắng, có khí mùi khai |
Nhận xét nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Chất X + dung dịch Ca(OH)2→ chỉ xuất hiện kết tủa trắng.
→ Chất X là KHCO3.
Phương trình ion:
 ;
;
Ca2++ 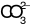 → CaCO3↓.
→ CaCO3↓.
Chất Y + dung dịch Ca(OH)2→ Khí mùi khai.
→ Chất Y là NH4NO3.
Phương trình ion: 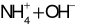 → NH3↑ + H2O.
→ NH3↑ + H2O.
Chất T + dung dịch Ca(OH)2→ Kết tủa trắng + Khí mùi khai.
→ Chất T là (NH4)2CO3.
Phương trình ion:
 ;
;
Ca2++ 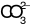 → CaCO3↓
→ CaCO3↓
 → NH3↑ + H2O
→ NH3↑ + H2O
Chất Z + dung dịch Ca(OH)2→ Không có hiện tượng gì.
→ Chất Z là NaNO3.
Câu 23:
 X
X  Y. Biết Y là hợp chất của crom. Hai chất X và Y lần lượt là
Y. Biết Y là hợp chất của crom. Hai chất X và Y lần lượt là Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phương trình hóa học:
2Cr + 3Cl2 2CrCl3
2CrCl3
2CrCl3+ 3Cl2+ 16KOH → 2K2CrO4+ 12KCl + 8H2O
→ Hai chất X và Y lần lượt làCrCl3và K2CrO4.
Câu 24:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Để có thể làm khô các khí bằng NaOH (ở thể rắn) thì điều kiện: không có phản ứng xảy ra giữa NaOH và các khí ẩm.
→ Có thể dùng NaOH (ở thể rắn) để làm khô các chất khí: NH3, O2, N2, CH4, H2.
Loại A vì NaOH có phản ứng với Cl2, SO2.
Loại B vì NaOH có phản ứng với CO2, NO2.
Loại D vì NaOH có phản ứng với Cl2, CO2.
Câu 25:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phương trình hóa học:
Fe + H2SO4→ FeSO4+ H2↑
→ Khí X là H2.
2KNO3 2KNO2+ O2↑
2KNO2+ O2↑
→ Khí Y là O2.
K2Cr2O7+ 14HCl(đặc) → 2KCl + 2CrCl3+ 3Cl2↑ + 7H2O
→ Khí Z là Cl2.
Câu 26:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Sơ đồ phản ứng:
X 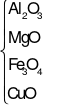
 Y
Y 
 Z
Z  .
.
(Al2O3là hợp chất lưỡng tính, có khả năng tan trong dung dịch NaOH).
Câu 27:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các chất lưỡng tính là: Cr(OH)3, Zn(OH)2.
Câu 28:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phương trình hóa học:
+) 2NH4Cl + Ba(OH)2→ BaCl2+ 2NH3↑ + 2H2O
+) (NH4)2SO4+ Ba(OH)2→ BaSO4↓ + 2NH3↑ + 2H2O
+) NaCl + Ba(OH)2→ không phản ứng
+) MgCl2+ Ba(OH)2→ Mg(OH)2↓ + BaCl2
+) FeCl2+ Ba(OH)2→ Fe(OH)2↓ + BaCl2(Fe(OH)2 Fe(OH)3)
Fe(OH)3)
+) 2AlCl3+ 3Ba(OH)2→ 2Al(OH)3↓ + 3BaCl2
Kết tủa Al(OH)3tan hết trong dung dịch Ba(OH)2dư:
Al(OH)3+ OH-→ 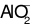 + 2H2O
+ 2H2O
→ Có 3 chất tác dụng với lượng dư dung dịch Ba(OH)2tạo thành kết tủa: (NH4)2SO4, MgCl2, FeCl2.
Câu 29:
Dung dịch X
KhíZ
Dung dịch X
Chất rắn Y
KhíZ
H2O
Dung dịch X
KhíZ
Dung dịch X
Chất rắn Y
KhíZ
H2O
Hình vẽ trên minh họa cho phản ứng nào sau đây ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Khí Z được thu bằng cách đẩy nước → Khí Z không tan hoặc tan rất ít trong nước.
→ Khí Z là H2.
Câu 30:
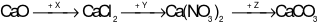 . Công thức của X, Y, Z lần lượt là:
. Công thức của X, Y, Z lần lượt là: Xem đáp án
Xem đáp án
Đáp án đúng là: A
X là HCl; Y là AgNO3; Z là (NH4)2CO3.
Phương trình hóa học:
CaO + 2HCl → CaCl2+ H2O
CaCl2+ 2AgNO3→ Ca(NO3)2+ 2AgCl↓
Ca(NO3)2+ (NH4)2CO3→ CaCO3↓ + 2NH4NO3
Câu 31:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
So sánh tính khử: Al >Fe.
So sánh tính oxi hóa: Ag+>Cu2+.
→ Hỗn hợp 3 kim loại sau thu được sau phản ứng: Ag, Cu, Fe (dư).
Câu 32:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phương trình hóa học:
Mg + 2FeCl3→ MgCl2+ 2FeCl2(1)
0,060,12(mol)
Mg + FeCl2→ MgCl2+ Fe (2)
0,060,06 (mol)
Giả sử FeCl3và FeCl2phản ứng hết sau (1) và (2).
→ mFe= 0,12×56 = 6,72 (gam) >mrắn= 3,36 (gam).
→ FeCl2dư sau phản ứng (2).
→ mFe= 3,36 (gam) → nFe = 0,06 (mol).
→ mMg= (0,06 + 0,06)×24 = 2,88 (gam).
Câu 33:
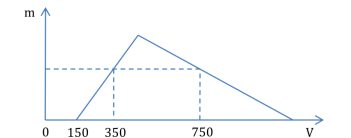
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Hòa tan hoàn toàn hỗn hợp X gồm Al2O3và Na vào nước:
2Na + 2H2O → 2NaOH + H2↑
Al2O3+ 2NaOH → 2NaAlO2+ H2O
→ Dung dịch Y gồm: NaAlO2và NaOH (dư).
nNaOH (dư)= 0,15×1 = 0,15 (mol).
Gọi số mol NaAlO2là a (mol) → n↓(Max)= a (mol).
Từ đồ thị, ta có: (4a + 0,15) – 0,75 = 3×(0,35 – 0,15) → a = 0,3.
→  (mol).
(mol).
→ x =  = 0,225×22,4 = 5,04 (lít).
= 0,225×22,4 = 5,04 (lít).
Câu 34:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Thí nghiệm 1:
CO2(0,04 mol) + X 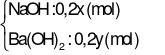 → dung dịch A + ↓BaCO3(1,97 gam).
→ dung dịch A + ↓BaCO3(1,97 gam).
→ 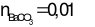 (mol);
(mol); 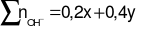 (mol).
(mol).
Thí nghiệm 2:
CO2(0,0325 mol) + Y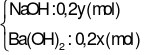 → dung dịch B + ↓BaCO3(1,4775 gam).
→ dung dịch B + ↓BaCO3(1,4775 gam).
→ 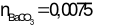 (mol);
(mol); 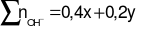 (mol).
(mol).
Phương trình ion:
CO2+ OH-→ 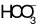
CO2+ 2OH-→ 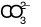 + H2O
+ H2O
Ba2++ 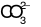 → BaCO3↓
→ BaCO3↓
Dung dịch A và B phản ứng với dung dịch KHSO4đều sinh ra kết tủa trắng → trong 2 dung dịch A và B đều còn dư Ba2+(Ba2+ + 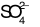 → BaSO4↓).
→ BaSO4↓).
Ta có hệ phương trình:
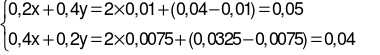
→  .
.
Câu 35:
(1) Cho AgNO3vào dung dịch Fe(NO3)2.
(2) Dẫn NH3 qua ống đựng CuO nung nóng.
(3) Cho Al vào dung dịch Fe2(SO4)3 dư.
(4) Cho K vào dung dịch Cu(NO3)2.
Sau khi kết thúc phản ứng, số thí nghiệm có tạo thành kim loại là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
(1) Cho AgNO3vào dung dịch Fe(NO3)2.
AgNO3+ Fe(NO3)2→ Fe(NO3)3+ Ag
(2) Dẫn NH3 qua ống đựng CuO nung nóng.
2NH3+ 3CuO  3Cu + N2+ 3H2O
3Cu + N2+ 3H2O
(3) Cho Al vào dung dịch Fe2(SO4)3 dư.
2Al + Fe2(SO4)3→ Al2(SO4)3+ 2Fe
(4) Cho K vào dung dịch Cu(NO3)2.
2K + 2H2O → 2KOH + H2↑
2KOH + Cu(NO3)2→ Cu(OH)2↓ + 2KNO3
→ Có 3 thí nghiệm tạo thành kim loại là: (1), (2), (3).
Câu 36:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Gọi số mol của M2CO3, MHCO3và MCl lần lượt là a, b, c (mol).
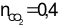 (mol) → a + b = 0,4 (mol).
(mol) → a + b = 0,4 (mol).
nMCl(Y)= nAgCl= 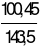 = 0,7 (mol) = 2a + b + c.
= 0,7 (mol) = 2a + b + c.
mX= (2M+60)×a + (M + 61)×b + (M + 35,5)×c = 32,65.
→ M×(2a + b + c) + 60×(a + b) + b + 35,5c = 32,65.
→ 0,7M + b + 35,5c = 8,65.
→ M < 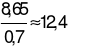 → M là kim loại Li (M = 7).
→ M là kim loại Li (M = 7).
Câu 37:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phương trình hóa học:
M(OH)2+ H2SO4→ MSO4+ 2H2O
111(mol)
Giả sử số mol M(OH)2là 1 (mol).
→ 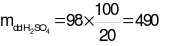 (gam).
(gam).
→ Khối lượng dung dịch sau phản ứng = 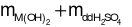
= M + 34 + 490 = (M + 524) (gam).
→ 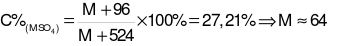
→ Kim loại M là Cu.
Câu 38:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Quá trình điện phân:
Tại catot (-): Cu2+;H+; H2O. | Tại anot (+): |
Cu2++ 2e → Cu 2H++ 2e → H2 2H2O + 2e → H2+ 2OH- | 2Cl-→ Cl2+ 2e 2H2O → O2+ 4H++ 4e |
Dung dịch thu được không có khả năng tạo kết tủa với dung dịch AgNO3.
→ Cl-điện phân hết.
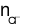
pH = 1 → [H+] = 0,1M → 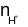 = 0,1 (mol) =
= 0,1 (mol) = 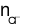 .
.
pH = 2 → [H+] = 0,01M → 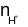 = 0,01 (mol).
= 0,01 (mol).
Bảo toàn e: 2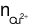 +
+ 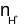 =
=  → 2
→ 2 + (0,1 – 0,01) = 0,1
+ (0,1 – 0,01) = 0,1
→  = 0,005 (mol).
= 0,005 (mol).
Câu 39:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
+) 2AgNO3 2Ag + 2NO2↑ + O2↑
2Ag + 2NO2↑ + O2↑
Thêm nước:
4NO2+ O2+ 2H2O → 4HNO3;
4HNO3+ 3Ag → 3AgNO3+ NO + 2H2O
+) 2Cu(NO3)2 2CuO + 4NO2↑ + O2↑
2CuO + 4NO2↑ + O2↑
Thêm nước:
4NO2+ O2+ 2H2O → 4HNO3;
8HNO3+ 3Cu → 3Cu(NO3)2+ 2NO↑ + 4H2O
+) MgCO3 MgO + CO2↑
MgO + CO2↑
Thêm nước không tạo lại được MgCO3.
+) CaCO3 CaO + CO2↑
CaO + CO2↑
Thêm nước lại: CaO + H2O → Ca(OH)2;
Ca(OH)2+ CO2→ CaCO3↓ + H2O
+) Ba(HCO3)2 BaCO3↓ + CO2↑ + H2O;
BaCO3↓ + CO2↑ + H2O;
Sau đó: BaCO3 BaO + CO2↑
BaO + CO2↑
Thêm nước: BaO + H2O → Ba(OH)2;
Ba(OH)2+ CO2→ BaCO3↓ + H2O
+) NH4HCO3 NH3+ CO2+ H2O
NH3+ CO2+ H2O
Thêm nước: NH3+ CO2+ H2O → NH4HCO3
+) NH4NO3 N2O + 2H2O
N2O + 2H2O
→ Thêm nước không tại lại được NH4NO3.
+) 2Fe(NO3)2 2FeO + 4NO2↑ + O2↑
2FeO + 4NO2↑ + O2↑
Thêm nước:
4NO2+ O2+ 2H2O → 4HNO3;
4HNO3+ Fe → Fe(NO3)3+ NO↑ + 2H2O
→ Thêm nước không tại lại được Fe(NO3)2.
→ Có 5 chất sau khi nung thêm nước có thể tạo lại chất ban đầu.
Câu 40:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
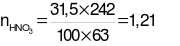 (mol).
(mol).
Ta có hệ phương trình:
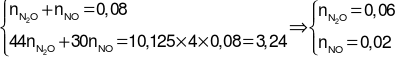 .
.
Ta có hệ phương trình:
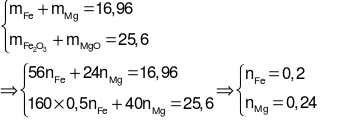 .
.
Sơ đồ phản ứng:
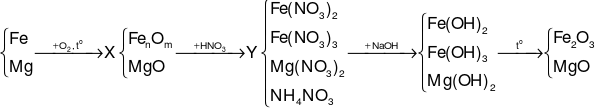 Coi hỗn hợp chất rắn X là: Fe, Mg và O.
Coi hỗn hợp chất rắn X là: Fe, Mg và O.
Gọi số mol NH4NO3và số mol O (trong X) lần lượt là a, b (mol).
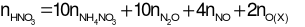
→ 1,21 = 10a + 10×0,06 + 4×0,02 + 2b.
→ 10a + 2b = 0,53 (1).
mmuối= m(Fe, Mg)+ 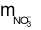 +
+ 
→ 16,96 + 62×(8×0,06 + 3×0,02 + 8a + 2b) + 80a = 82,2
→ 576a + 124b = 31,76 (2).
Từ (1) và (2) suy ra: a = 0,025, b = 0,14.
Gọi số mol Fe(NO3)2và Fe(NO3)3lần lượt là x, y (mol)
Ta có hệ phương trình:
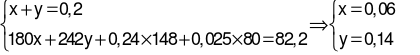 .
.
Khối lượng dung dịch sau phản ứng với HNO3bằng:
m(Fe, Mg)+ mO(X) + -
- 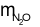 - mNO
- mNO
= 16,96 + 0,14×16 + 242 – 0,06×44 – 0,02×30 = 257,96 (gam).
→ 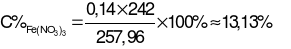 .
.
…….Hết……..

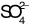 ; Cl-; H2O.
; Cl-; H2O.