ĐGNL ĐH Bách khoa - Vấn đề thuộc lĩnh vực hóa học - Aluminium và hợp chất của aluminium
-
342 lượt thi
-
32 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Vì sao những vật bằng nhôm hàng ngày tiếp xúc với nước dù ở nhiệt độ nào cũng không xảy ra phản ứng ?
 Xem đáp án
Xem đáp án
Trả lời:
Những vật bằng nhôm hàng ngày tiếp xúc với nước dù ở nhiệt độ nào cũng không xảy ra phản ứng vì trên bề mặt vật được phủ một lớp nhôm oxit mỏng, bền, ngăn cách vật với nước.
Đáp án cần chọn là: B
Câu 2:
Phản ứng hoá học nào dưới đây không thuộc loại phản ứng nhiệt nhôm ?
 Xem đáp án
Xem đáp án
Trả lời:
Phản ứng nhiệt nhôm là cho nhôm khử các oxit của kim loại =>Phản ứng hoá học không thuộc loại phản ứng nhiệt nhôm là Al tác dụng với axit H2SO4 đặc, nóng.
\[8Al + 3F{e_3}{O_4}\mathop \to \limits^{t^\circ } 4A{l_2}{O_3} + 9Fe\]
\[2Al + 3CuO\mathop \to \limits^{t^\circ } A{l_2}{O_3} + 3Cu\]
\[2Al + F{e_2}{O_3}\mathop \to \limits^{t^\circ } A{l_2}{O_3} + 2Fe\]
Đáp án cần chọn là: D
Câu 3:
Để giữ cho các đồ vật làm từ kim loại nhôm được bền, đẹp thì cần phải :
(1) Ngâm đồ vật trong nước xà phòng đặc, nóng, để làm sạch.
(2) Không nên cho đồ vật tiếp xúc với dung dịch nước chanh, giấm ăn.
(3) Dùng giấy nhám, chà trên bề mặt của vật, để vật được sạch và sáng.
(4) Bảo vệ bề mặt của vật như nhà thiết kế, sản xuất ban đầu.
Cách làm đúng là :
 Xem đáp án
Xem đáp án
Trả lời:
Để giữ cho các đồ vật làm từ kim loại nhôm được bền, đẹp thì cần phải :
(2) Không nên cho đồ vật tiếp xúc với dung dịch nước chanh, giấm ăn vì nhôm tác dụng với axit.
(4) Bảo vệ bề mặt của vật như nhà thiết kế, sản xuất ban đầu.
Đáp án cần chọn là: D
Câu 4:
Phản ứng nhiệt nhôm (đun nóng oxit kim loại với Al ở nhiệt độ cao) dùng điều chế những kim loại nào?
 Xem đáp án
Xem đáp án
Trả lời:
Al khử được những oxit kim loại yếu hơn nó
Loại A vì Mg mạnh hơn Al
Loại C vì Na mạnh hơn Al
Loại D vì Ca mạnh hơn Al
Đáp án cần chọn là: B
Câu 5:
Hỗn hợp X gồm Fe3O4 và Al có tỉ lệ mol tương ứng 1 : 3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
 Xem đáp án
Xem đáp án
Trả lời:
nFe3O4 = 1 mol =>nAl = 3 mol
PTHH: 3Fe3O4 + 8Al → 9Fe + 4Al2O3
1 → 8/3 → 3 → 4/3
=>sau phản ứng Al còn dư, hỗn hợp thu được gồm Al, Fe, Al2O3
Đáp án cần chọn là: B
Câu 6:
Trong số các phản ứng cho sau đây có mấy phản ứng viết sai :
1) 2Al + 3MgSO4 → Al2(SO4)3 + 3Mg.
2) Al + 6HNO3 đặc, nguội → Al(NO3)3 + 3NO2 + 3H2O.
3) 8Al + 5NaOH + 3NaNO3 + 2H2O → 8NaAlO2 + 3NH3
4) 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
5) 2Al + 2H2O + Ca(OH)2 → Ca(AlO2)2 + 3H2
 Xem đáp án
Xem đáp án
Trả lời:
(1) sai vì Mg mạnh hơn Al nên Al không đẩy được Mg ra khỏi dung dịch muối
(2) sai vì Al bị thụ động hóa tronh HNO3 đặc nguội
Đáp án cần chọn là: B
Câu 7:
Cho phản ứng:
Al + HNO3 → Al(NO3)3 + NO + N2O + H2O.
Biết tỉ lệ NO và N2O là 1 : 3. Hệ số cân bằng của phản ứng trên là :
 Xem đáp án
Xem đáp án
Trả lời:
9Al + 34HNO3 → 9Al(NO3)3 + NO + 3N2O + 17H2O
\[9x\left| {Al} \right. \to A{l^{3 + }} + 3e\]
\[1x\left| {7{N^{ + 5}}} \right. + 27e \to \mathop N\limits^{ + 2} O + 3\mathop {{N_2}}\limits^{ + 1} O\]
Đáp án cần chọn là: A
Câu 8:
Cho Al tác dụng với S, C ở nhiệt độ cao, lấy sản phẩm phản ứng trên cho tác dụng với H2O thì sản phẩm cuối cùng thu được là :
 Xem đáp án
Xem đáp án
Trả lời:
Ta có sơ đồ phản ứng sau:
\[Al + \left\{ {\begin{array}{*{20}{c}}S\\C\end{array}} \right.\mathop \to \limits^{t^\circ } \left\{ {\begin{array}{*{20}{c}}{A{l_2}{S_3}}\\{A{l_4}{C_3}}\end{array}} \right.\mathop \to \limits^{ + {H_2}O} \left\{ {\begin{array}{*{20}{c}}{Al{{\left( {OH} \right)}_3} \downarrow }\\{{H_2}S \uparrow }\\{C{H_4} \uparrow }\end{array}} \right.\]
Đáp án cần chọn là: A
Câu 9:
Điều nào sau đây không đúng ?
 Xem đáp án
Xem đáp án
Trả lời:
Câu không đúng là Al3+ bị khử bởi Na trong dung dịch AlCl3, vì Na phản ứng với nước trong dung dịch tạo NaOH
Đáp án cần chọn là: B
Câu 10:
Cho Al đến dư vào dung dịch gồm NO3-, Cu2+, Fe3+, Ag+. Số phản ứng xảy ra (không kể phản ứng của Al với H2O) là
 Xem đáp án
Xem đáp án
Trả lời:
Al + 3Ag+ → Al3+ + Ag
Al + 3Fe3+ → Al3+ + 3Fe2+
2Al + 3Cu2+ → 2Al3+ + 3Cu
2Al + 3Fe2+ → 2Al3+ + 3Fe
Đáp án cần chọn là: A
Câu 11:
Trong phản ứng của nhôm với dung dịch NaOH, chất oxi hóa nhôm là:
 Xem đáp án
Xem đáp án
Trả lời:
Trong phản ứng của nhôm với dung dịch NaOH, chất oxi hóa nhôm là H2O
Đáp án cần chọn là: B
Câu 12:
Cho hỗn hợp dạng bột hai kim loại Mg và Al vào dung dịch có hòa tan hai muối AgNO3 và Cu(NO3)2. Sau khi phản ứng kết thúc, thu được hỗn hợp hai kim loại và dung dịch D. Như vậy :
 Xem đáp án
Xem đáp án
Trả lời:
2 kim loại thu được là Ag và Cu
=>Mg và Al phản ứng hết
=>dung dịch D chứa Mg(NO3)2, Al(NO3)3 và có thể còn Cu(NO3)2 dư
Đáp án cần chọn là: B
Câu 13:
Cho Al lần lượt vào các dung dịch : H2SO4 loãng, HNO3 (đậm đặc, to), Ba(OH)2, HNO3 loãng, H2SO4 đặc, thấy sinh ra khí B có tỉ khối so với O2 nhỏ hơn 0,8. Số dung dịch có thể phù hợp là :
 Xem đáp án
Xem đáp án
Trả lời:
MB < 32.0,8 = 25,6
Al + H2SO4 loãng → H2 (thỏa mãn)
Al + HNO3 đặc, to → NO2 (loại)
Al + Ba(OH)2 → H2 (thỏa mãn)
Al + HNO3 loãng → N2 hoặc N2O hoặc NO tất cả khối lượng mol của chúng đều ≥ 28 không thỏa mãn
Al + H2SO4 đặc, to → SO2 (hoặc H2S) loại
Đáp án cần chọn là: A
Câu 14:
Nung nóng hỗn hợp Al và Fe2O3 (chỉ xảy ra phản ứng nhiệt nhôm đến hoàn toàn) thu được hỗn hợp X. Cho X tác dụng dung dịch NaOH thấy có khí thoát ra. Thành phần X gồm :
 Xem đáp án
Xem đáp án
Trả lời:
Phản ứng nhiệt nhôm: 2Al + Fe2O3 → Al2O3 + 2Fe
X tác dụng với dung dịch NaOH sinh ra khí =>trong X chứa Al
=>Al còn dư sau phản ứng
=>X gồm Al2O3, Fe và Al dư
Đáp án cần chọn là: B
Câu 15:
Cho các kim loại Na, Ca, Al, Fe. Chỉ dùng nước cất có thể nhận biết được mấy kim loại ?
 Xem đáp án
Xem đáp án
Trả lời:
Nhận biết được cả 4 kim loại :
| Na | Ca | Al | Fe |
H2O | Sủi bọt khí, tạo dung dịch trong suốt | Sủi bọt khí, tạo dung dịch vẩn đục | Không hiện tượng | Không hiện tượng |
NaOH |
|
| Sủi bọt khí | Không hiện tượng |
Đáp án cần chọn là: B
Câu 16:
Cho các kim loại: Ba, Mg, Al, Fe, Ag. Chỉ dùng dung dịch H2SO4 loãng sẽ nhận biết được bao nhiêu kim loại?
 Xem đáp án
Xem đáp án
Trả lời:
| Ba | Mg | Al | Fe | Ag |
H2SO4 loãng | Sủi bọt khí, tạo kết tủa trắng | Sủi bọt, tạo dung dịchh trong suốt | Sủi bọt, tạo dung dịch trong suốt. | Sủi bọt, tạo dung dịch trong suốt | Không hiện tượng |
Ba(OH)2 |
| Kết tủa trắng, không tan | Kết tủa trắng, tan dần | Kết tủa trắng xanh |
|
=>nhận biết được cả 5 kim loại
Đáp án cần chọn là: A
Câu 17:
Có 3 mẫu hợp kim Fe – Al, K – Na, Cu – Mg. Có thể dùng dung dịch nào dưới đây có thể phân biệt 3 mẫu hợp kim trên ?
 Xem đáp án
Xem đáp án
Trả lời:
- dùng dung dịch NaOH
| Fe - Al | K - Na | Cu – Mg |
NaOH | Tan 1 phần, sủi bọt khí | Tan hoàn toàn, sủi bọt khí | Không tan |
Đáp án cần chọn là: B
Câu 18:
Trong các ứng dụng được cho là của nhôm dưới đây, có mấy ứng dụng chưa chính xác ?
(1) Làm vật liệu chế tạo ôtô, máy bay, tên lửa, tàu vũ trụ;
(2) Sản xuất thiết bị điện (dây điện điện), trao đổi nhiệt (dụng cụ đun nấu).
(3) Sản xuất, điều chế các kim loại quí hiếm (Au, Pt, Ag).
(4) Trang trí nội thất và mạ đồ trang sức.
(5) Chế tạo hỗn hợp tecmit, được dùng để hàn gắn đường ray.
 Xem đáp án
Xem đáp án
Trả lời:
Al không dùng để sản xuất, điều chế các kim loại quí hiếm (Au, Pt, Ag); Trang trí nội thất và mạ đồ trang sức.
Đáp án cần chọn là: A
Câu 19:
Cho hỗn hợp gồm BaO, FeO, Al2O3 vào nước dư thu được dung dịch A và phần không tan B. B tan một phần trong dung dịch NaOH. Dung dịch A có chứa :
 Xem đáp án
Xem đáp án
Trả lời:
Vì B tan 1 phần trong dung dịch NaOH =>B có Al2O3
=>Ba(OH)2 hết, Al2O3 dư
=>dung dịch A chứa Ba(AlO2)2
Đáp án cần chọn là: D
Câu 20:
Cho bốn hỗn hợp, mỗi hỗn hợp gồm hai chất rắn có số mol bằng nhau: Na2O và Al2O3; Cu và Fe2(SO4)3; BaCl2 và CuCl2 ; Ba và NaHSO4. Số hỗn hợp có thể tan hoàn toàn trong nước (dư) chỉ tạo ra dung dịch là
 Xem đáp án
Xem đáp án
Trả lời:
1) Na2O và Al2O3
nNaOH = 2nNa2O = 2 mol
2NaOH + Al2O3 + 3H2O → 2Na[Al(OH)4]
2 mol 1 mol
=>hỗn hợp tan hết
2) Cu và Fe2(SO4)3
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
1 mol 1 mol
=>hỗn hợp tan hết
3) BaCl2 và CuCl2 : hỗn hợp tan hết
4) Ba và NaHSO4
Ba(OH)2 + NaHSO4 → BaSO4 ↓ + NaOH + H2O
Hỗn hợp tan tạo kết tủa và khí H2
=>có 3 hỗn hợp hòa tan vào nước chỉ tạo thành dung dịch
Đáp án cần chọn là: D
Câu 21:
Có các hỗn hợp chất rắn
(1) FeO, BaO, Al2O3 (tỉ lệ mol 1: 1 : 1)
(2) Al, K, Al2O3 (tỉ lệ mol 1: 2: 1)
(3) Na2O, Al (tỉ lệ mol 1: 1)
(4) K2O, Zn (tỉ lệ mol 1: 1)
Số hỗn hợp tan hết trong nước (dư) là :
 Xem đáp án
Xem đáp án
Trả lời:
(1) không tan hết vì có FeO
(2) 2K+2H2O→2KOH+H22K+2H2O→2KOH+H2
=>nKOH = nK = 2 mol
= >Tổng số mol KOH phản ứng với Al và Al2O3 là 1+ 2 = 3 mol >nKOH ban đầu
=>hỗn hợp không tan hết
(3) nNaOH = 2nNa2O = 2 mol
Vì nNaOH >nAl =>hỗn hợp tan hết
(4) nKOH = 2nK2O = 2 mol
2KOH + Zn → K2ZnO2 + H2
2 mol 1 mol
=>hỗn hợp tan hết
Nhận xét: nếu nK ⩾ nAl hoặc nK ⩾ 2nZn thì hỗn hợp tan hết
Đáp án cần chọn là: D
Câu 22:
Có 3 chất rắn: Mg, Al, Al2O3 đựng trong 3 lọ mất nhãn. Chỉ dùng một thuốc thử nào sau đây có thể nhận biết được mỗi chất ?
 Xem đáp án
Xem đáp án
Trả lời:
- dùng dung dịch NaOH
- Al tan có xuất hiện khí
2Al + 2H2O + 2NaOH → 3H2 + 2NaAlO2
- Al2O3 tan
Al2O3 + 2NaOH → H2O + 2NaAlO2
- Mg không hiện tượng
Đáp án cần chọn là: D
Câu 23:
Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là :
 Xem đáp án
Xem đáp án
Trả lời:
Hiện tượng xảy ra là: có kết tủa keo trắng, sau đó kết tủa tan
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
NaOH + Al(OH)3 → Na[Al(OH)4]
Đáp án cần chọn là: B
Câu 24:
Cho hai thí nghiệm (TN) :
TN1 cho từ từ đến dư dung dịch HCl vào dung dịch NaAlO2.
TN2 cho từ từ đến dư khí CO2 vào dung dịch NaAlO2.
Hiện tượng quan sát được là :
 Xem đáp án
Xem đáp án
Trả lời:
TN1: Cho dung dịch HCl vào dung dịch NaAlO2
HCl + NaAlO2 + H2O → NaCl + Al(OH)3 ↓
HCl dư: Al(OH)3 + 3HCl → AlCl3 + 3H2O
TN2: Cho đến dư khí CO2 vào dung dịch NaAlO2
NaAlO2 + CO2 + H2O → NaHCO3 + Al(OH)3 ↓
Dư CO2, kết tủa không bị hòa tan
Đáp án cần chọn là: C
Câu 25:
Thí nghiệm nào sau đây có kết tủa sau phản ứng ?
 Xem đáp án
Xem đáp án
Đáp án đúng: D
Phương pháp giải
xem lại lí thuyết hợp chất nhôm
Hợp chất của nhôm --- Xem chi tiết
Xem lời giải
Lời giải của GV Vungoi.vn
A không thu được kết tủa vì Cr(OH)3 tan trong dung dịch kiềm
B không thu được kết tủa vì Al(OH)3 sinh ra tan trong HCl
C sai vì CO2 dư thu được muối Ca(HCO3)2
D đúng vì Al(OH)3 không tan trong NH3
Đáp án cần chọn là: D
Câu 26:
Cho các chất : Al, Al2O3, Al2(SO4)3, Zn(OH)2, NaHS, KHSO3, (NH4)2CO3. Số chất đều phản ứng được với dung dịch HCl, dung dịch NaOH là :
 Xem đáp án
Xem đáp án
Trả lời:
Các chất vừa phản ứng được với dung dịch HCl, vừa phản ứng với NaOH là Al, Al2O3, Zn(OH)2, NaHS, KHSO3, (NH4)2CO3
Đáp án cần chọn là: D
Câu 27:
Hoà tan m gam hỗn hợp gồm Al, Fe vào dung dịch H2SO4 loãng (dư). Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X. Cho dung dịch Ba(OH)2 (dư) vào dung dịch X, thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi, thu được chất rắn Z là :
 Xem đáp án
Xem đáp án
Trả lời:
\[\left\{ {\begin{array}{*{20}{c}}{Al}\\{Fe}\end{array}} \right.\mathop \to \limits^{ + {H_2}S{O_4}} ddX\left\{ {\begin{array}{*{20}{c}}{A{l_2}{{\left( {S{O_4}} \right)}_3}}\\{FeS{O_4}}\end{array}} \right.\mathop \to \limits^{Ba{{\left( {OH} \right)}_2}} \downarrow Y\]
\[\left\{ {\begin{array}{*{20}{c}}{Fe{{\left( {OH} \right)}_2}}\\{BaS{O_4}}\end{array}} \right.\mathop \to \limits^{ + {O_2},t^\circ } Z\left\{ {\begin{array}{*{20}{c}}{F{e_2}{O_3}}\\{BaS{O_4}}\end{array}} \right.\]
Đáp án cần chọn là: B
Câu 28:
Cho Na vào dung dịch chứa Al2(SO4)3 và CuSO4 thu được khí (A), dung dịch (B) và kết tủa (C). Nung kết tủa (C) thu được chất rắn (D). Cho khí (A) dư tác dụng với rắn (D) thu được rắn (E). Hoà tan (E) trong HCl dư thu được rắn (F). Rắn (F) là :
 Xem đáp án
Xem đáp án
Trả lời:
Cho Na vào dung dịch xảy ra phản ứng:
2Na + 2H2O → 2NaOH + H2
Al2(SO4)3 + 3NaOH → Al(OH)3 + Na2SO4
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Al(OH)3 + NaOH → Na[Al(OH)4]
=>A là khí H2
=>dung dịch B chứa Na2SO4 và có thể có Na[Al(OH)4]
Kết tủa C là Cu(OH)2 và có thể có Al(OH)3
Nung C =>rắn D: CuO, Al2O3
Sơ đồ phản ứng:
\[NaOH + \left\{ {\begin{array}{*{20}{c}}{A{l_2}S{O_4}}\\{CuS{O_4}}\end{array}} \right.\]
\[ \to \left\{ {\begin{array}{*{20}{c}}{dd\left( B \right):N{a_2}S{O_4},Na\left[ {Al{{\left( {OH} \right)}_4}} \right]}\\{ \downarrow \left( C \right):Cu{{\left( {OH} \right)}_2},Al{{\left( {OH} \right)}_3}\mathop {\mathop \to \limits^{t^\circ } \left( D \right):CuO,A{l_2}{O_3}\mathop \to \limits^{ + {H_2},t^\circ } \left( E \right):Cu,A{l_2}{O_3}}\limits^{} }\\{\mathop { \to \left( F \right)Cu}\limits^{ + HCl} }\end{array}} \right.\]
Đáp án cần chọn là: D
Câu 29:
Cho chuỗi biến hóa sau :
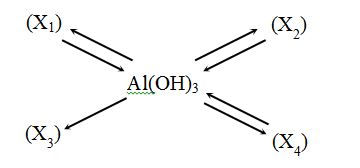
Vậy X1, X2, X3, X4 lần lượt là :
 Xem đáp án
Xem đáp án
Trả lời:
Vì Al(OH)3 tạo ra X3 mà X3 không tạo được ra Al(OH)3 =>X3 là Al2O3
Đáp án cần chọn là: A
Câu 30:
Hòa tan hết a mol Al vào dung dịch chứa 2a mol NaOH thu được dung dịch X. Kết luận nào sau đây đúng?
 Xem đáp án
Xem đáp án
Trả lời:
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
a a a
=>dung dịch X chứa a mol NaAlO2 và a mol NaOH
A.Sục CO2 dư vào dung dịch thu được:
CO2 + NaAlO2 + 2H2O → Al(OH)3 ↓ + NaHCO3
a a a
NaOH + CO2 → NaHCO3
=>sau phản ứng thu được a mol kết tủa
B sai vì X chứa NaOH phản ứng được với dung dịch CuSO4
C. thêm 2a mol HCl vào X
NaOH + HCl → NaCl + H2O
a a
NaAlO2 + HCl + H2O → NaCl + Al(OH)3
a a a
=>thu được a mol kết tủa
D sai vì dung dịch X làm quỳ chuyển xanh
Đáp án cần chọn là: A
Câu 31:
Các hidroxit: Ba(OH)2, NaOH, Al(OH)3, Fe(OH)3 được kí hiệu ngẫu nhiên là X, Y, Z, T. Kết quả thí nghiệm của X, Y, Z, T được ghi ở bảng sau:
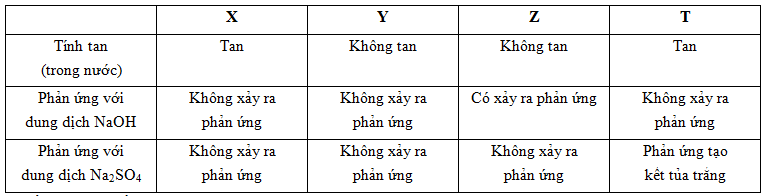
Chất X, Y, Z, T lần lượt là:
 Xem đáp án
Xem đáp án
Trả lời:
- Y, Z không tan trong nước =>Al(OH)3 và Fe(OH)3
+ Z tan trong NaOH =>Z là Al(OH)3 (PTHH: Al(OH)3 + NaOH → NaAlO2 + 2H2O)
+ Y là Fe(OH)3
- Z, T tan trong nước =>Ba(OH)2, NaOH
+ T + H2SO4 tạo kết tủa trắng =>T là Ba(OH)2 (PTHH: Ba(OH)2 + H2SO4 → BaSO4 + 2H2O)
+ X là NaOH
Đáp án cần chọn là: C
Câu 32:
Dân gian xưa kia dùng phèn chua làm thuốc chữa đau răng, đau mắt, cầm máu và đặc biệt dùng làm trong nước. Nguyên nhân nào sau đây làm cho phèn chua có khả năng làm trong nước :
 Xem đáp án
Xem đáp án
Trả lời:
Phèn chua có công thức là KAl(SO4)2.12H2O khi hòa vào nước thì phân ly ra Al3+
Sau đó có phản ứng : Al3+ + 3OH- → Al(OH)3 (kết tủa keo sẽ kéo các hạt bụi bẩn trong nước lắng xuống, từ đó làm trong nước)
Đáp án cần chọn là: C
