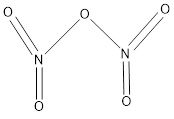
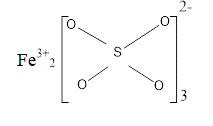
Trắc nghiệm tổng hợp Hóa học năm 2023 có đáp án (Phần 1)
-
1806 lượt thi
-
51 câu hỏi
-
90 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Lời giải:
K2SO4 không tác dụng với NaOH, do không thoả mãn điều kiện xảy ra phản ứng trao đổi.
Câu 2:
Cho 5 mol N2 và 12 mol H2 vào bình kín. Tại thời điểm cân bằng thu được 13 mol hỗn hợp khí. Hiệu suất của phản ứng tổng hợp NH3 là
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
Phương trình hoá học:
3H2 + N2 2NH3
Ban đầu: 12 5 0 mol
Phản ứng: 3x x 2x mol
Cân bằng: (12 – 3x) (5 – x) 2x mol
Tại thời điểm cân bằng thu được 13 mol khí.
Þ (12 – 3x) + (5 – x) + 2x = 13 Þ x = 2 (mol).
Giả sử H = 100% thì H2 hết, do đó hiệu suất phản ứng tính theo H2.
Vậy H = \[\frac{{3x}}{{12}}.100\% = \frac{{3.2}}{{12}}.100\% = 50\% .\]
Câu 3:
Hòa tan 21,1 gam hỗn hợp A gồm Zn và ZnO bằng 200 gam dung dịch HCl (vừa đủ) thu được dung dịch B và 4,48 lít khí H2.
a. Xác định phần trăm mỗi chất có trong hỗn hợp A.
b. Tính khối lượng muối có trong dung dịch B.
 Xem đáp án
Xem đáp án
Lời giải:
a. \[{n_{{H_2}}} = \frac{{4,48}}{{22,4}} = 0,2(mol)\]
PTHH: Zn + 2HCl → ZnCl2 + H2 (1)
ZnO + 2HCl → ZnCl2 + H2O (2)
Theo PTHH (1): \[{n_{Zn}} = {n_{{H_2}}} = 0,2(mol)\]→ mZn = 0,2. 65 = 13 (g)
Phần trăm mỗi chất có trong hỗn hợp A là:
\[\% {m_{Zn}} = \frac{{13}}{{21,1}}.100\% = 61,61\% \]
%mZnO = 100% - 61,61% = 38,39%
b. mZnO = 21,1 – 13 = 8,1 (g)
→ \[{n_{ZnO}} = \frac{{8,1}}{{81}} = 0,1(mol)\]
Theo PTHH (1) và (2): \[{n_{ZnC{l_2}}} = {n_{Zn}} + {n_{ZnO}} = 0,2 + 0,1 = 0,3(mol)\]
→ \[{m_{ZnC{l_2}}} = 0,3.136 = 40,8(g)\]
Vậy khối lượng muối có trong dung dịch B là 40,8 gam.
Câu 4:
 Xem đáp án
Xem đáp án
Lời giải:
nNaOH = 0,25. 4 = 1 (mol)
\[{n_{A{l_2}{{(S{O_4})}_3}}} = 0,05.2 = 0,1(mol)\]
Phương trình hoá học:
6NaOH + Al2(SO4)3 → 3Na2SO4 + 2Al(OH)3↓ (1)
Lập tỉ lệ: \[\frac{1}{6} > \frac{{0,1}}{1}\]→ NaOH dư
Theo phương trình hoá học (1):
- \[{n_{Al{{(OH)}_3}}} = 2{n_{A{l_2}{{(S{O_4})}_3}}} = 2.0,1 = 0,2(mol)\]
- nNaOH (phản ứng) = \[6{n_{A{l_2}{{(S{O_4})}_3}}} = 6.0,1 = 0,6(mol)\]→nNaOH (dư) = 1 – 0,6 = 0,4 (mol)
Phương trình hoá học:
NaOH + Al(OH)3 → NaAlO2 + 2H2O (2)
\[{n_{NaOH}} > {n_{Al{{(OH)}_3}}}\]→ Kết tủa Al(OH)3 tan hoàn toàn, dung dịch sau phản ứng gồm các chất tan NaOH dư, Na2SO4 và NaAlO2.
Vậy khối lượng kết tủa sau phản ứng bằng 0.
Câu 5:
 Xem đáp án
Xem đáp án
Lời giải
Đáp án đúng là: C
\[{n_{NaOH}} = \frac{{44}}{{40}} = 1,1(mol)\]
\[{n_{{H_3}P{O_4}}} = \frac{{39,2}}{{98}} = 0,4(mol)\]
Ta có: \[\frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{{1,1}}{{0,4}} = 2,75\]
→Tạo muối \[\left\{ \begin{array}{l}HPO_4^{2 - }\\PO_4^{3 - }\end{array} \right.\]hay \[\left\{ \begin{array}{l}N{a_2}P{O_4}:a(mol)\\N{a_3}P{O_4}:b(mol)\end{array} \right.\]
Bảo toàn Na: 2a + 3b = 1,1 (1)
Bảo toàn P: a + b = 0,4 (2)
Giải (1) và (2) →\[\left\{ \begin{array}{l}a = 0,1\\b = 0,3\end{array} \right.\]
→14,2 gam Na2HPO4 và 49,2 gam Na3PO4.
Câu 6:
Cân bằng phương trình hoá học sau:
CnH2n-2 + O2 \[ - - - \to \] CO2 + H2O
 Xem đáp án
Xem đáp án
Lời giải:
Bước 1: Cân bằng C
Vế trái có n nguyên tử C, vế phải có 1 nguyên tử C nên thêm n vào CO2 và 1 vào CnH2n-2 (thường số 1 ta sẽ không ghi để cho đỡ phức tạp).
CnH2n-2 + O2 \[ - - - \to \] nCO2 + H2O
Bước 2: Cân bằng H
Vế trái có (2n – 2) nguyên tử H, vế phải có 2 nguyên tử H nên thêm (n – 1) vào H2O
CnH2n-2 + O2 \[ - - - \to \] nCO2 + (n – 1)H2O
Bước 3: Tổng số O bên vế phải là 2.n trong CO2 và (n – 1) trong H2O, tức bằng
(2.n + n – 1) = (3n – 1) nguyên tử O. Vế trái có 2 nguyên tử O, thêm \[\frac{{3n - 1}}{2}\] vào O2
\[{C_n}{H_{2n - 2}} + (\frac{{3n - 1}}{2}){O_2} \to \;nC{O_2} + \left( {n--1} \right){H_2}O\].
Câu 7:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
Gọi A là nguyên tố cần tìm, đồng thời A là khối lượng mol của nguyên tố đó
Vì A có hoá trị II nên công thức oxit của A với oxi sẽ là AO
Theo đề ra, ta có:
\[\% {m_O} = 28,57\% \Leftrightarrow \frac{{16}}{{16 + A}}.100 = 28,57 \to A = 40\]
Vậy nguyên tố cần tìm là canxi (Ca).
Câu 8:
 Xem đáp án
Xem đáp án
Lời giải: Canxi nitrat có công thức hoá học Ca(NO3)2 cho biết:
- Hợp chất được tạo nên từ 3 nguyên tố là canxi (Ca), nitơ (N), oxi (O)
- Trong 1 phân tử Ca(NO3)2 có: 1 nguyên tử Ca, 2 nguyên tử N và 6 nguyên tử O.
- PTK Ca(NO3)2 = 40 + (14 + 16. 3). 2 = 164 đvC.
Câu 9:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Gọi chung các ion \[CO_3^{2 - }\], \[SO_3^{2 - }\], \[SO_4^{2 - }\] là \[{Y^{2 - }}\]
Bảo toàn điện tích cho A: \[2{n_{{Y^{2 - }}}} + 0,1.1 = 0,3.1 \to {n_{{Y^{2 - }}}} = 0,1\] (mol)
Cho Ba(OH)2 vào A xảy ra phản ứng sau:
\[HCO_3^ - + O{H^ - } \to CO_3^{2 - } + {H_2}O\]
Theo PTHH trên: \[{n_{CO_3^{2 - }}} = {n_{HCO_3^ - }} = 0,1(mol)\]
Lúc này tổng số mol các ion \[CO_3^{2 - }\], \[SO_3^{2 - }\], \[SO_4^{2 - }\] là 0,1 + 0,1 = 0,2 (mol)
PTHH: \[{Y^{2 - }} + B{a^{2 + }} \to BaY\]
Theo PTHH trên: \[{n_{B{a^{2 + }}}} = {n_{{Y^{2 - }}}} = 0,2(mol)\]
\[ \to {n_{Ba{{(OH)}_2}}} = 0,2(mol) \to {V_{{\rm{dd}}Ba{{(OH)}_2}}} = \frac{{0,2}}{1} = 0,2(l)\]
Câu 10:
 Xem đáp án
Xem đáp án
Lời giải:
\[{H_2}S{O_4} \to 2{H^ + } + SO_4^{2 - }\]
0,1.………0,2…..0,1 (mol)
HCl → H+ + Cl-
0,2…..0,2….0,2 (mol)
NaOH → Na+ + OH-
0,3……...0,3…..0,3 (mol)
Ca(OH)2 → Ca2+ + 2OH-
0,05………0,05…..0,1 (mol)
\[{n_{{H^ + }}} = 0,2 + 0,2 = 0,4(mol)\]
\[{n_{O{H^ - }}} = 0,3 + 0,1 = 0,4(mol)\]
Khi đổ hỗn hợp axit và hỗn hợp kiềm thì xảy ra phản ứng sau:
H+ + OH- → H2O
0,4…0,4 (mol)
Vậy dung dịch sau phản ứng có 0,1 mol \[SO_4^{2 - }\], 0,2 mol Cl-, 0,3 mol Na+, 0,05 mol Ca2+. Khối lượng muối tạo thành là:
mmuối = 0,1. 96 + 0,2. 35,5 + 0,3. 23 + 0,05. 40 = 25,6 (g).
Câu 11:
 Xem đáp án
Xem đáp án
Lời giải:
Khi trộn Na3PO4 vào dung dịch HCl thì sẽ có những phản ứng là:
Na3PO4 + HCl → Na2HPO4 + NaCl
Na3PO4 + 2HCl → NaH2PO4 + 2NaCl
Na3PO4 + 3HCl → H3PO4 + 3NaCl.
Câu 12:
Cho 34,8g hỗn hợp kim loại gồm Al, Fe, Cu thành hai phần bằng nhau.
- Phần 1: Cho vào dung dịch HNO3 đặc nguội thu được 4,48 lít khí NO2 ở đktc.
- Phần 2: Cho vào dung dịch HCl dư thu được 8,96 lít khí H2 (đktc).
Xác định khối lượng Al, Fe trong hỗn hợp ban đầu.
 Xem đáp án
Xem đáp án
Lời giải:
Chia hỗn hợp làm 2 phần bằng nhau nên khối lượng hỗn hợp kim loại ở mỗi phần là \[\frac{{34,8}}{2} = 17,4(g)\]
Phần 1: Ta có: Fe và Al thụ động với HNO3 đặc, nguội nên chỉ có Cu phản ứng theo phương trình hoá học: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O (1)
Theo đề bài ra: \[{n_{N{O_2}}} = \frac{{4,48}}{{22,4}} = 0,2(mol)\]
Theo PTHH (1): \[{n_{Cu}} = \frac{1}{2}{n_{N{O_2}}} = \frac{1}{2}.0,2 = 0,1(mol)\]
→mCu = 0,1. 64 = 6,4 (g)
Phần 2: Cho hỗn hợp kim loại vào dung dịch HCl, Cu không phản ứng, Fe, Al phản ứng theo các PTHH sau:
Fe + 2HCl→ FeCl2 + H2 (2)
2Al + 6HCl → 2AlCl3 + 3H2 (3)
Gọi số mol của Fe, Al trong mỗi phần lần lượt là x, y (mol; x,y > 0)
Vì mCu = 6,4 (g) → mFe + mAl = 17,4 – 6,4 = 11 → 56. x + 27. y = 11 (*)
Theo PTHH (2) \[{n_{{H_2}}} = {n_{Fe}} = x(mol)\]
Theo PTHH (3): \[{n_{{H_2}}} = \frac{3}{2}{n_{Al}} = \frac{3}{2}y(mol)\]
Mà \[{n_{{H_2}}} = \frac{{8,96}}{{22,4}} = 0,4(mol)\]→ \[x + \frac{3}{2}y = 0,4\](**)
Giải hệ (*), (**), ta được: x = 0,1; y = 0,2
Vậy khối lượng Al, Fe trong hỗn hợp đầu là:
mAl = 0,2. 27. 2 = 10,8 (g); mFe = 0,1. 56. 2 = 11,2 (g)
Câu 13:
 Xem đáp án
Xem đáp án
Lời giải:
Gọi phân lớp electron ngoài cùng của A là \[3{p^x}\] (0 < x < 6), còn B là 4sy (0 < y < 2).
Ta có:
- Tổng số electron của 2 phân lớp bằng 6 → x + y = 6 (*)
- Hiệu số electron của 2 phân lớp bằng 4 → x – y = 4 (**)
Giải hệ (*), (**), ta được: x = 5, y = 1
Cấu hình electron của A là: 1s22s22p63s23p5 → ZA = 17 → Tên nguyên tố A là clo.
Cấu hình electron của B là 1s22s22p63s23p64s1 → ZB = 19 → Tên nguyên tố B là kali
Câu 14:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
Gọi hoá trị của kim loại M là n (\[1 \le n \le 3\]), M là khối lượng mol của kim loại M.
Phương trình hoá học:
2M + nH2SO4 → M2(SO4)n + nH2
Theo PTHH: Cứ 2 mol M → 1 mol M2(SO4)n
Hay: 2M (g) → (2M + 96n) (g) tăng 96n gam
Theo đề bài: m (g) → 5m (g) tăng 4m gam
→ 2M. 4m = m. 96n → 12n = M
Lập bảng:
|
n |
1 |
2 |
3 |
|
M |
12 (Loại) |
24 (Nhận) |
36 (Loại) |
Câu 15:
Một hợp chất A có phân tử gồm một nguyên tử X và 3 nguyên tử Y, tỉ lệ khối lượng X và Y trong A là 2: 3, phân tử khối của hợp chất A là 80 đvC.
a) Xác định công thức hóa học của hợp chất A.
b) Tìm % về khối lượng của nguyên tố X trong hợp chất A.
 Xem đáp án
Xem đáp án
Lời giải:
a) Một hợp chất A có phân tử gồm một nguyên tử X và 3 nguyên tử Y nên A có công thức hoá học dạng XY3
- Tỉ lệ khối lượng X và Y trong A là 2: 3 nên \[\frac{{{m_X}}}{{{m_Y}}} = \frac{{{M_X}}}{{3{M_Y}}} = \frac{2}{3} \to {M_X} = 2{M_Y}\] (1)
- Phân tử khối của hợp chất A là 80 đvC → MX + 3MY = 80 (2)
Thay (1) vào (2) ta được: MY = 16 (g/mol) → Y là oxi (O), MX = 32 (g/mol) → X là lưu huỳnh (S). Vậy công thức hoá học của A là SO3.
b) % về khối lượng của nguyên tố X (lưu huỳnh) trong hợp chất A là:
\[\% {m_S} = \frac{{32}}{{80}}.100\% = 40\% \]
Câu 16:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Ca2+ + 2\[NO_3^ - \] → Ca(NO3)2
0,03….0,06…….0,03 (mol)
2Al3+ + 3\[SO_4^{2 - }\] → Al2(SO4)3
0,06……0,09…….0,03 (mol)
Vậy muốn có dung dịch A cần phải hòa tan hai muối: 0,03 mol Ca(NO3)2 và 0,03 mol Al2(SO4)3
Câu 17:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Ta có, gọi % số nguyên tử của đồng vị 63Cu là x (0 < x < 100%) thì % đồng vị 65Cu là 100 – x.
Nguyên tử khối trung bình của đồng là 63,546 nên:
\[\frac{{63.x + 65.(100 - x)}}{{100}} = 63,546\]→ x = 72,7
Vậy thành phần phần trăm theo số nguyên tử của 65Cu là 27,3%.
Câu 18:
Chia hỗn hợp Cu và Al làm 2 phần bằng nhau:
- Phần 1: Tác dụng với dung dịch HNO3 đặc, nguội thì thu được 17,92 lít NO2 (đktc)
- Phần 2: Tác dụng với dung dịch HCl thì có 13,44 lít khí H2 (đktc) thoát ra.
a) Tính khối lượng mỗi kim loại trong hỗn hợp đầu.
b) Xác định phần trăm về khối lượng mỗi kim loại trong hỗn hợp?
 Xem đáp án
Xem đáp án
Lời giải:
Phần 1: Hỗn hợp tác dụng với dung dịch HNO3 đặc, nguội thì Al bị thụ động (không phản ứng), Cu phản ứng theo PTHH:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O (1)
\[{n_{N{O_2}}} = \frac{{17,92}}{{22,4}} = 0,8(mol)\]
Theo PTHH (1): \[{n_{Cu}} = \frac{1}{2}{n_{N{O_2}}} = \frac{1}{2}.0,8 = 0,4(mol)\]→ mCu = 0,4. 64 = 25,6 (g)
Phần 2: Cho hỗn hợp tác dụng với dung dịch HCl thì Cu không phản ứng, Al phản ứng theo PTHH:
2Al + 6HCl → 2AlCl3 + 3H2 (2)
\[{n_{{H_2}}} = \frac{{13,44}}{{22,4}} = 0,6(mol)\]
Theo PTHH (2): \[{n_{Al}} = \frac{2}{3}{n_{{H_2}}} = \frac{2}{3}.0,6 = 0,4(mol)\]→ nAl = 0,4. 27 = 10,8 (g)
a) Khối lượng mỗi kim loại trong hỗn hợp đầu là:
mAl = 10,8. 2 = 21,6 (g)
mCu = 25,6. 2 = 51,2 (g)
b) mhỗn hợp = mAl + mCu = 21,6 + 51,2 = 72,8 (g)
Phần trăm về khối lượng mỗi kim loại trong hỗn hợp là:
\[\% {m_{Al}} = \frac{{21,6}}{{72,8}}.100\% = 29,67\% \].
%mCu = 100% - 29,67% = 70, 33%.
Câu 19:
 Xem đáp án
Xem đáp án
Lời giải
Đáp án đúng là: D
\[{V_{{O_2}}} = \frac{{4,48}}{{22,4}} = 0,2(mol)\]
\[{m_{{O_2}}} = 0,2.32 = 6,4(g)\]
Câu 20:
 Xem đáp án
Xem đáp án
Lời giải:
Khi hấp thụ hoàn toàn lượng khí SO2 trong 600 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thu được 35,5 gam chất rắn khan thì có 2 trường hợp xảy ra:
Trường hợp 1: 35,5 gam chất rắn gồm: NaHSO3 (a mol), Na2SO3 (b mol)
Ta có: \[\left\{ {\begin{array}{*{20}{c}}{104a + 126b = 35,5}\\{a + 2b = {n_{NaOH}} = 0,6}\end{array} \to \left\{ \begin{array}{l}a = 1,8\\b = - 1,2\end{array} \right.} \right.\] (Loại)
Trường hợp 2: 35,5 gam chất rắn gồm: Na2SO3 (x mol), NaOH dư (y mol)
Ta có: \[\left\{ {\begin{array}{*{20}{c}}{126x + 40y = 35,5}\\{2x + 2y = {n_{NaOH}} = 0,6}\end{array} \to \left\{ \begin{array}{l}x = 0,25\\y = 0,1\end{array} \right.} \right.\]
Suy ra: \[{n_{S{O_2}}} = {n_{N{a_2}S{O_3}}} = 0,25(mol)\]\[ \to {V_{S{O_2}}} = 0,25.22,4 = 5,6(l)\]
Gọi kim loại trong oxit cần tìm là R, hoá trị n (\[1 \le n \le 3\]), R là khối lượng mol của kim loại R.
Khi oxit kim loại hoà tan trong lượng dư dung dịch H2SO4 đặc, nóng thu được muối là R2(SO4)n
Trong oxit kim loại, gọi nR = m (mol); nO = t (mol)
→ \[{n_{{R_2}{{(S{O_4})}_n}}} = \frac{1}{2}{n_R} = 0,5m(mol)\]
Theo đề bài: moxit = 36 (g) → R. m + 16. t = 36 (*)
mmuối = 80 (g) → 0,5m. (2R + 96n) = 80 (**)
Mà với các quá trình chuyển e:
\[\mathop R\limits^0 \to \mathop R\limits^{ + n} + ne\], \[\mathop O\limits^0 + 2e \to \mathop O\limits^{ - 2} ,\,\,\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} \]
Áp dụng định luật bảo toàn e, ta có: m. n = 2. t + 0,25. 2 (***)
Giải (*), (**), (***), ta được: Rm = 32; mn = 1; t = 0,25
Với mn = 1 \[ \to m = \frac{1}{n}\]
Mà Rm = 32 \[ \Rightarrow R\frac{1}{n} = 32 \Rightarrow R = 32n\]
Với n = 2 thì R = 64 → R là đồng (Cu)
Vậy công thức hoá học oxit cần tìm là CuO.
Câu 21:
a) Nguyên tố A không phải là khí hiếm, nguyên tử có phân lớp electron ngoài cùng là 3p. Nguyên tử nguyên tố B có phân lớp e ngoài cùng là 4s.
(1) Trong 2 nguyên tố A, B nguyên tố nào là kim loại, nguyên tố nào là phi kim?
(2) Xác định cấu hình e của A, B và tên của A, B.
Cho biết tổng số e ở hai phân lớp ngoài cùng của A và B là 7.
b) Cho các ion A-, B2+ đều có cấu hình electron của khí trơ Ne (1s22s22p6). Viết cấu hình e của A, B và dự đoán tính chất hoá học của 2 nguyên tố này.
 Xem đáp án
Xem đáp án
Lời giải:
a)
(1) Nguyên tử nguyên tố B có phân lớp e ngoài cùng là 4s nên có tối đa 2 electron ở lớp ngoài cùng nên B là nguyên tố kim loại.
Nguyên tố A không phải là khí hiếm, nguyên tử có phân lớp electron ngoài cùng là 3p, A có thể là nguyên tố kim loại hoặc phi kim.
(2) Nguyên tử nguyên tố B có phân lớp e ngoài cùng là 4s sẽ xảy ra 2 trường hợp sau:
Trường hợp 1: B có phân lớp e ngoài cùng là 4s1
→ B có cấu hình electron là 1s22s22p63s23p64s1
→ B có 19 electron → B có Z = 19
A có số electron ở phân lớp ngoài cùng là 7 – 1 = 6
→ A có phân lớp electron ngoài cùng là 3p6 → A là khí hiếm → loại
Trường hợp 2: B có phân lớp e ngoài cùng là 4s2
→ B có cấu hình electron là 1s22s22p63s23p64s2
→ B có 20 electron → B có Z = 20 → B là nguyên tố kim loại canxi (Ca).
A có số electron ở phân lớp ngoài cùng là 7 – 2 = 5
→ A có phân lớp electron ngoài cùng là 3p5
→ A có cấu hình electron là 1s22s22p63s23p5
→ A có 17 electron → A có Z = 17 → A là nguyên tố phi kim clo (Cl).
b) Ion A- có cấu hình electron của khí trơ Ne[2s22p6] nên cấu hình e của A là 1s22s22p5 → A có Z = 9, là nguyên tố phi kim. A có đầy đủ tính chất hoá học của 1 nguyên tố phi kim.
Ion B2+ có cấu hình electron của khí trơ Ne[2s22p6] nên cấu hình e của B là 1s22s22p63s2 → B có Z = 12, là nguyên tố kim loại. B có đầy đủ tính chất hoá học của 1 kim loại.
Câu 22:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{CuO}} = \frac{{16}}{{80}} = 0,2(mol)\]
\[{m_{{H_2}S{O_4}}} = \frac{{200.19,6}}{{100}} = 39,2(g) \to {n_{{H_2}S{O_4}}} = \frac{{39,2}}{{98}} = 0,4(mol)\]
Phương trình hoá học: CuO + H2SO4 → CuSO4 + H2O
Lập tỉ lệ: \[\frac{{0,2}}{1} < \frac{{0,4}}{1}\]→ H2SO4 dư, CuO phản ứng hết
\[{n_{{\rm{CuS}}{O_4}}} = {n_{{H_2}S{O_4}p{\rm{u}}}} = {n_{CuO}} = 0,2(mol)\]→\[{n_{{H_2}S{O_4}du}} = 0,4 - 0,2 = 0,2(mol)\]
Vậy dung dịch sau phản ứng gồm 0,2 mol H2SO4 và 0,2 mol CuSO4
\[{m_{{H_2}S{O_4}}} = 0,2.98 = 19,6(g);{m_{{\rm{CuS}}{{\rm{O}}_4}}} = 0,2.160 = 32(g)\]
Nồng độ % các chất trong dung dịch X là:
\[C{\% _{{H_2}S{O_4}}} = \frac{{19,6}}{{200 + 16}}.100\% = 9,07\% \];
\[C{\% _{CuS{O_4}}} = \frac{{32}}{{200 + 16}}.100\% = 14,81\% \]
Câu 24:
 Xem đáp án
Xem đáp án
Lời giải:
Dùng quỳ tím để nhận biết 3 dung dịch sau: H2SO4, MgCl2, Ca(OH)2:
- Dung dịch nào làm quỳ tím chuyển màu đỏ thì là H2SO4;
- Dung dịch nào làm quỳ tím chuyển màu xanh thì là Ca(OH)2;
- Dung dịch không làm quỳ tím chuyển màu là MgCl2.
Câu 25:
 Xem đáp án
Xem đáp án
Lời giải:
nHCl (pH=1) = 1,8. 0,1 = 0,18 (mol); nHCl (pH=2) = 3,6. 0,01 = 0,036 (mol)
→\[{n_{{H^ + }}} = 0,18 + 0,036 = 0,216(mol)\]
\[\left[ {{H^ + }} \right] = \frac{{0,216}}{{5,4}} = 0,04\](M)
\[pH = - \log \left[ {{H^ + }} \right] = - \log (0,04) = \]1,398
Câu 26:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
But – 2 – en có cấu tạo đối xứng, khi cộng nước thu được 1 ancol duy nhất:
![]()
Câu 27:
 Xem đáp án
Xem đáp án
Lời giải:
Cho hỗn hợp trên vào dung dịch NaOH dư ta thu được một phần chất rắn không tan, lọc bỏ phần chất rắn không tan ta thu được sắt.
Phương trình hoá học:
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2
Câu 28:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Khi cho dung dịch NaOH vào dung dịch Ca(HCO3)2 thấy có kết tủa trắng xuất hiện vì xảy ra phản ứng sau:
2NaOH + Ca(HCO3)2 → Na2CO3 + CaCO3↓ + 2H2O
Câu 29:
 Xem đáp án
Xem đáp án
Lời giải:
Gọi \[{n_{Fe{{(N{O_3})}_3}}}\]phản ứng = x (mol, x > 0) → \[{m_{Fe{{(N{O_3})}_3}}}\]phản ứng = 242. x (g)
Phương trình hoá học:
![]()
Theo PTHH: \[{n_{F{e_2}{O_3}}} = \frac{1}{2}{n_{Fe{{(N{O_3})}_3}}} = 0,5x(mol)\]\[ \to {m_{F{e_2}{O_3}}} = 0,5x.160 = 80x(g)\]
mchất rắn = \[{m_{Fe{{(N{O_3})}_3}}}\]dư + \[{m_{F{e_2}{O_3}}}\]= 72,6 – 242x + 80x = 53,16 → x = 0,12
Hiệu suất phản ứng của quá trình nhiệt phân là:
\[H = \frac{{242.0,12}}{{72,6}}.100\% = 40\% \]
Câu 30:
 Xem đáp án
Xem đáp án
Lời giải:
\[N{H_4}Cl \to NH_4^ + + C{l^ - }\]
0,1……….0,1….0,1 (mol)
Gọi nồng độ \[NH_4^ + \] phân li là x (M, x > 0)
PTHH: \[NH_4^ + + {H_2}O \to N{H_4}OH + {H^ + }\] \[{K_a} = {5,56.10^{ - 10}}\]
Ban đầu: 0,1…………….0…………0 M
Phân li: x………………x………...x M
Kết thúc: 0,1 – x …………...x…….......x M
\[{K_a} = \frac{{\left[ {N{H_4}OH} \right].\left[ {{H^ + }} \right]}}{{\left[ {NH_4^ + } \right]}} = \frac{{{x^2}}}{{0,1 - x}} = {5,56.10^{ - 10}}\]
\[ \Rightarrow x = \left[ {{H^ + }} \right] = {7,46.10^{ - 6}}M\]→ \[pH = - \log \left[ {{H^ + }} \right] = 5,13\]
Câu 31:
Để điều chế cao su Buna người ta có thể thực hiện theo các sơ đồ biến hóa sau:
C2H6 C2H4 C2H5OH Buta-1,3-đien Cao su Buna.
Tính khối lượng etan cần lấy để có thể điều chế được 5,4 kg cao su Buna theo sơ đồ trên?
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
nCao su Buna = \[\frac{{5,4}}{{54}} = 0,1(kmol)\]
nButa-1,3-đien = \[\frac{{01.100}}{{80}} = 0,125(kmol)\]
\[{n_{{C_2}{H_5}OH}} = \frac{{0,125.100}}{{50}} = 0,25(kmol)\]
\[{n_{{C_2}{H_4}}} = \frac{{0,25.100}}{{80}} = 0,625(kmol)\]
\[{n_{{C_2}{H_6}}} = \frac{{0,625.100}}{{30}} = \frac{{25}}{{12}}(kmol)\]\[ \to {m_{{C_2}{H_6}}} = \frac{{25}}{{12}}.30 = 62,5(kg)\].
Câu 32:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
Theo định luật bảo toàn điện tích cho dung dịch X và Y, lần lượt ta có:
0,07. 1 = 0,02. 2 + x. 1 → x = 0,03
0,04. 1 = y. 1 → y = 0,04
Phương trình hoá học:
H+ + \[O{H^ - }\] → H2O
0,04 0,03
→\[O{H^ - }\]hết, H+ dư
\[ \Rightarrow {n_{{H^ + }d{\rm{u}}}} = 0,04 - 0,03 = 0,01(mol)\]
\[ \Rightarrow \left[ {{H^ + }} \right] = \frac{{0,01}}{{0,1}} = 0,1M\]
\[ \Rightarrow pH = - \log \left[ {{H^ + }} \right] = 1\]
Câu 33:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Gọi công thức hoá học tạo bởi Fe (II) và O là FexOy
Theo quy tắc hoá trị, ta có: II. x = II. y
\[ \to \frac{x}{y} = \frac{{II}}{{II}} = \frac{1}{1} \to x = y = 1\]
→ Công thức hoá học cần tìm là FeO.
Câu 34:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
Vì Ag → Ag+ + 1e nên Ag là chất khử trong phản ứng trên.
Câu 35:
 Xem đáp án
Xem đáp án
Lời giải:

Câu 36:
 Xem đáp án
Xem đáp án
Lời giải:
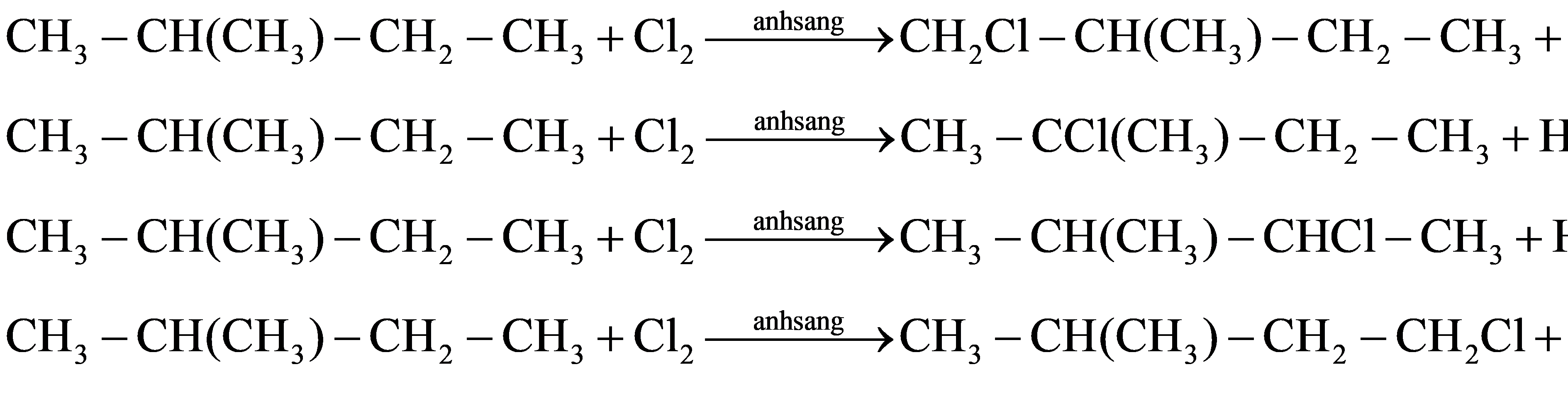
Câu 37:
 Xem đáp án
Xem đáp án
Lời giải:
Phân tử khối CaCO3: 40 + 12 + 16.3 = 100.
Phần trăm theo khối lượng các nguyên tố có trong hợp chất CaCO3:
\[\% Ca = \frac{{40}}{{100}}.100\% = 40\% \]
\[\% C = \frac{{12}}{{100}}.100\% = 12\% \]
%O = 100% – 40% – 12% = 48%
Câu 38:
 Xem đáp án
Xem đáp án
Lời giải
\[{n_{Pb{{(N{O_3})}_2}}} = \frac{{6,62}}{{201 + (14 + 16.3).2}} = 0,02(mol)\]
Phương trình hoá học:
![]()
Theo PTHH: \[{n_{N{O_2}}} = 2{n_{Pb{{(N{O_3})}_2}}} = 2.0,02 = 0,04(mol)\]
\[{n_{{O_2}}} = \frac{1}{2}{n_{Pb{{(N{O_3})}_2}}} = \frac{1}{2}.0,02 = 0,01(mol)\]
Vhỗn hợp khí = (0,04 + 0,01). 22,4 = 1,12 (l)
Câu 39:
 Xem đáp án
Xem đáp án
Lời giải
Đáp án đúng là: A
Phân từ khối của khí nitrogen N2 là 14. 2 = 28 đvC.
Câu 40:
 Xem đáp án
Xem đáp án
Lời giải:
\[{H_2}S{O_4} \to 2{H^ + } + SO_4^{2 - }\]
0,005……0,01
\[\left[ {{H^ + }} \right] = 0,01 \to pH = - \log \left[ {{H^ + }} \right] = 2\]
Câu 41:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{{N_2}}} = \frac{{5,6}}{{22,4}} = 0,25(mol) \Rightarrow {m_{{N_2}}} = 0,25.28 = 7(g)\]
Vậy khối lượng của 5,6 lít khí N2 ở đktc là 7 gam.
Câu 43:
Cho 11,2 gam Fe vào dung dịch HCl. Tính:
a) Thể tích khí H2 thu được ở đktc?
b) Khối lượng HCl đã phản ứng?
c) Khối lượng muối FeCl2 tạo thành?
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{Fe}} = \frac{{11,2}}{{56}} = 0,2(mol)\]
Phương trình hoá học:
Fe + 2HCl → FeCl2 + H2
a) \[{n_{{H_2}}} = {n_{Fe}} = 0,2(mol) \to {V_{{H_2}}} = 0,2.22,4 = 4,48(l)\]
b) \[{n_{HCl}} = 2{n_{Fe}} = 2.0,2 = 0,4(mol) \to {m_{HCl}} = 0,2.36,5 = 7,3(g)\]
c) \[{n_{FeC{l_2}}} = {n_{Fe}} = 0,2(mol) \to {m_{FeC{l_2}}} = 0,2.127 = 25,4(g)\]
Câu 44:
Cho 11,2 gam Fe vào 300 ml dung dịch AgNO3 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
\[{n_{Fe}} = 0,2(mol);{n_{A{g^ + }}} = 0,3(mol)\]
Do \[{n_{Fe}} < 2{n_{A{g^ + }}}\]nên Ag+ phản ứng hết, Fe dư
nFe phản ứng = \[\frac{1}{2}{n_{A{g^ + }}} = \frac{1}{2}.0,3 = 0,15(mol)\]
Chất rắn A gồm Fe dư 0,05 mol; 0,3 mol Ag
mrắn = 0,05. 56 + 0,3. 108 = 35,2 gam
Câu 45:
Cho X là một muối nhôm (khan), Y là một muối vô cơ (khan). Hòa tan m gam hỗn hợp 2 muối X, Y (có cùng số mol) vào nước thu được dung dịch A. Thêm từ từ dung dịch Ba(OH)2 vào dung dịch A cho tới dư được dung dịch B, kết tủa D và khí C. Axit hóa dung dịch B bằng HNO3 rồi thêm AgNO3 vào thấy xuất hiện kết tủa trắng, kết tủa này bị đen dần khi để ngoài ánh sáng. Khi thêm dd Ba(OH)2 vào dung dịch A thì kết tủa D đạt giá trị lớn nhất (kết tủa E), sau đó thêm tiếp dd Ba(OH)2 vào thì lượng kết tủa đạt giá trị nhỏ nhất (kết tủa F). Nung các kết tủa E và F đến khối lượng ko đổi, thu được 6,248g và 5,126g các chất tương ứng. Cho biết F không tan trong axit mạnh.
a. Xác định CTHH của các muối X, Y.
b. Tính m và thể tích khí C ở đktc ứng với giá trị E lớn nhất.
 Xem đáp án
Xem đáp án
Lời giải:
a. Cho AgNO3 vào dung dịch B đã axit hoá tạo ra kết tủa trắng bị hoá đen ngoài ánh sáng, đó là AgCl, vậy phải có một trong hai muối là muối clorua.
- Khi cho Ba(OH)2 mà có khí bay ra chứng tỏ đó là NH3. Vậy muối Y phải là muối amoni (muối trung hoà hoặc muối axit)
- Mặt khác khi thêm Ba(OH)2 tới dư mà vẫn còn kết tủa chứng tỏ một trong hai muối phải là muối sunfat
Các phản ứng dạng ion:
\[A{g^ + } + C{l^ - } \to AgCl \downarrow \]
\[NH_4^ + + O{H^ - } \to N{H_3} + {H_2}O\]
\[A{l^{3 + }} + 3O{H^ - } \to Al{(OH)_3} \downarrow \]
\[Al{(OH)_3} + O{H^ - } \to Al(OH)_4^ - \]
![]()
\[B{a^{2 + }} + SO_4^{2 - } \to BaS{O_4}\](không đổi khi nung)
Sự chênh lệch nhau vì khối lượng khi nung E, F là do Al2O3 tạo thành từ Al(OH)3
\[{n_{A{l_2}{O_3}}} = \frac{{6,248 - 5,126}}{{102}} = 0,011(mol)\]
\[{n_{BaS{O_4}}} = {n_{SO_4^{2 - }}} = \frac{{5,126}}{{233}} = 0,022(mol)\]
Ta thấy: \[{n_{SO_4^{2 - }}} = {n_{A{l^{3 + }}}}\]nên không thể có muối Al2(SO4)3. Do đó muối nhôm phải là muối clorua AlCl3 với số mol = 0,011. 2 = 0,022 mol và muối Y phải là (NH4)2SO4 hoặc NH4HSO4 với số mol là 0,022 mol.
b.
- Trường hợp muối (NH4)2SO4
m = 0,022. 133,5 + 0,022. 132 = 5,841 gam
nkhí C = \[{n_{NH_4^ + }}\]= 0,044 (mol) → VB = 0,9856 lít
- Trường hợp muối NH4HSO4
m = 0,022. 133,5 + 0,022. 115 = 5,467 gam
nkhí C = \[{n_{NH_4^ + }}\]= 0,022 (mol) → VB = 0,4928 lít
Câu 46:
Nguyên tử silicon có 14 electron. Số lớp electron và số electron lớp ngoài cùng của nguyên tử này lần lượt là
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Nguyên tử silicon có 14 electron sẽ sắp xếp lần lượt như sau:
+ Lớp thứ nhất có 2 electron
+ Lớp thứ hai có 8 electron
+ Còn lại 14 – 2 – 8 = 4 electron ở lớp thứ ba
Câu 47:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
\[{n_{Mg}} = \frac{{4,8}}{{24}} = 0,2(mol)\]
\[\mathop {Mg}\limits^0 \to {\rm{ }}\mathop {Mg}\limits^{ + 2} + {\rm{ }}2e\]
ne cho = 0,2. 2 = 0,4 (mol)
\[{n_{{N_2}O}} = \frac{{5,6}}{{22,4}} = 0,025(mol)\]
\[2\mathop N\limits^{ + 5} + {\rm{ }}8e{\rm{ }} \to {\rm{ }}2\mathop N\limits^{ + 1} \]
ne nhận = 0,025. 8 = 0,2 (mol) < ne cho
→ Sản phẩm có muối amoni:
\[\mathop N\limits^{ + 5} + {\rm{ }}8e{\rm{ }} \to {\rm{ }}\mathop N\limits^{ - 3} \]
\[{n_{N{H_4}N{O_3}}} = \frac{{0,4 - 0,2}}{8} = 0,025(mol)\]
Chất rắn khan gồm NH4NO3: 0,025 mol; Mg(NO3)2: 0,2 mol
→ m = 0,025. 80 + 0,2. 148 = 31,6 (g)
Câu 48:
 Xem đáp án
Xem đáp án
Lời giải:
Công thức đúng là: NaH2PO4, Mg(HSO3)2, NH4Cl
Câu 49:
 Xem đáp án
Xem đáp án
Lời giải:
Ở cả 2 trường hợp, lượng kết tủa thu được bằng nhau mà:
\[{n_{C{O_2}(1)}} = \frac{{4,48}}{{22,4}} = 0,2(mol);{n_{C{O_2}(2)}} = \frac{{8,96}}{{22,4}} = 0,4(mol)\] nên trường hợp 1: CO2 hết, Ba(OH)2 dư, chỉ xảy ra 1 phản ứng: CO2 + Ba(OH)2 → BaCO3↓ + H2O
\[{n_{BaC{O_3}}} = {n_{C{O_2}}} = \frac{{4,48}}{{22,4}} = 0,2(mol)\]
Ở trường hợp 2, xảy ra 2 phản ứng sau:
CO2 + Ba(OH)2 → BaCO3↓ + H2O (*)
2CO2 + Ba(OH)2 → Ba(HCO3)2 (**)
\[{n_{C{O_2}(*)}} = {n_{BaC{O_3}}} = 0,2(mol)\]→ \[{n_{C{O_2}(**)}} = {n_{C{O_2}(2)}} - {n_{C{O_2}(*)}} = 0,4 - 0,2 = 0,2(mol)\]
Theo PTHH (*), (**), \[{n_{Ba{{(OH)}_2}}} = {n_{C{O_2}(*)}} + \frac{1}{2}.{n_{C{O_2}(**)}} = 0,2 + 0,2.\frac{1}{2} = 0,3(mol)\]\[x = {C_M} = \frac{{{n_{Ba{{(OH)}_2}}}}}{{{V_{{\rm{dd}}}}}} = \frac{{0,3}}{{0,1}} = 3M\]
Câu 50:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Vì hai nguyên tố A và B ở hai nhóm A liên tiếp trong bảng tuần hoàn, A thuộc nhóm VA nên B thuộc nhóm IVA hoặc nhóm VIA.
Vì ZA + ZB = 23 nên ZA < 23
- Khi A là N thì ZB = 23 – 7 = 16, hay B là S thuộc nhóm VIA.
Ở trạng thái đơn chất, N2 và S không phản ứng với nhau.
Do đó cặp nguyên tố N và S thoả mãn.
- Khi A là P thì ZB = 23 – 15 = 8, hay B là O thuộc nhóm VIA.
Ở trạng thái đơn chất, P và O2 có phản ứng với nhau. Do đó cặp nguyên tố P và O không thoả mãn.
Câu 51:
Cho phản ứng hóa học sau: M + HNO3 → M(NO3)n + NO↑ + H2O.
Hệ số cân bằng của phản ứng lần lượt là:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
3M + 4nHNO3 → 3M(NO3)n + nNO↑ + 2nH2O.