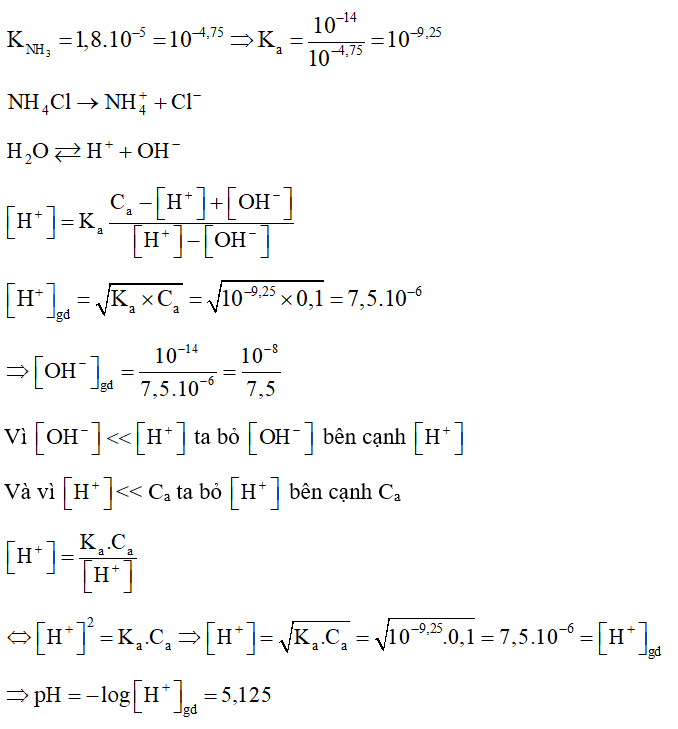Trắc nghiệm tổng hợp Hóa học năm 2023 có đáp án (Phần 3)
-
1873 lượt thi
-
50 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
AgNO3 + Na2SO4 ra hiện tượng gì?
 Xem đáp án
Xem đáp án
Phương trình phản ứng:
Na2SO4 + 2AgNO3 → Ag2SO4↓trắng + 2NaNO3
Hiện tượng: Xuất hiện kết tủa màu trắng.
Câu 4:
Nêu một số biện pháp sử dụng các nguyên liệu an toàn, hiệu quả và bảo đảm sự phát triển bền vững.
 Xem đáp án
Xem đáp án
Một số biện pháp sử dụng nguyên liệu an toàn hiệu quả và đảm bảo sự phát triển bền vững:
+ Đổi mới công nghệ khai thác, chế biến;
+ Kiểm soát, xử lý chất thải và bảo vệ môi trường;
+ Khai thác các nguồn nguyên liệu có kế hoạch;
+ Sử dụng đúng cách nguồn tài nguyên thiên nhiên mà không làm tổn hại đến hệ sinh thái và môi trường.
+ Thăm dò, nghiên cứu các loại nguyên liệu mới phù hợp và góp phần bảo vệ môi trường…
Câu 5:
Tổng số hạt proton, notron, electron trong hai nguyên tử kim loại A, B là 142. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 42. Số hạt mang điện của nguyên tử B nhiều hơn của A là 12. Hai kim loại A, B lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Tổng số hạt proton, notron, electron trong hai nguyên tử kim loại A, B là 142
→ 2pA + nA + 2pB + nB = 142
Số hạt mang điện nhiều hơn số hạt không mang điện là 42
→ 2pA + 2pB - (nA + nB) = 42
Giải hệ → 2pA + 2pB = 92 (1) và nA + nB= 50
Số hạt mang điện của nguyên tử B nhiều hơn của A là 12
→ 2pB - 2pA = 12 (2)
Giải hệ (1), (2) → pA = 20 (Ca), pB = 26 (Fe).
Câu 6:
Hòa tan hoàn toàn m gam FexOy bằng dung dịch H2SO4 đặc nóng dư thu được khí A và dung dịch B. Cho khi A hấp thụ hoàn toàn vào dung dịch NaOH dư tạo ra 12,6 gam muối. Mặt khác, cô cạn dung dịch B thì thu được 120 gam muối khan. Công thức oxit là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Vì H2SO4 đặc nóng dư nên khí A sinh ra là SO2.
Muối khan thu được là: Fe2(SO4)3
Theo bảo toàn nguyên tố Fe có:
Vì dung dịch NaOH dư nên khi dẫn SO2 vào đung dịch NaOH chỉ xảy ra một phản ứng:
2NaOH + SO2 → Na2SO3 + H2O
Coi oxit FexOy ban đầu là hỗn hợp của Fe và O.
Gọi nO = a (mol)
Áp dụng định luật bảo toàn mol electron, ta có:
Có: → Oxit cần tìm là Fe3O4.
Câu 7:
Chỉ dùng phương pháp đun nóng, hãy nêu cách phân biệt các dung dịch mất nhãn từng các chất sau: NaHSO4, KHCO3, Na2SO3, Mg(HCO3)2, Ba(HCO3)2. Viết phương trình phản ứng nếu có.
 Xem đáp án
Xem đáp án
Lấy mẫu các dung dịch rồi tiến hành đun nóng:
- Xuất hiện kết tủa trắng, có bọt khí → Mg(HCO3)2 hoặc Ba(HCO3)2 (Nhóm I)
- Xuất hiện bọt khí là KHCO3
- Không xảy ra hiện tượng gì là NaHSO4 hoặc Na2CO3 (Nhóm II)
Dùng KHCO3 nhận biết các chất trong nhóm II:
- Xuất hiện bọt khí là NaHSO4
2KHCO3 + 2NaHSO4 → K2SO4 + Na2SO4 + 2CO2↑ + 2H2O
- Không có hiện tượng gì là Na2CO3
Dùng NaHSO4 nhận biết các chất trong nhóm I:
- Xuất hiện kết tủa trắng và bọt khí là Ba(HCO3)2
Ba(HCO3)2 + 2NaHSO4 → BaSO4↓ + Na2SO4 + 2CO2 ↑ + 2H2O
- Xuất hiện bọt khí là Mg(HCO3)2
Mg(HCO3)2 + 2NaHSO4 → MgSO4 + Na2SO4 + 2CO2 ↑ + 2H2O
Câu 8:
Cho biết độ tan của chất tan A trong nước ở 10 oC là 15 g còn ở 90 oC là 50 g. Hỏi khi làm lạnh 600 g dung dịch bão hòa A ở 90 oC xuống 10 oC thì có bao nhiêu g chất rắn A tách ra?
 Xem đáp án
Xem đáp án
- Ở 90 oC: Trong 150 gam dung dịch A có 50 gam A
Vậy trong 600 gam dung dịch A có: A
Giả sử khi làm lạnh từ 90 oC xuống 10 oC có m gam chất rắn A tách ra
- Ở 10 oC: Trong 115 gam dung dịch A có 15 gam A
Vậy trong (600 - m) gam dung dịch A có (200 - m) gam A
⇒(600 - m). 15 = (200 - m). 115
⇒ m = 140 (gam)
Vậy khi làm lạnh 600 gam dung dịch bão hòa A ở 90 oC xuống 10 oC thì có 140 gam chất rắn A tách ra.
Câu 9:
Hiện tượng khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường glucozơ (C6H12O6) là:
 Xem đáp án
Xem đáp án
Khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường thì đường bị hóa đen, cột chất rắn dâng cao, có khói trắng thoát ra:
PTHH:
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O
Câu 10:
Thủy phân hoàn toàn 20,3 gam một Oligopeptit X trong môi trường axit loãng, thu được 8,9 gam alanin và 15 gam glyxin. Peptit X thuộc loại:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Đặt công thức chung của 2 amino axit là CmH2m+1O2N; Giả sử X tạo bởi k gốc amino axit → X có dạng
= mamino axit – mX = 8,9 + 15 – 20,3 = 3,6 gam
nalanin + nglyxin =
X là tripeptit
Câu 11:
Cho các phản ứng:
(1) Fe3O4 + 4H2SO4 (loãng) → FeSO4 + Fe2(SO4)3 + 4H2O
(2) 3Fe + 4H2O Fe3O4 + 4H2
(3) Fe(NO3)2 + HCl → FeCl3 + NO + H2O
(4) FeS + H2SO4 (đặc nóng) → Fe2(SO4)3 + H2S + H2O
Có bao nhiêu phản ứng viết đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các phản ứng (1) và (2) đúng.
(3) Sai vì: 9Fe(NO3)2 + 12HCl → 5Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O
(4) Sai vì: 2FeS + 10H2SO4 (đặc, nóng) → Fe2(SO4)3 + 9SO2 + 10H2O
Câu 12:
Cho dung dịch NH4NO3 tác dụng với dung dịch bazơ của kim loại thu được 4,48 lít khí (đktc) và 26,1 gam muối. Kim loại đó là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
2NH4NO3 + R(OH)2 → R(NO3)2 + 2NH3 + 2H2O
Vậy R là bari (Ba).
Câu 13:
Cho 11,0 gam hỗn hợp A gồm Fe và Al phản ứng hết với dung dich HCl dư thu được 8,96 lít H2 (đktc). Cho 22 gam hỗn hợp A phản ứng hết với dung dịch HNO3 dư thu được V lít NO (đktc) là sản phẩm khử duy nhất. Giá trị V là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Xét 11g A:
Bảo toàn electron: ne = 2nH2 = 0,8 mol = 2nFe + 3nAl (1)
Và mFe + mAl = 11g nên 56nFe + 27nAl = 11 (2)
Từ (1) và (2) giải hệ phương trình được: nFe = 0,1 mol; nAl = 0,2 mol.
Trong 22g A có: nFe = 0,2 mol; nAl = 0,4 mol
Bảo toàn electron: 3nFe + 3nAl = 3nNO nNO = 0,6 mol.
VNO = 0,6. 22,4 = 13,44 lít.
Câu 16:
Trong phân tử MX2 có tổng số hạt p, n, e bằng 164 hạt, tổng đó số hạt mang điện nhiều hơn số hạt không mang điện là 52 hạt. Số khối của nguyên tử M lớn hơn số khối của nguyên tử X là 5. Tổng số hạt p, n, e trong nguyên tử M lớn hơn số hạt p, n, e trong nguyên tử X. Số hiệu nguyên tử là?
 Xem đáp án
Xem đáp án
+) Trong phân tử MX2 có tổng số hạt p n e bằng 164 hạt
→2PM + NM + 2(2PX + NX) = 164 (1)
+) Trong đó số hạt mang điện nhiều hơn hạt không mang điện là 52
→2PM + 2.2PX − (NM + 2NX) = 52 (2)
Từ (1) và (2) ta có: PM + 2PX = 54 (*)
+) Số khối của nguyên tử M lớn hơn số khối của nguyên tử X là 5
→PM + NM − (PX + NX) = 5 (3)
+) Tổng số hạt p, n, e trong M lớn hơn trong X là 8
→2PM + NM − (2PX + NX) = 8 (4)
Từ (3) và (4) có PM – PX = 3 (**)
Từ (*), (**) giải hệ phương trình ta được: PM = 20; PX = 17;
Vậy M là Canxi (Ca).
Câu 17:
Cho 45 gam axit axetic phản ứng với 69 gam ancol etylic (xúc tác H2SO4 đặc), đun nóng, thu được 39,6 gam etyl axetat. Hiệu suất của phản ứng este hoá là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
0,75 1,5 (mol)
Giả sử H = 100% → axit hết;
neste = naxit = 0,75 mol
→ meste lý thuyết = 0,75.88 = 66 gam
Hiệu suất phản ứng là: .
Câu 18:
Thuỷ phân hoàn toàn 3,7 gam chất X có công thức phân tử C3H6O2 trong 100 gam dung dịch NaOH 4%, cô cạn dung dịch sau phản ứng thu được 5,4 gam chất rắn. Công thức cấu tạo của X là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Theo đề bài ra X là este đơn chức
Đặt X là RCOOR’
RCOOR’ + NaOH → RCOONa + R’OH
0,05 0,1
Theo PTHH có NaOH dư;
Bảo toàn khối lượng, có:
mRCOOR’ + mNaOH = mchất rắn + mR’OH
→ mancol (R’OH) = 3,7 + 4 – 5,4 = 2,3 gam
Vậy ancol là C2H5OH nên X là HCOOC2H5.
Câu 19:
Trộn V1 lít dung dịch HCl có pH = 1 với V2 lít dung dịch HCl pH = 2 thu được dung dịch HCl có pH = 1,26. Tỉ lệ V2/V1 là bao nhiêu?
 Xem đáp án
Xem đáp án
Dung dịch HCl pH = 1 có
Dung dịch HCl pH = 2 có
Khi trộn 2 dung dịch thu được dung dịch mới có
Thể tích dung dịch mới là V1 + V2 (lít)
→
Dung dịch mới có pH = 1,26
→ .
Câu 20:
Cho 1,92 gam Cu tác dụng với 100 ml dung dịch A chứa HNO3 1M, HCl 0,5M, H2SO4 0,1M. Cô cạn dung dịch sau phản ứng thu được muối gì?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C

Câu 21:
Nguyên tử khối trung bình của Bo là 10,812 (số hiệu nguyên tử của Bo là 5). Bo có 2 đồng vị là 10B, 11B. Nếu có 94 nguyên tử 10B thì có bao nhiêu nguyên tử 11B?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Gọi x và 1 – x lần lượt là tỉ lệ số nguyên tử của 10B và 11B
→ 10x + 11.(1 – x) = 10,812 → x = 0,188
Tỉ lệ:
Vậy nếu có 94 nguyên tử 10B thì có nguyên tử 11B.
Câu 22:
Cho 1,84 g hỗn hợp Fe và Mg vào lượng dư dung dịch HNO3 thấy thoát 0,04 mol khí NO duy nhất. Xác định số mol Fe và Mg trong hỗn hợp?
 Xem đáp án
Xem đáp án
Đặt x, y lần lượt là số mol Fe và Mg.
Ta có các quá trình:
Áp dụng định luật bảo toàn electron ta có: 3x + 2y = 0,12 (1)
Mặt khác khối lượng hỗn hợp: mhỗn hợp = 56x + 24y = 1,84 (2)
Từ (1) và (2) suy ra x = 0,02; y = 0,03.
Câu 23:
Cho 6,4 gam Cu vào dung dịch HNO3 đặc, đun nóng thì thu được dung dịch B và hỗn hợp khí NO2 và NO. Tỉ lệ mol lít NO2 và NO là 2 : 1. Tính thể tích khí NO2 (đktc):
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Ta có các quá trình:
5x……2x……..x mol
Bảo toàn e: 5x = 0,2 → x = 0,04
Câu 24:
Chỉ dùng thêm 1 hóa chất hãy trình bày cách phân biệt các dung dịch sau: HCl, NaCl , NaNO3, H2O
 Xem đáp án
Xem đáp án
- Trích mẫu thử.
- Cho Fe vào các mẫu thử.
+ Mẫu thử nào tạo khí không màu là HCl
Fe + 2HCl → FeCl2 + H2↑
+ 3 mẫu thử còn lại không có hiện tượng gì.
- Cho đồng thời Fe và HCl vừa nhận được vào các mẫu thử còn lại
+ Mẫu thử nào tạo khí không màu hóa nâu trong không khí là NaNO3
Fe + 4HCl + NaNO3 → FeCl3 + NaCl + NO + 2H2O
+ 2 mẫu thử còn lại không có hiện tượng gì.
- Cô cạn hai mẫu thử còn lại :
- Mẫu thử không thu được chất rắn sau khi cô cạn là H2O.
- Mẫu thử nào thu được chất rắn khan là NaCl.
Câu 25:
Cho m gam Mg tác dụng với V lít dung dịch HCl 1M thu được 2,24 lít khí H2 (đktc). Hãy xác định giá trị m và V?
 Xem đáp án
Xem đáp án
PTHH: Mg + 2HCl → MgCl2 + H2
0,1…..0,2……………..0,1 (mol)
mMg = 0,1. 24 = 2,4 (g)
Câu 26:
Viết phương trình phản ứng để chứng minh
a) N2 vừa có tính oxi hoá, vừa có tính khử.
b) NH3 có tính khử.
 Xem đáp án
Xem đáp án
a)
Số oxi hoá của N từ 0 lên + 2 → N2 có tính khử.
N2 + 6Li → 2Li3N
Số oxi hoá của N từ 0 xuống -3 → N2 có tính oxi hoá.
b) 2NH3 + 3CuO 3Cu + 3H2O + N2
Số oxi hoá của N từ -3 lên + 0 → NH3 có tính khử.
Câu 28:
Cách nhận biết một bình khí NH3 đầy?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cách nhận biết một bình khí NH3 đầy dùng quỳ tím ẩm để cạnh miệng bình.
Hiện tượng: Quỳ tím ẩm chuyển sang màu xanh.
Câu 29:
Em hãy chỉ ra vật thể tự nhiên, vật thể nhân tạo, vật vô sinh, vật hữu sinh trong các phát biểu sau:
a) Nước hàng (nước màu) được nấu từ đường sucrose (chiết xuất từ cây mía đường, cây thốt nốt, củ cải đường. ...) và nước.
b) Thạch găng được làm từ lá găng rừng, nước đun sôi, đường mía.
c) Kim loại được sản xuất từ nguồn nguyên liệu ban đầu là các quặng kim loại.
d) Gỗ thu hoạch từ rừng được sử dụng để đóng bàn ghế, giường tủ, nhà cửa.
 Xem đáp án
Xem đáp án
a, Vật thể tự nhiên: đường sucrose, cây mía đường, cây thốt nốt, củ cải đường, nước.
Vật thể nhân tạo: nước hàng (nước màu).
Vật vô sinh: nước, đường, nước hàng (nước màu).
Vật hữu sinh: cây mía đường, cây thốt nốt, cây củ cải đường.
b, Vật thể tự nhiên: lá găng rừng, nước, đường mía.
Vật thể nhân tạo: thạch găng.
Vật hữu sinh: lá găng rừng.
Vật vô sinh: nước, đường mía, thạch găng.
c, Vật thể tự nhiên: quặng kim loại.
Vật thể nhân tạo: kim loại.
Vật vô sinh: kim loại, quặng.
d, Vật thể tự nhiên: gỗ, rừng.
Vật thể nhân tạo: bàn ghế, giường tủ, nhà cửa.
Vật vô sinh: gỗ hạ từ cây, bàn ghế, giường tử, nhà cửa.
Vật hữu sinh: rừng.
Câu 30:
Chất nào sau đây được gọi là đơn chất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
O3 là đơn chất vì chất tạo nên từ 1 nguyên tố hoá học.
Câu 31:
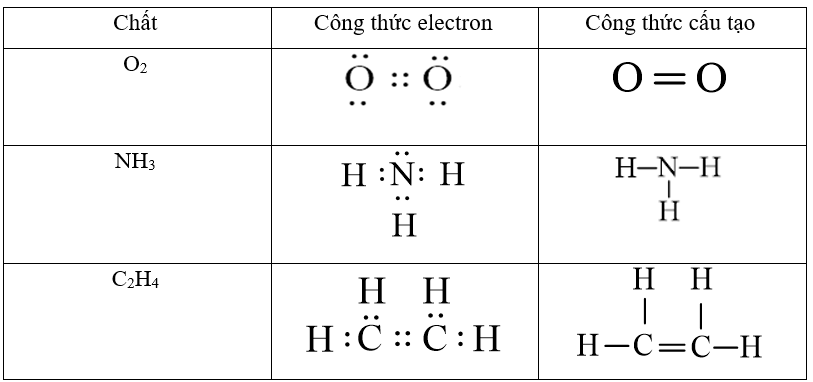
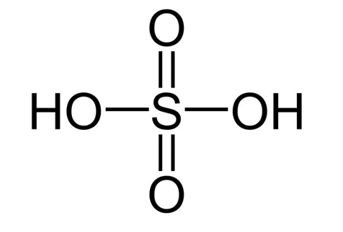
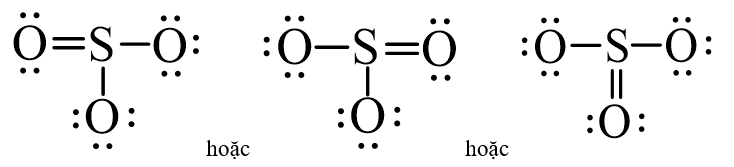
Viết các công thức Lewis cho mỗi phân tử sau: SO2 và SO3?
 Xem đáp án
Xem đáp án
Công thức Lewis của SO2:
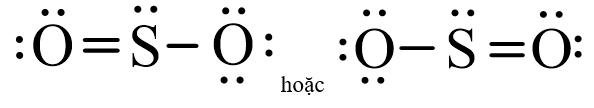
Công thức Lewis của SO3:
Câu 32:
Làm thế nào để tách được khí CO2 và O2 thành từng chất riêng biệt?
 Xem đáp án
Xem đáp án
Dẫn hỗn hợp qua dung dịch Ca(OH)2 dư:
- CO2 phản ứng giữ lại
- O2 tinh khiết bay ra
Lọc lấy kết tủa cho phản ứng với dung dịch HCl dư thu được CO2.
Ca(OH)2 + CO2 → CaCO3↓ + H2O
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
Câu 36:
Cân bằng các phương trình hoá học sau:
a) FeS + O2 → Fe2O3 + SO2
b) Al2(SO4)3 + Ca(OH)2 → Al(OH)3 + CaSO4
 Xem đáp án
Xem đáp án
a)
Cách cân bằng: Theo phương pháp thăng bằng electron:
Ta có:
Phương trình được cân bằng:
b) Al2(SO4)3 + 3Ca(OH)2 → 2Al(OH)3 + 3CaSO4
Cách cân bằng: nhẩm đại số.
Câu 37:
Hòa tan hoàn toàn 5,85 gam một kim loại A thuộc nhóm IA vào nước thì thu được 1,68 lít khí (đktc). Xác định tên kim loại đó.
 Xem đáp án
Xem đáp án
Vì A thuộc nhóm IA nên A hóa trị I trong hợp chất.
2A + 2H2O → 2AOH + H2
Theo PTHH ta có:
Vậy A là kali (K).
Câu 38:
Ngâm một dây đồng vào dung dịch bạc nitrat, hiện tượng quan sát được là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Một phần dây đồng bị hoà tan, có chất rắn màu xám bám ngoài dây đồng và dung dịch không màu chuyển dần sang màu xanh;
Phương trình hoá học minh hoạ:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Câu 39:
Để điều chế 5 tấn axit nitric nồng độ 60% cần dùng bao nhiêu tấn NH3. Biết sự hao hụt của NH3 trong quá trình sản xuất là 3,8%.
 Xem đáp án
Xem đáp án
Khối lượng HNO3 nguyên chất là: tấn.
Sơ đồ phản ứng điều chế HNO3 từ NH3
1 mol 1 mol
17 g 63 g
x tấn 3 tấn
Theo sơ đồ điều chế
tấn
Khối lượng NH3 hao hụt là 3,8% nghĩa là hiệu suất đạt 100% - 3,8% = 96,2%
Vậy khối lượng amoniac cần dùng là: tấn
Câu 40:
Hoà tan hết hỗn hợp gồm một kim loại kiềm và một kim loại kiềm thổ trong nước được dung dịch A và có 1,12 lít H2 bay ra (ở đktc). Cho dung dịch chứa 0,03 mol AlCl3 vào dung dịch A. Khối lượng kết tủa thu được là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Ta có nhận xét:
PT ion: Al3+ + 3OH- → Al(OH)3
BĐ: 0,03 0,1 0 mol
PƯ: 0,03 0,09 0,03 mol
Sau: 0 0,1 0,03 mol
PT ion: Al(OH)3 + OH- → AlO2- + H2O
BĐ: 0,03 0,01 0 mol
PƯ: 0,01 0,01 0,01 mol
Sau: 0,02 0 0,01 mol
Khối lượng kết tủa (Al(OH)3) thu được là:
m = 0,02.78 = 1,56 gam.
Câu 41:
Cho dãy chất được biểu diễn bằng công thức hóa học như sau: Cl2, Fe, NaOH, MgO, F2, Hg, AgCl, C4H8, CH3Cl. Số đơn chất trong dãy trên là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các đơn chất là: Cl2, Fe, F2, Hg.
Câu 42:
Hợp chất A có phân tử gồm 1 nguyên tử của nguyên tố X kết hợp với 2 nguyên tử O. Biết phân tử hợp chất A nặng hơn phân tử khí oxi là 1,375 lần. Xác định CTHH của hợp chất A.
 Xem đáp án
Xem đáp án
Hợp chất A có phân tử gồm 1 nguyên tử của nguyên tố X kết hợp với 2 nguyên tử O nên A có CTHH dạng XO2
Ta có:
Vậy X là cacbon (C) nên CTHH của A là CO2.
Câu 43:
Hợp chất X là 1 amin đơn chức bậc 1 chứa 31,11% nitơ. Công thức phân tử của X là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Amin đơn chức X có dạng RNH2, theo bài ra ta có:
%mN =
Þ R = 29 (C2H5)
X là C2H5NH2.
Câu 44:
Một hợp chất Y có phân tử khối là 58 đvC, cấu tạo từ 2 nguyên tố C và H trong đó C chiếm 82,76% khối lượng của hợp chất. Công thức phân tử của Y là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Đặt công thức hợp chất Y là CxHy có phân tử khối MY.
%C = 82,76% ⇒ %H = 100% − 82,76% = 17,24%
Vì khối lượng mỗi nguyên tố tỉ lệ với thành phần phần trăm khối lượng của nó.
Ta có:
Công thức của Y là C4H10.
Câu 45:
Nguyên tố X có nguyên tử khối bằng 6,75 lần nguyên tử khối của oxi. X là nguyên tố nào sau đây
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Vậy X là bạc (Ag).
Câu 46:
Nguyên tử Fe có hóa trị II trong công thức nào:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Trong hợp chất FeO, nguyên tử Fe có hoá trị II.
Câu 47:
Cách viết nào sau đây chỉ 2 phân tử oxi?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
2 phân tử oxi được viết là: 2O2
Câu 48:
Cho biết CTHH hợp chất của nguyên tố X với Cl là XCl2, hợp chất của Y với O là Y2O3. Vậy CTHH của hợp chất của X và Y là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Ta có:
+ XCl2 → X có hóa trị II
+ Y2O3 → Y có hóa trị III
Vậy công thức hóa học đúng là: X3Y2.
Câu 49:
Dùng chữ số và công thức hóa học để diễn đạt những ý sau: Hai phân tử oxi; năm phân tử nước; ba phân tử khí cacbonic; sáu phân tử hiđro?
 Xem đáp án
Xem đáp án
Hai phân tử oxi: 2 O2.
Năm phân tử nước: 5 H2O.
Ba phân tử khí cacbonic: 3 CO2.
Sáu phân tử hiđro: 6 H2.
Câu 50:
Nguyên tử cacbon có khối lượng 1,9926.i lượng tính bằng gam của Ca?
 Xem đáp án
Xem đáp án
Nguyên tử cacbon có nguyên tử khối là 12 đvC.
Þ Khối lượng của 1 đvC là:
Mà nguyên tử canxi có nguyên tử khối là 40 đvC.
Þ Khối lượng của nguyên tử canxi là: .