Trắc nghiệm tổng hợp Hóa học năm 2023 có đáp án (Phần 9)
-
1804 lượt thi
-
105 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Chỉ dùng quỳ tím, nhận biết các chất sau:
a) 6 dung dịch: H2SO4, HCl, NaOH, Ba(OH)2, NaCl, BaCl2.
b) 6 dung dịch: Na2SO4, NaOH, BaCl2, HCl, AgNO3, MgCl2.
c) 4 dung dịch: Na2CO3, AgNO3, CaCl2, HCl.
 Xem đáp án
Xem đáp án
Lời giải:
a) 6 dung dịch: H2SO4, HCl, NaOH, Ba(OH)2, NaCl, BaCl2
- Dùng quỳ tím để nhận biết:
+ Quỳ tím hoá đỏ: HCl, H2SO4 (A)
+ Quỳ tím hoá xanh: NaOH, Ba(OH)2 (B)
+ Quỳ tím không đổi màu: NaCl, BaCl2 (C)
- Lấy 1 chất bất kì ở nhóm A cho vào nhóm B. Nếu có kết tủa trắng thì chất ở nhóm A là H2SO4, chất ở nhóm B là Ba(OH)2 → Chất còn lại ở nhóm A là HCl, chất còn lại ở nhóm B là NaOH.
H2SO4 + Ba(OH)2 → BaSO4↓ + 2H2O
- Dùng H2SO4 nhận ra 2 chất ở nhóm C, có kết tủa là BaCl2, còn lại là NaCl
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
b) 6 dung dịch: Na2SO4, NaOH, BaCl2, HCl, AgNO3, MgCl2
- Dùng quỳ tím để nhận biết:
+ Quỳ tím hoá đỏ: HCl, AgNO3, MgCl2 (A)
+ Quỳ tím hoá xanh: NaOH
+ Quỳ tím không đổi màu: Na2SO4, BaCl2 (B)
- Cho NaOH vào nhóm A:
+ Kết tủa trắng là MgCl2:
2NaOH + MgCl2 → Mg(OH)2↓ + 2NaCl
+ Kết tủa đen là AgNO3
2AgNO3 + 2NaOH → 2NaNO3 + Ag2O↓ + H2O
+ Trong suốt, không hiện tượng là HCl
HCl + NaOH → NaCl + H2O
- Cho AgNO3 vào nhóm B:
+ Kết tủa trắng hoàn toàn là BaCl2:
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
+ Có thể kết tủa trắng một phần nhỏ là Na2SO4
Na2SO4 + 2AgNO3 → 2NaNO3 + Ag2SO4
c) 4 dung dịch: Na2CO3, AgNO3, CaCl2, HCl.
- Dùng quỳ tím để nhận biết:
+ Quỳ tím hoá đỏ: HCl, AgNO3 (A)
+ Quỳ tím hoá xanh: Na2CO3
+ Quỳ tím không đổi màu: CaCl2
- Cho Na2CO3 vào A:
+ Có khí là HCl:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
+ Có kết tủa là AgNO3:
Na2CO3 + 2AgNO3 → Ag2CO3↓ + 2NaNO3
Câu 2:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
- Trích mẫu thử. Cho lần lượt các mẫu thử vào dung dịch H2SO4.
+ Mẫu thử sủi bọt khí không màu đồng thời xuất hiện ↓ trắng là Ba
Ba + H2SO4 → BaSO4↓ + H2↑
+ Mẫu thử chỉ sủi bọt khí không màu là Mg, Zn và Fe.
Mg + H2SO4 → MgSO4 + H2↑
Zn + H2SO4 → ZnSO4 + H2↑
Fe + H2SO4 → FeSO4 + H2↑
- Cho tiếp Ba dư vào rồi lọc bỏ kết tủa → thu được dung dịch chỉ chứa Ba(OH)2
- Lấy dung dịch này cho từ từ đến dư vào các dung dịch sản phẩm phía trên:
+ Dung dịch cho ↓ trắng → dung dịch là MgSO4 → mẫu thử là Mg.
Ba(OH)2 + MgSO4 → BaSO4↓ + Mg(OH)2↓
+ Dung dịch cho ↓ xanh trắng → dung dịch là FeSO4 → mẫu thử là Fe.
Ba(OH)2 + FeSO4 → BaSO4↓+ Fe(OH)2↓
+ Dung dịch cho ↓ keo trắng lẫn kết tủa trắng rồi tan một phần → dung dịch là ZnSO4 → mẫu thử là Zn.
Ba(OH)2 + ZnSO4 → BaSO4↓ + Zn(OH)2↓
Zn(OH)2 + Ba(OH)2 → BaZnO2 + 2H2O
Câu 3:
Chia 38,6 gam hỗn hợp gồm Fe và kim loại M có hóa trị duy nhất thành 2 phần bằng nhau:
Phần 1: Tan vừa đủ trong 2 lít dung dịch HCl thấy thoát ra 14,56 lít H2 (đktc).
Phần 2: Tan hoàn toàn trong dung dịch HNO3 loãng nóng thấy thoát ra 11,2 lít khí NO duy nhất (đktc).
Kim loại M là:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
\[{n_{{H_2}}} = \frac{{14,56}}{{22,4}} = 0,65(mol)\]
\[{n_{NO}} = \frac{{11,2}}{{22,4}} = 0,5(mol)\]
Gọi nFe = x; nM = y (mol; x,y > 0)
Vì Fe và kim loại M có hóa trị duy nhất tan trong HCl và HNO3 nên áp dụng định luật bảo toàn electron ta có:
\[\left\{ \begin{array}{l}2x + ny = 0,65.2\\3x + ny = 0,5.3\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,2\\ny = 0,9\end{array} \right.\]
\[{m_M} = \frac{{38,6}}{2} - 0,2.56 = 8,1(g) \Rightarrow {n_M} = \frac{{8,1}}{{{M_M}}}\](1)
Mà \[{n_M} = y = \frac{{0,9}}{n}\](2)
Từ (1) và (2) \[\frac{{8,1}}{{{M_M}}} = \frac{{0,9}}{n} \Rightarrow {M_M} = 9n \Rightarrow \left\{ \begin{array}{l}{M_M} = 27\\n = 3\end{array} \right.\]
Vậy M là nhôm (Al).
Câu 4:
Chia 7,22 gam hỗn hợp A gồm Fe và R (R là kim loại có hóa trị không đổi) thành 2 phần bằng nhau:
- Phần 1: Phản ứng với dung dịch HCl dư, thu được 2,128 lít H2 (đktc)
- Phần 2: Phản ứng với HNO3 thu được 1,972 lít NO (đktc) là sản phẩm khử duy nhất.
Xác định kim loại R.
 Xem đáp án
Xem đáp án
Lời giải:
Gọi nFe = a (mol); nR = b (mol)
Gọi n là hóa trị của kim loại R
⇒ \[56a + {M_R}b = \frac{{7,22}}{2} = 3,61(1)\]
Fe + 2HCl → FeCl2 + H2
2R + 2nHCl → 2RCln + nH2
Theo PTHH :
\[{n_{{H_2}}} = a + 0,5bn = \frac{{2,128}}{{22,4}} = 0,095(2)\]
Phần 2 :
\[{n_{NO}} = \frac{{1,792}}{{22,4}} = 0,08(mol)\]
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
3R + 4nHNO3 → 3R(NO3)n + nNO + 4nH2O
Theo PTHH :
\[\begin{array}{l}{n_{NO}} = {n_{Fe}} + \frac{n}{3}{n_R}\\ \Rightarrow a + \frac{{nb}}{3} = 0,08(3)\end{array}\]
Từ (1) (2) và (3) suy ra:
a = 0,05; MRb = 0,81; bn = 0,09 ⇔ \[b = \frac{{0,09}}{n}\]
⇒\[{M_R} = \frac{{{M_R}b}}{b} = \frac{{0,81}}{{\frac{{0,09}}{n}}} = 9n\]
Nếu n = 1 thì MR = 9 → Loại
Nếu n = 2 thì MR = 18 → Loại
Nếu n = 3 thì MR = 27(Al)
Vậy, kim loại R là Al.
Câu 5:
 Xem đáp án
Xem đáp án
Lời giải
Đáp án đúng là: B
Nhận thấy:
\[T = \frac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{{0,5}}{{0,2}} = 2,5\] → tạo hai muối
Na2HPO4 (a mol) và Na3PO4 (b mol)
Bảo toàn nguyên tố Na:
\[{n_{NaOH}} = 2{n_{N{a_2}HP{O_4}}} + 3{n_{N{a_3}P{O_4}}}\]→ 2a + 3b = 0,5 (1)
Bảo toàn nguyên tố P:
\[{n_{{H_3}P{O_4}}} = {n_{N{a_2}HP{O_4}}} + {n_{N{a_3}P{O_4}}}\]→ a + b = 0,2 (2)
Từ (1) và (2) suy ra: a = b = 0,1
\[{m_{N{a_2}HP{O_4}}} = 0,1.142 = 14,2(g)\]
\[{m_{N{a_3}P{O_4}}} = 0,1.164 = 16,4(g)\]
Câu 6:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
\[{n_{A{l^{3 + }}}}\] = 0,04 mol; \[{n_{SO_4^{2 - }}}\] = 0,08 mol; \[{n_{O{H^ - }}}\] = 0,14 mol; \[{n_{B{a^{2 + }}}}\] = 0,07 mol.
\[{n_{BaS{O_4}}}\] = 0,07 mol;
\[\begin{array}{l}A{l^{3 + }} + 3O{H^ - } \to Al{(OH)_3}\\0,04....0,12.........0,04\end{array}\]
\[\begin{array}{l}Al{(OH)_3} + O{H^ - } \to AlO_2^ - + 2{H_2}O\\0,04...........0,02\end{array}\]
\[{n_{Al{{(OH)}_3}}}\]= 0,02 (mol)
Vậy kết tủa gồm Al(OH)3 và BaSO4 có tổng khối lượng = 78.0,02 + 233.0,07 = 17,87 gam.
Câu 7:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
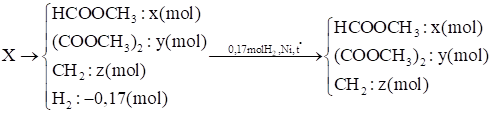
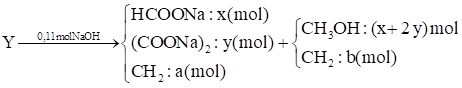
\[\left\{ \begin{array}{l}{n_X} = x + y = 0,08\\{n_{NaOH}} = x + 2y = 0,11\\BTE:8x + 14y + 6z - 0,17.2 = 0,09.8.4\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,05\\y = 0,03\\z = 0,4\end{array} \right.\]
\[\begin{array}{l} \Rightarrow \left\{ \begin{array}{l}b = \frac{{6,88 - 32.0,11}}{{14}} = 0,24\\a = 0,4 - 0,24 = 0,16\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}x = 0,05\\y = 0,03\\a = 0,16\end{array} \right.\end{array}\]
\[\begin{array}{l} \Rightarrow \left\{ \begin{array}{l}H{(C{H_2})_2}{\rm{CO}}ONa:0,05(mol)\\{(C{H_2}{\rm{COONa)}}_2}:0,03(mol)\end{array} \right.\\ \Rightarrow \% {(C{H_2}{\rm{COONa)}}_2} = 50,31\% \end{array}\]
Câu 8:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
Bỏ qua bước trung gian tạo dung dịch X, ta coi như cho lần lượt Lysin (0,1 mol) và NaOH (0,2 mol) tác dụng với HCl.
PTHH:
HOOCR(NH2)2 + 2HCl → muối
NaOH + HCl → NaCl + H2O
Theo các PTHH: \[{n_{HCl}} = 2{n_{ly\sin }} + {n_{NaOH}}\]= 2.0,01 + 0,02 = 0,04 mol
⇒VHCl = 0,04 l = 400 ml.
Câu 9:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Ta có: \[{n_{C{O_2}}} = \frac{{0,112}}{{22,4}} = 0,005(mol)\]
- TH1: Muối cacbonat trung hòa:
Đặt công thức của muối là R2CO3
R2 CO3+ 2HCl → 2RCl+ CO2+ H2O
Theo PTHH: \[{n_{{R_2}C{O_3}}} = {n_{C{O_2}}} = 0,005(mol)\]
→ \[{M_{{R_2}C{O_3}}} = \frac{{0,53}}{{0,005}} = 106\]
→ MR= 23 → Na → Na2CO3
- TH2: Muối cacbonat axit
Đặt công thức của muối là RHCO3
RHCO3+ HCl → RCl+ CO2+ H2O
Theo PTHH: nRHCO3= nCO2= 0,005 mol
→ MRHCO3= 0,53/ 0,005=106
→ MR= 465 → Loại.
Câu 10:
 Xem đáp án
Xem đáp án
Lời giải:
Gọi kí hiệu, nguyên tử khối của kim loại là M.
M + 2H2O → M(OH)2 + H2.
\[{n_{{H_2}}} = \frac{{0,336}}{{22,4}} = 0,015(mol)\]
\[{n_M} = {n_{{H_2}}}\] = 0,015 (mol)
→ \[M = \frac{m}{n} = \frac{{0,6}}{{0,015}} = 40\]. Suy ra nguyên tử khối là 40u.
Vậy nguyên tố kim loại là Ca.
Câu 11:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{{H_2}S{O_4}}}\]= 0,25.0,16=0,04(mol)
Gọi nAl = a (mol); nMg = b (mol)
⇒ 27a + 24b = 0,765 (1)
\[\begin{array}{l}2Al + 3{H_2}S{O_4} \to A{l_2}{\left( {S{O_4}} \right)_3} + 3{\rm{ }}{H_2}\\a.........1,5a.............0,5a\end{array}\]
\[\begin{array}{l}Mg + {H_2}S{O_4} \to MgS{O_4} + {H_2}\\b.........b...............b\end{array}\]
\[ \Rightarrow {n_{{H_2}S{O_4}d{\rm{u}}}} = 0,04 - (1,5a + b)(mol)\]
Gọi \[{n_{Al{{(OH)}_3}}}\]bị hoà tan = c (mol)
nNaOH = 0,25.0,34 = 0,085 (mol)
2NaOH + H2SO4 → Na2SO4 + 2H2O
\[\begin{array}{l}2NaOH + MgS{O_4} \to Mg{\left( {OH} \right)_2} + N{a_2}S{O_4}\\2b..............b.................b\end{array}\]
\[\begin{array}{l}A{l_2}{(S{O_4})_3} + 6NaOH \to 2Al{(OH)_3} + 3N{a_2}S{O_4}\\0,5a................3a...............a\end{array}\]
\[\begin{array}{l}Al{(OH)_3} + NaOH \to NaAl{O_2} + 2{H_2}O\\c...................c\end{array}\]
Ta có:
\[{n_{NaOH}} = 2{n_{{H_2}S{O_4}}} + 2{n_{MgS{O_4}}} + 6{n_{A{l_2}{{(S{O_4})}_3}}} + {n_{Al{{(OH)}_3}}}\]bị hoà tan
→ (0,04 – 1,5 a – b).2 + 2b + 3a + c = 0,085 → c = 0,085 (2)
\[{n_{Mg{{(OH)}_2}}} = b(mol);{n_{Al{{(OH)}_3}}} = a - c(mol)\]
⇔ 58b + (a−c).78 = 1,65
⇔78a + 68b − 78c = 1,65 (3)
Từ (1) (2) và (3) suy ra a = 0,015; b = 0,015; c = 0,005
Vậy dung dịch X chứa :
Al2(SO4)3: 0,5a = 0,0075(mol)
MgSO4: b=0,015
H2SO4 dư: 0,04 − 1,5a − b = 0,0025 (mol)
Suy ra :
\[{n_{A{l^{3 + }}}}\]= 0,075.2 = 0,015 (mol)
\[{n_{M{g^{2 + }}}}\] = 0,015 (mol)
\[{n_{SO_4^{2 - }}}\]= 0,0075.3 + 0,015 + 0,0025 = 0,04
\[{n_{{H^ + }}}\] = 0,0025.2 = 0,005 (mol)
\[\begin{array}{l}B{a^{2 + }} + SO_4^{2 - } \to BaS{O_4}\\0,04....0,04......0,04\end{array}\]
⇒ \[{n_{Ba{{(OH)}_2}}} = {n_{B{a^{2 + }}}}\]= 0,04 (mol)
⇒ \[{V_{hh}} = \frac{{0,04}}{{0,1}} = 0,4\](lít)
nKOH = 0,4.0,8 = 0,32 (mol)
Suy ra:
\[{n_{O{H^ - }}}\] = 0,32 + 0,04.2 = 0,4(mol)
\[{H^ + } + O{H^ - } \to {H_2}O\]
\[M{g^{2 + }} + 2O{H^ - } \to Mg{(OH)_2}\]
\[A{l^{3 + }} + 3O{H^ - } \to Al{(OH)_3}\]
Số mol \[O{H^ - }\] phản ứng với \[A{l^{3 + }}\] là :
\[{n_{O{H^ - }}} = 0,4 - 0,005 - 0,015.2 = 0,365 > 4{n_{A{l^{3 + }}}} = 0,015.4 = 0,06\]
Vậy Al(OH)3 bị hòa tan kết
Suy ra kết tủa gồm: Mg(OH)2 0,015 mol; BaSO4: 0,04 mol
Vậy :
M = 0,015.40 + 0,04.233 = 9,92(gam).
Câu 12:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{{H_2}}} = \frac{{0,504}}{{22,4}} = 0,0225(mol)\]
Phương trình:
\[\begin{array}{l}X{\rm{ }} + {\rm{ }}2HCl{\rm{ }} \to {\rm{ X}}C{l_2} + {\rm{ }}{H_2}\\0,0225...........................0,0225(mol)\end{array}\]
\[ \Rightarrow {M_X} = \frac{{0,9}}{{0,0225}} = 40\]
Vậy X là canxi (Ca).
Câu 13:
Cho 1,04 g hỗn hợp hai kim loại ở hai chu kì liên tiếp thuộc nhóm IIA, tác dụng hết với H2O (dư) thoát ra 0,672 lít khí hidro (đktc).
A. Xác định 2 kim loại đó?
B. Tính phần trăm khối lượng của mỗi kim loại trong hỗn hợp
 Xem đáp án
Xem đáp án
Lời giải:
a, Gọi 2 kim loại đó là M
\[{n_{{H_2}}} = \frac{{0,672}}{{22,4}} = 0,03(mol)\]
M + 2H2O → M(OH)2 + H2↑
0,03 0,03
⇒ \[{M_M} = \frac{{1,04}}{{0,03}} \approx 34,67\] ⇒ 2 kim loại là Mg và Ca
b, gọi nMg = x; nCa = y
⇒ Ta có : x+ y = 0,03; 24x+ 40y = 1,04
⇒ x= 0,01 ; y = 0,02
⇒ \[\% {m_{Mg}} = \frac{{24.0,01}}{{1,04}}.100\% = 23,1\% \]; %mCa = 100% - 23,1% = 76,9%
Câu 14:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Phương trình: M + 2HCl → MCl2 + H2
\[{n_{KL}} = {n_{{H_2}}} = \frac{{0,672}}{{22,4}} = 0,03(mol)\]
\[ \Rightarrow {M_M} = \frac{{1,2}}{{0,03}} = 40\]
Vậy kim loại là canxi (Ca).
Câu 15:
 Xem đáp án
Xem đáp án
Lời giải:
Đặt x, y, z lần lượt là số mol Cu, Mg, Al.
Quá trình nhường e :
Cu → Cu2+ + 2e
x → x → 2x
Mg → Mg2+ + 2e
y → y → 2y
Al → Al3+ + 3e
z → z → 3z
Quá trình thu e:
\[\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} \]
0,03…0,01
\[\mathop N\limits^{ + 5} + 1e \to \mathop N\limits^{ + 4} \]
0,04…0,04
Ta có : 2x + 2y + 3z = 0,03 + 0,04 = 0,07 và 0,07 cũng chính là số mol NO3- tạo muối.
Khối lượng muối nitrat là : 1,35 + 62 × 0,07 = 5,69 (gam).
Câu 16:
a) Viết các phương trình hóa học.
b) Tính thành phần phần trăm theo khối lượng của mỗi kim loại ban đầu.
 Xem đáp án
Xem đáp án
Lời giải:
a) Các phương trình hóa học:
2Al + H2SO4 → Al2(SO4)3 + 3H2
Fe + H2SO4 → FeSO4 + H2
b) \[{{\rm{n}}_{{{\rm{H}}_2}}} = \frac{{11,2}}{{22,4}} = 0,5(mol)\]
Đặt nAl = x, nFe = y
Ta có hệ phương trình: 27x + 56y = 16, 6 và 1,5x + y = 0,5
Giải hệ được: x = y = 0,2 mol.
Suy ra mAl = 0,2.27 = 5,4g
\[\% {m_{Al}} = \frac{{5,4.100\% }}{{16,6}} = 32,53\% \]
% mFe = 67,47%
Câu 17:
 Xem đáp án
Xem đáp án
Lời giải:
6NaOH + Al2(SO4)3 → 3Na2SO4 + 2Al(OH)3
\[ \to \frac{{{n_{NaOH}}}}{6} > \frac{{{n_{A{l_2}{{(S{O_4})}_3}}}}}{1}\]
Suy ra có dung dịch NaOH dư
NaOH + Al(OH)3 → NaAlO2 + 2H2O
\[{n_{Al{{(OH)}_3}}} = 2{n_{A{l_2}{{(S{O_4})}_3}}} = 0,2(mol)\]
\[{n_{NaOHdu}} = 1,05 - 6{n_{A{l_2}{{(S{O_4})}_3}}} = 0,45(mol)\]
\[ \to {n_{NaOHdu}} > {n_{Al{{(OH)}_3}}}\]
Suy ra có dung dịch NaOH dư
\[{n_{NaOHdu}} = 0,45 - {n_{Al{{(OH)}_3}}} = 0,25(mol)\]
Câu 18:
Cho 10,8 gam nhôm tác dụng với dung dịch axit sunfuric H2SO4 10%.
a) Tính khối lượng muối tạo thành và thể tích khí hidro thoát ra ở đktc.
b) Tính khối lượng dung dịch H2SO4 đã dùng.
 Xem đáp án
Xem đáp án
Lời giải:
Ta có pthh
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Theo đề bài ta có
\[{n_{Al}} = \frac{{10,8}}{{27}} = 0,4(mol)\]
a, Theo PTHH:
\[{n_{A{l_2}{{(S{O_4})}_3}}} = \frac{1}{2}{n_{Al}} = \frac{1}{2}.0,4 = 0,2(mol)\]
\[{m_{A{l_2}{{(S{O_4})}_3}}} = 0,2.342 = 68,4(g)\]
\[{n_{{H_2}}} = \frac{3}{2}{n_{Al}} = \frac{3}{2}.0,4 = 0,6(mol)\]
\[ \Rightarrow {V_{{H_2}}} = 0,6.22,4 = 13,44(l)\]
b, Khối lượng dung dịch H2SO4 là:
\[{m_{{\rm{dd}}{H_2}S{O_4}}} = \frac{{10,8.100\% }}{{10\% }} = 108(g)\]
Câu 19:
Để điều chế khí hidro trong phòng thí nghiệm. Người ta dùng 13 gam kẽm tác dụng hoàn toàn với dung dịch HCl.
a) Viết phương trình hoá học phản ứng xảy ra.
b) Tính thể tích H2 sinh ra ở đktc.
c) Nếu cho toàn bộ lượng khí H2 ở trên khử 0,3 mol CuO. Tính lượng đồng kim loại sinh ra.
 Xem đáp án
Xem đáp án
Lời giải
a) Zn + 2HCl → ZnCl2 + H2
b) \[{n_{Zn}} = \frac{{13}}{{65}} = 0,2(mol)\]
PTHH: Zn + 2HCl → ZnCl2 + H2
0,2→0,4 →0,2→ 0,2
\[ \Rightarrow {V_{{H_2}}} = 0,2.22,4 = 4,48(l)\]
c)
PTHH: CuO + H2 Cu + H2O
Xét tỉ lệ: \[\frac{{0,3}}{1} > \frac{{0,2}}{1}\] => CuO dư, H2 hết
PTHH: CuO + H2 Cu + H2O
0,2……….0,2
=> mCu = 0,2.64 = 12,8 (g).
Câu 20:
Cho 2,06 gam hỗn hợp gồm Fe, Al và Cu tác dụng với dung dịch HNO3 loãng, dư, thu được 0,896 lít NO duy nhất (đktc). Khối lượng muối nitrat sinh ra là:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Khối lượng muối nitrat của kim loại
= mkim loại + \[{m_{NO_3^ - }}\] tạo muối
= mkim loại + 62.ne nhường
= 2,06 + 62.0,04.3 = 9,5g
Câu 21:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{Fe}} = \frac{{1,68}}{{56}} = 0,03(mol)\]
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
\[{n_{Fe{{(N{O_3})}_3}}} = {n_{Fe}} = 0,03(mol)\]
\[{m_{Fe{{(N{O_3})}_3}}} = 0,03.242 = 7,26(g)\]
\[{n_{NO}} = {n_{Fe}} = 0,03(mol) \Rightarrow {V_{NO}} = 0,03.22,4 = 0,672(l)\]
Câu 22:
 Xem đáp án
Xem đáp án
Lời giải:
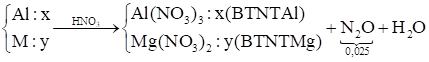
Quá trình cho và nhận e:
\[\begin{array}{l}Al \to \mathop {Al}\limits^{ + 3} + 3e\\2\mathop N\limits^{ + 5} + 8e \to 2\mathop N\limits^{ + 1} ({N_2}O)\\Mg \to \mathop {Mg}\limits^{ + 2} + 2e\end{array}\]
Ta có hệ phương trình:
\[\left\{ \begin{array}{l}BTe:3x + 2y = 0,025.8\\{m_{hh}} = 27x + 24y = 1,86\end{array} \right. \to \left\{ \begin{array}{l}x = 0,06\\y = 0,01\end{array} \right.\]
\[ \Rightarrow {m_{Al{{(N{O_3})}_3}}} = 0,06.213 = 12,78(g)\]
\[ \Rightarrow {m_{Mg{{(N{O_3})}_2}}} = 0,01.148 = 1,48(g)\]
Vậy m = 12,78 + 1,48 = 14,26 (g).
Câu 23:
a) Viết phương trình phản ứng hóa học
b) Tính thành phần % khối lượng của mỗi oxit trong hỗn hợp.
 Xem đáp án
Xem đáp án
Lời giải:
MgO + H2SO4 → MgSO4 + H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 +3H2O
Gọi số mol MgO; Al2O3 lần lượt là x; y.
→40x +102y = 1,82 gam
Ta có:
\[{n_{{H_2}S{O_4}}} = {n_{MgO}} + 3{n_{A{l_2}{O_3}}} = x + 3y = 0,25.0,2 = 0,05\]
Giải được: x = 0,02; y = 0,01
→mMgO = 0,02.40 = 0,8 gam
\[ \to \% {m_{MgO}} = \frac{{0,8}}{{1,82}}.100\% = 43,956\% \to \% {m_{A{l_2}{O_3}}} = 56,044\% \]
Câu 24:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
Số mol NaOH là:
![]()
Gọi x, y lần lượt là số mol của CH3COOH và CH3COOC2H5
CH3COOH + NaOH → CH3COONa + H2O
CH3COOC2H5 + NaOH CH3COONa + C2H5OH
nNaOH = x + y = 0,15.
mhh = 60x + 88y = 10,4.
Giải hệ phương trình ta có x = 0,1; y = 0,05.
Khối lượng etyl axetat :
\[{m_{C{H_3}{\rm{COO}}{{\rm{C}}_2}{H_5}}}\] = 88 . 0,05 = 4,4(g)
![]()
Câu 25:
 Xem đáp án
Xem đáp án
Lời giải:
Phương trình hóa học của phản ứng:
Cu + H2SO4 → Không phản ứng
Fe + H2SO4 → FeSO4 + H2
\[{n_{{H_2}}} = \frac{{2,24}}{{22,4}} = 0,1(mol)\]
mFe = 0,1 x 56 = 5,6g.
Khối lượng Cu không hòa tan là
m = 10 - 5,6 = 4,4g
Câu 26:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
\[{n_{{H_2}}} = \frac{{6,72}}{{22,4}} = 0,3(mol)\]
Gọi công thức chung 2 kim loại là M
M + 2HCl → MCl2 + H2
Mol 0,3 ← 0,3
=> Mtb = 10,4: 0,3 = 34,67 g/mol
=> 2 kim loại là Mg (24) và Ca (40).
Câu 27:
 Xem đáp án
Xem đáp án
Lời giải:
Gọi M là khối lượng mol của kim loại
2M + 3Cl2 → 2MCl3
10,8 g 53,4 g
Theo phương trình: \[{n_M} = {n_{MC{l_3}}} \Rightarrow \frac{{10,8}}{{{M_M}}} = \frac{{53,4}}{{{M_M} + 2.35,5}}\]
⇒ M = 27 (g). Vậy M là nhôm (Al)
Câu 28:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Ta có: \[\frac{{{n_{KOH}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{{0,15}}{{0,1}} = 1,5\]
Giá trị này nằm trong khoảng (1,2)
Dung dịch chứa KH2PO4 và K2HPO4.Câu 29:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{{H_2}}} = \frac{{6,72}}{{22,4}} = 0,3(mol)\]
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Ag không phản ứng với H2SO4
\[{n_{Al}} = \frac{2}{3}{n_{{H_2}}} = \frac{2}{3}.0,3 = 0,2(mol)\]
\[ \to {m_{Al}} = 0,2.27 = 5,4(g) \to {m_{Ag}} = 10 - 5,4 = 4,6(g)\]
Câu 30:
Cho 10 gam hỗn hợp hai kim loại Al và Cu tác dụng vớ dung dịch H2SO4 20% thu được 6,72 lít khí H2 (ở đktc)
a, Viết phương trình phản ứng
b, Tính khối lượng các chất có trong hỗn hợp
c, Tính thành phần trăm khối lượng mỗi kim loại trong hỗn hợp d, tính khối lượng dung dịch H2SO4 cần dùng.
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{{H_2}}} = \frac{{6,72}}{{22,4}} = 0,3(mol)\]
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
\[{n_{Al}} = \frac{2}{3}{n_{{H_2}}} = \frac{2}{3}.0,3 = 0,2(mol)\]
\[ \to {m_{Al}} = 0,2.27 = 5,4(g)\]
mCu = 10 – 5,4 = 4,6 (g)
\[\begin{array}{l}\% {m_{Al}} = \frac{{5,4}}{{10}}.100 = 54\% \\\% {m_{Cu}} = 46\% \end{array}\]
\[\begin{array}{l}{n_{{H_2}S{O_4}}} = 1,5{n_{Al}} = 0,3(mol) \to {m_{{H_2}S{O_4}}} = 29,4(g)\\{m_{{\rm{dd}}{H_2}S{O_4}}} = \frac{{29,4.100}}{{20}} = 147(g)\end{array}\]
Câu 31:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{NO}} = \frac{{6,72}}{{22,4}} = 0,3(mol)\]
Bảo toàn e: ne nhường = ne nhận = 3nNO = 3.0,3 = 0,9 (mol)
Đặt nAl = x (mol); nFe = y (mol)
Ta có: \[\left\{ \begin{array}{l}27x + 56y = 11\\3x + 3y = 0,9\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,2\\y = 0,1\end{array} \right.\]
mAl = 0,2.27 = 5,4 (g)
mFe = 0,1.56 = 5,6 (g)
Câu 32:
Cho 11,2 gam Fe tác dụng với dung dịch HCl. Tính:
a, Thể tích khí H2 thu được ở đktc.
b, Khối lượng HCl phản ứng
c, Khối lượng FeCl2 tạo thành.
 Xem đáp án
Xem đáp án
Lời giải:
Theo đề bài: \[{n_{Fe}} = \frac{{11,2}}{{56}} = 0,2(mol)\]
Phương trình: Fe + 2HCl → FeCl2 + H2
a) Theo phương trình: \[{n_{{H_2}}} = {n_{Fe}} = 0,2(mol)\]
\[ \Rightarrow {V_{{H_2}}} = 0,2.22,4 = 4,48(l)\]
b) Theo phương trình: nHCl = 2nFe = 0,2.2 = 0,4 (mol)
→ mHCl = 0,4. 36,5 = 14,6 (g)
c) Theo phương trình:
\[\begin{array}{l}{n_{FeC{l_2}}} = {n_{Fe}} = 0,2(mol)\\ \Rightarrow {m_{FeC{l_2}}} = 0,2.127 = 25,4(g)\end{array}\]
Câu 33:
Cho 11,2 gam Fe tác dụng với dung dịch HCl 2M vừa đủ.
a. Viết PTHH xảy ra.
b. Tính thể tích HCl cần dùng
c. Tính thể tích chất khí thoát ra ở điều kiện tiêu chuẩn.
 Xem đáp án
Xem đáp án
Lời giải:
a. Phương trình: Fe + 2HCl → FeCl2 + H2
b. Theo đề bài: \[{n_{Fe}} = \frac{{11,2}}{{56}} = 0,2(mol)\]
Theo phương trình: nHCl = 2nFe = 0,2.2 = 0,4 (mol)
\[ \Rightarrow {V_{HCl}} = \frac{{0,4}}{2} = 0,2(l) = 200(ml)\]
c. Theo phương trình: \[{n_{{H_2}}} = {n_{Fe}} = 0,2(mol)\] \[ \Rightarrow {V_{{H_2}}} = 0,2.22,4 = 4,48(l)\]
Câu 34:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{S{O_2}}} = \frac{{4,48}}{{22,4}} = 0,2(mol)\]
Coi hỗn hợp A gồm Fe và O, nếu gọi mFe trong A = x (g, x>0)
→mO = 12,8 – x (g)
→\[{n_{Fe}} = \frac{x}{{56}}(mol),{n_O} = \frac{{12,8 - x}}{{16}}(mol)\]
Quá trình cho và nhận electron:
\[\begin{array}{l}\mathop {Fe}\limits^0 \to \mathop {Fe}\limits^{ + 3} + 3e\\\mathop O\limits^0 + 2e \to \mathop O\limits^{ - 2} \\\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} \end{array}\]
Áp dụng bảo toàn electron, ta có: \[\frac{x}{{56}}.3 = \frac{{12,8 - x}}{{16}}.2 + 0,2.2 \Rightarrow x = 11,2\]
Muối thu được là Fe2(SO4)3 có: \[{n_{F{e_2}{{(S{O_4})}_3}}} = \frac{1}{2}{n_{Fe}} = \frac{1}{2}.\frac{{11,2}}{{56}} = 0,1(mol)\]
\[ \Rightarrow {m_{F{e_2}{{(S{O_4})}_3}}} = 0,1.400 = 40(g)\]
Câu 35:
 Xem đáp án
Xem đáp án
Lời giải:
Gọi nX= a (mol; a > 0)
X + Cl2 → XCl2
a a
Theo bài ra ta có: a.MX = 12
a.(MX + 71) = 47,5
Þ 71a = 47,5 - 12 = 35,5
=> a = 0,5 mol
→MX =12/0,5 = 24 (g/mol)
Vậy X là magie (Mg).
Câu 36:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
\[{n_{{N_2}}} = \frac{{13,44}}{{22,4}} = 0,6(mol)\]
Ta có H = 25% nên: \[{n_{{N_2}phanung}} = 0,6.25\% = 0,15(mol)\]
Phương trình:
\[ \to {n_{N{H_3}}} = 2{n_{{N_2}phanung}} = 2.0,15 = 0,3(mol)\]
\[ \to {m_{N{H_3}}} = 0,3.17 = 5,1(g)\]
Câu 37:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
Gọi nFe = a và nCu = b → 56x + 64y = 15,2
BT e: 3x + 2y = 3nNO = 0,6
→ x = 0,1 và y = 0,15 → mCu = 9,6 (g) → %mCu = 63,16%.
Câu 38:
 Xem đáp án
Xem đáp án
Lời giải:
3Ba(OH)2 + Al2(SO4)3 → 3BaSO4↓ + 2Al(OH)3↓
Ta có:
\[{n_{Ba{{(OH)}_2}}} = 0,15.0,1 = 0,015(mol)\]
\[{n_{A{l_2}{{(S{O_4})}_3}}} = 0,1.0,1 = 0,01(mol)\]
Lập tỉ lệ: \[\frac{{{n_{Ba{{(OH)}_2}}}}}{3} < \frac{{{n_{A{l_2}{{(S{O_4})}_3}}}}}{1}\]
=> Ba(OH)2 hết
Theo PTHH: \[{n_{BaS{O_4}}} = {n_{Ba{{(OH)}_2}}} = 0,015(mol)\]
\[ \to {m_{BaS{O_4}}} = 0,015.233 = 3,495(g)\]
\[{n_{Al{{(OH)}_3}}} = \frac{2}{3}{n_{Ba{{(OH)}_2}}} = \frac{2}{3}.0,015 = 0,01(mol)\]
\[{m_{Al{{(OH)}_3}}} = 0,01.78 = 0,78(g)\]
Vậy khối lượng kết tủa thu được là: 3,495 + 0,78 = 4,275(g).
Câu 39:
 Xem đáp án
Xem đáp án
Lời giải
Đáp án đúng là: B
Phản ứng có thể tạo NH4NO3.
Đặt: nAl = x; nMg = y; \[{n_{N{H_4}N{O_3}}}\] = z (mol)
+ mhh = 27x + 24y = 15 (1)
+ mmuối = \[{m_{Al{{(N{O_3})}_3}}} + {m_{Mg{{(N{O_3})}_2}}} + {m_{N{H_4}N{O_3}}}\] => 213x + 148y + 80z = 109,8 (2)
+ Bảo toàn electron: 3nAl + 2nMg = 3nNO + 8\[{n_{N{H_4}N{O_3}}}\]
=> 3x + 2y = 3.0,2 + 8z (3)
Giải (1) (2) (3) => x = 0,2; y = 0,4; z = 0,1
=> %nAl = 0,2/(0,2+0,4) = 33,33%.
Câu 40:
Cho 16,8 lít CO2 ở điều kiện tiêu chuẩn hấp thụ vào 600 ml NaOH 2M thu được dung dịch A.
a. Tính tổng khối lượng muối trong dung dịch A
b. Lấy dung dịch A tác dụng một lượng dư BaCl2.Tính khối lượng kết tủa thu được
 Xem đáp án
Xem đáp án
Lời giải
Theo đề bài ta có \[\left\{ \begin{array}{l}{n_{C{O_2}}} = \frac{{16,8}}{{22,4}} = 0,75(mol)\\{n_{NaOH}} = 0,6.2 = 1,2(mol)\end{array} \right.\]
Ta xét tỉ lệ :
\[T = \frac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}} = \frac{{1,2}}{{0,75}} = 1,6 < 2\]
Ta có : 1 < T < 2 => Dung dịch A gồm 2 muối là Na2CO3 và NaHCO3
a) Gọi x ,y lần lượt là số mol của CO2 tham gia vào 2 phương trình:
Ta có PTHH :
(1) \[\begin{array}{*{20}{l}}{C{O_2} + {\rm{ }}2NaOH{\rm{ }} \to {\rm{ }}N{a_2}C{O_3} + {\rm{ }}{H_2}O}\\{x............2x...................x}\end{array}\]
(2) \[\begin{array}{*{20}{l}}{C{O_2} + {\rm{ }}NaOH{\rm{ }} \to {\rm{ }}NaHC{O_3}}\\{y............y...................y}\end{array}\]
Ta có hệ phương trình \[\left\{ \begin{array}{l}x + y = 0,75\\2x + y = 1,2\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,45\\y = 0,3\end{array} \right.\]
\[\begin{array}{l}\left\{ \begin{array}{l}{n_{N{a_2}C{O_3}}} = {n_{C{O_2}(1)}} = x = 0,45(mol)\\{n_{NaHC{O_3}}} = {n_{C{O_2}(2)}} = y = 0,3(mol)\end{array} \right.\\ \Rightarrow \left\{ {\begin{array}{*{20}{c}}{{m_{N{a_2}C{O_3}}} = 0,45.106 = 47,7(g)}\\{{m_{NaHC{O_3}}} = 0,3.84 = 25,2(g)}\end{array}} \right.\end{array}\]
=> mA = 47,7 + 25,2 = 72,9 (g)
b) Ta có :
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
0,45mol....................0,45mol
=> mkết tủa = \[{m_{BaC{O_3}}}\] = 0,45.197 = 88,65 (g).
Câu 41:
 Xem đáp án
Xem đáp án
Lời giải:
Metyl axetat là CH3COOCH3: C3H6O2
Etyl axetat: CH3COOC2H5: C4H8O2
Do là các este no đơn chức nên tác dụng với NaOH theo tỉ lệ 1:1
nNaOH = CM.V = 2.0,1 = 0,2 mol
Gọi x là \[{n_{{C_3}{H_6}{O_2}}}\], y là \[{n_{{C_4}{H_8}{O_2}}}\]
Lập hệ phương trình:
\[\left\{ \begin{array}{l}x{\rm{ }} + {\rm{ }}y{\rm{ }} = {\rm{ }}0,2\\74x{\rm{ }} + {\rm{ }}88y{\rm{ }} = {\rm{ }}16,2\end{array} \right. \Rightarrow x = y = 0,1\]
\[\% {m_{{C_3}{H_6}{O_2}}} = \frac{{0,1.74}}{{16,2}}.100\% = 45,68\% \]
\[\% {m_{{C_4}{H_8}{O_2}}} = 100\% - 45,68\% = 54,32\% \]
Câu 42:
Hòa tan hoàn toàn 17,6 gam hỗn hợp X gồm Fe và Cu trong dung dịch HNO3 đặc nóng, dư 20%. Sau phản ứng thu được 17,92 lít khí màu nâu duy nhất.
a. Tính % Fe, Cu.
b. Biết HNO3 dư 20%. Tính V dung dịch NaOH 2M cần để trung hòa X.
c. Cho NaOH 2M vào dung dịch X đến khi kết tủa max. Tính V NaOH?
 Xem đáp án
Xem đáp án
Lời giải:
a. Gọi x, y là số mol Fe, Cu.
⇒56x + 64y = 17,6 (1)
\[{n_{N{O_2}}} = \frac{{17,92}}{{22,4}} = 0,8(mol)\]
Bảo toàn e: 3x + 2y = 0,8 (2)
Từ (1) và (2)⇒x = 0,2; y = 0,1
\[\% {m_{Fe}} = \frac{{56.0,2.100\% }}{{17,6}} = 63,6\% \]
%mCu = 36,4%.
b. Dư 20% HNO3 nên chỉ phản ứng 80% HNO3 so với ban đầu.
\[{n_{HN{O_3}}}\]phản ứng = \[3{n_{Fe{{(N{O_3})}_3}}} + 2{n_{Cu{{(N{O_3})}_2}}} + {n_{N{O_2}}}\]= 3x + 2y + 0,8 = 1,6(mol)
⇒\[{n_{HN{O_3}}}\]dư = 0,4 (mol) = nNaOH
\[{V_{NaOH}} = \frac{{0,4}}{2} = 0,2(l)\]
c. X chứa Fe(NO3)3 (0,2 mol), Cu(NO3)2 (0,1 mol), HNO3 (0,4 mol)
\[ \Rightarrow {n_{NaOH}} = 3{n_{Fe{{(N{O_3})}_3}}} + 2{n_{Cu{{(N{O_3})}_2}}} + {n_{HN{O_3}}} = 1,2(mol)\]
\[ \Rightarrow {V_{NaOH}} = \frac{{1,2}}{2} = 0,6(l)\]
Câu 43:
 Xem đáp án
Xem đáp án
Lời giải:
Gọi số mol Fe; Cu lần lượt là x; y
Ta có:
mhh = mFe + mCu = 56x + 64y = 18,4 gam
Vì HNO3 đặc nóng dư nên khí sinh ra là NO2
\[ \to {n_{N{O_2}}} = \frac{{15,68}}{{22,4}} = 0,7(mol)\]
Bảo toàn e:
3nFe + 2nCu = \[{n_{N{O_2}}}\]→3x + 2y = 0,7
Giải được: x = 0,1; y = 0,2
→mFe = 0,1.56 = 5,6 gam
\[ \to \% {m_{Fe}} = \frac{{5,6}}{{18,4}}.100\% = 30,4\% \] → %mCu = 69,6%.
Câu 44:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
x 3/2 x mol
Fe + H2SO4 → FeSO4 + H2
y y mol
\[ \to \left\{ \begin{array}{l}27x + 56y = 0,83\\\frac{3}{2}x + y = \frac{{0,56}}{{22,4}}\end{array} \right. \Rightarrow \left\{ {x = y = 0,01} \right.\]
\[ \Rightarrow \% {m_{Al}} = \frac{{0,01.27}}{{0,83}}.100\% = 32,53\% \]
⇒%mFe = 100% − 32,53% = 67,47%.
Câu 45:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Phân tử khối của HCl nhỏ hơn của NaOH
=> phản ứng theo tỉ lệ mol 1 : 1 => HCl dư => Quỳ tím chuyển màu sang màu đỏ.
Câu 46:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Giả sử 1 mol khí trao đổi n mol electron.
Áp dụng bảo toàn e: 2nMg = n.n khí → Giá trị của n
+ n = 1 → NO2
+ n = 3 → NO
+ n = 8 → N2O
+ n = 10 → N2
Giải chi tiết:
nMg = 0,1 mol và nX = 0,02 mol
Giả sử 1 mol khí trao đổi n mol electron
Áp dụng bảo toàn e: 2nMg = n.n khí → 2.0,1 = 0,02.n → n = 10
→ Khí là N2.
Câu 47:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
R2CO3 + BaCl2 → BaCO3 + 2RCl
\[{n_{BaC{l_2}}} = {n_{BaC{O_3}}} = 0,2(mol)\]
Bảo toàn khối lượng m = 24,4 + 0,2.208 – 39,4 = 26,6.
Câu 48:
 Xem đáp án
Xem đáp án
Lời giải:
mmuối = mkim loại + \[{m_{NO_3^ - }}\]
→\[{m_{NO_3^ - }}\]= mmuối – mkim loại = 6 – 2,28 = 3,72 (g)
\[ \to {n_{NO_3^ - }} = \frac{{3,72}}{{62}} = 0,06(mol)\]
\[ \to {n_{NO}} = \frac{1}{3}{n_{NO_3^ - }} = 0,02(mol)\]
→ VNO = 0,02. 24,79 = 0,4958 (l) = 495,8 (ml).
Câu 49:
 Xem đáp án
Xem đáp án
Lời giải:
Theo đề bài ta có \[{n_{C{O_2}}} = \frac{{2,464}}{{22,4}} = 0,11(mol)\]
Gọi x ,y lần lượt là số mol của CO2 tham gia vào 2 phương trình:
Ta có PTHH :
(1) \[\begin{array}{*{20}{l}}{C{O_2} + {\rm{ }}2NaOH{\rm{ }} \to {\rm{ }}N{a_2}C{O_3} + {\rm{ }}{H_2}O}\\{x............2x...................x}\end{array}\]
(2) \[\begin{array}{*{20}{l}}{C{O_2} + {\rm{ }}NaOH{\rm{ }} \to {\rm{ }}NaHC{O_3}}\\{y............y...................y}\end{array}\]
Ta có hệ phương trình: \[\left\{ \begin{array}{l}x + y = 0,11\\106x + 84y = 11,44\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,1\\y = 0,01\end{array} \right.\]
\[\begin{array}{l}\left\{ \begin{array}{l}{n_{N{a_2}C{O_3}}} = {n_{C{O_2}(1)}} = x = 0,1(mol)\\{n_{NaHC{O_3}}} = {n_{C{O_2}(2)}} = y = 0,01(mol)\end{array} \right.\\ \Rightarrow \left\{ {\begin{array}{*{20}{c}}{{m_{N{a_2}C{O_3}}} = 0,1.106 = 10,6(g)}\\{{m_{NaHC{O_3}}} = 0,01.84 = 0,84(g)}\end{array}} \right.\end{array}\]
Câu 50:
 Xem đáp án
Xem đáp án
Lời giải:
Gọi \[{n_{{N_2}O}} = a;{n_{{N_2}}} = b(mol)\]
Ta có :
nkhí = a + b = 0,027 (mol)
mkhí = 44a + 28b = M.n = 18,45.2.0,027 = 0,9963(gam)
Suy ra a = 0,015 ; b = 0,012
Bảo toàn electron :
\[3{n_M} = 8{n_{{N_2}O}} + 10{n_{{N_2}}} = 0,015.8 + 0,012.10 = 0,24\]
→ nM = 0,08 (mol)
\[ \Rightarrow {M_M} = \frac{{2,16}}{{0,08}} = 27(g/mol)\]
Vậy kim loại M là nhôm (Al).
Câu 51:
Cho 200 ml dung dịch NaOH 1M tác dụng vừa đủ với 200 ml dung dịch HCl thu được dung dịch X.
a, Tính khối lượng muối có trong dung dịch X.
b, Tính nồng độ mol của dung dịch X.
 Xem đáp án
Xem đáp án
Lời giải:
nNaOH = V. CM = 0,2. 1 = 0,2 (mol)
PTHH: \[\begin{array}{l}NaOH{\rm{ }} + {\rm{ }}HCl{\rm{ }} \to {\rm{ }}NaCl{\rm{ }} + {\rm{ }}{H_2}O\\0,2............................0,2\end{array}\]
a. mNaCl = n. M = 0,2. (23 + 35,5) = 11,7 (g)
b. \[{C_{{M_{NaCl}}}} = \frac{n}{V} = \frac{{0,2}}{{0,2 + 0,2}} = 0,5M\]
Câu 52:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
Ta có: nH3PO4= 0,3 mol; nNaOH = 0,5 mol
Ta có 1 < T = nNaOH/ nH3PO4 =1,67 <2
→ NaOH tác dụng với H3PO4 theo 2 PTHH:
NaOH + H3PO4 → NaH2PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
Đặt \[{n_{Na{H_2}P{O_4}}}\] = x mol; \[{n_{N{a_2}HP{O_4}}}\] = y mol
Ta có \[{n_{{H_3}P{O_4}}}\] = x+ y = 0,3 mol; nNaOH = x + 2y = 0,5 mol
→ x =0,1; y = 0,2
→ \[{m_{Na{H_2}P{O_4}}}\] = 12gam; \[{m_{N{a_2}HP{O_4}}}\]=28,4 gam.
Câu 53:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Dung dịch X có: \[{n_{{H_2}S{O_4}}}\] = 0,2a mol; nHCl = 0,2. 0,1 = 0,02 mol
→ \[{n_{{H^ + }}} = 2{n_{{H_2}S{O_4}}}\] + nHCl = 0,4a + 0,02 (mol); = 0,2a mol
Dung dịch Y có: = 0,3b mol; nKOH = 0,3. 0,05 = 0,015 mol
→\[{n_{O{H^ - }}} = 2{n_{Ba{{(OH)}_2}}}\] + nKOH = 0,6b + 0,015 (mol); \[{n_{B{a^{2 + }}}}\] = 0,3b mol
Dung dịch Z có pH = 12 nên dư \[O{H^ - }\] → \[\left[ {{H^ + }} \right] = {10^{ - 12}}\] (M) → \[\left[ {O{H^ - }} \right] = {10^{ - 2}}\] (M)
→ \[{n_{O{H^ - }}}\]dư = Vdd.CM = 0,5. 10-2 = 0,005 mol
Ta có: \[{n_{Ba{{(OH)}_2}}}\] = 0,01 mol
Xét 2 trường hợp sau:
*TH1: \[{\bf{B}}{{\bf{a}}^{{\bf{2 + }}}}\] phản ứng hết
\[{\rm{B}}{{\rm{a}}^{{\rm{2 + }}}} + SO_4^{2 - } \to BaS{O_4}\]
Khi đó \[{n_{B{a^{2 + }}}} = {n_{Ba{{(OH)}_2}}}\] = 0,01 mol → 0,3b = 0,01 → b = 1/30
→ 0,6b + 0,015 = 0,035 mol
H+ + OH- → H2O
Ban đầu 0,4a + 0,02 0,035 mol
Phản ứng 0,4a + 0,02 0,4a + 0,02 mol
Sau phản ứng 0 0,035 – (0,4a + 0,02) mol
Ta có: \[{n_{O{H^ - }}}\] dư = 0,035 – (0,4a + 0,02) = 0,005 mol → a = 0,025 (không thỏa mãn điều kiện \[{n_{B{a^{2 + }}}} < {n_{SO_4^{2 - }}}\])
*TH2: \[{\bf{SO}}_{\bf{4}}^{{\bf{2 - }}}\] phản ứng hết
\[{\rm{B}}{{\rm{a}}^{{\rm{2 + }}}} + SO_4^{2 - } \to BaS{O_4}\]
Khi đó \[{n_{SO_4^{2 - }}} = {n_{BaS{O_4}}}\] = 0,01 mol → 0,2a = 0,01 → a = 0,05
→ \[{n_{{H^ + }}} = 2{n_{{H_2}S{O_4}}} + {n_{HCl}}\] = 0,4a + 0,02 = 0,04 (mol)
H+ + OH- → H2O
Ban đầu 0,04 (0,6b + 0,015)
Phản ứng 0,04 0,04
Sau phản ứng 0 0,6b – 0,025
Ta có: \[{n_{O{H^ - }}}\] dư = 0,6b – 0,025 = 0,005 mol → b = 0,05
Vậy a = 0,05 và b = 0,05.
Câu 54:
Cho 21,6 gam hỗn hợp A gồm Fe, Fe2O3 tác dụng hết với dung dịch H2SO4 loãng dư thu được 2,24 lít khí H2 (đktc).
a. Viết phương trình hoá học xảy ra và tính phần trăm khối lượng của Fe trong hỗn hợp A.
b. Thổi khí CO qua hỗn hợp A nung nóng một thời gian thu được chất rắn B và 4,4 gam khí CO2. Tính khối lượng chất rắn B?
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{{H_2}}} = \frac{{2,24}}{{22,4}} = 0,1(mol)\]
Fe + H2SO4 → FeSO4 + H2
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
\[ \Rightarrow {n_{Fe}} = {n_{{H_2}}} = 0,1(mol)\]
\[ \Rightarrow \% {m_{Fe}} = \frac{{56.0,1}}{{21,6}}.100 = 25,93\% \]
b. \[{n_{C{O_2}}} = \frac{{4,4}}{{44}} = 0,1(mol)\]
![]()
\[{n_{CO}} = {n_{C{O_2}}} = 0,1(mol)\]
Bảo toàn khối lượng:
\[{m_A} + {m_{CO}} = {m_B} + {m_{C{O_2}}}\]
\[ \Rightarrow {m_B} = 21,6 + 0,1.28 - 4,4 = 20(g)\]
Câu 55:
Cho 21 gam hỗn hợp bột nhôm và nhôm oxit tác dụng dung dịch HCl dư làm thoát ra 13,44 lít khí (đktc).
a) Tính % theo khối lượng mỗi chất trong hỗn hợp đầu.
b) Tính thể tích dung dịch HCl 36% ( D = 1,18 g/ml) để hoà tan vừa đủ hỗn hợp đó.
 Xem đáp án
Xem đáp án
Lời giải:
a. Gọi số mol Al và Al2O3 là a và b
2Al + 6HCl → 2AlCl3 + 3H2
Al2O3 + 6HCl → 2AlCl2 + 3H2O
\[{n_{Al}} = \frac{2}{3}{n_{{H_2}}} = \frac{2}{3}.0,6 = 0,4(mol)\]
→ mAl = 0,4.27 = 10,8
\[ \to \% {m_{Al}} = \frac{{10,8}}{{21}}.100\% = 51,43\% \]
\[ \to \% {m_{A{l_2}{O_3}}} = 100\% - 51,43\% = 48,57\% \]
b. \[{m_{A{l_2}{O_3}}} = \frac{{21 - 10,8}}{{102}} = 0,1(mol)\]
\[{n_{HCl}} = 3{n_{Al}} + 6{n_{A{l_2}{O_3}}} = 3.0,4 + 6.0,1 = 1,8(mol)\]
→mHCl = 1,8. 36,5 = 65,7 (g)
\[ \to {m_{{\rm{dd}}HCl}} = \frac{{65,7.100}}{{36}} = 182,5(g)\]
\[ \to {V_{{\rm{ddHCl}}}} = \frac{{182,5}}{{1,18}} = 154,66(ml)\]
Câu 56:
Cho 23,2 gam hỗn hợp Fe và Cu vào 100 gam dung dịch HCl loãng thấy thoát ra 6,72 lít khí hiđro (đktc).
a. Tính thành phần% về khối lượng của mỗi kim loại trong hỗn hợp
b. Tính nồng độ % của dung dịch muối sau phản ứng.
 Xem đáp án
Xem đáp án
Lời giải
a.\[{n_{{H_2}}} = \frac{{6,72}}{{22,4}} = 0,3(mol)\]
Chỉ có Fe tác dụng với dung dịch HCl
\[\begin{array}{*{20}{l}}{Fe{\rm{ }} + {\rm{ }}2HCl{\rm{ }} \to {\rm{ }}FeC{l_2} + {\rm{ }}{H_2}}\\{0,3 \ldots ..0,6 \ldots \ldots ....0,3 \ldots \ldots 0,3\left( {mol} \right)}\end{array}\]
mFe = 0,3.56 = 16,8 (g)
\[\% {m_{Fe}} = \frac{{16,8}}{{23,2}}.100\% = 72,41\% \]
%mCu = 100% - 72,41% = 27,58%.
b. \[{m_{FeC{l_2}}} = 0,3.127 = 38,1(g)\]
mdd sau = 16,8 + 100 – 0,3.2 = 116,2 (g)
\[C{\% _{FeC{l_2}}} = \frac{{38,1}}{{116,2}}.100\% = 32,79\% \]
Câu 57:
 Xem đáp án
Xem đáp án
Lời giải
\[{n_{{O_2}}} = \frac{{5,6}}{{22,4}} = 0,25(mol)\]
Phương trình:
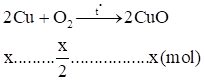
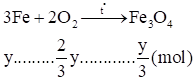
Theo đề bài ra, ta có:
\[\left\{ \begin{array}{l}64x + 56y = 23,2\\\frac{x}{2} + \frac{2}{3}y = 0,25\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,1\\y = 0,3\end{array} \right.\]
mCuO = 0,1.80 = 8(g)
\[{m_{F{e_3}{O_4}}} = 0,3.232 = 69,6(g)\]
b. \[\% {m_{CuO}} = \frac{{8.100\% }}{{8 + 69,6}} = 10,3\% \]
\[ \Rightarrow \% {m_{F{e_3}{O_4}}} = 100\% - 10,3\% = 89,7\% \]
Câu 58:
Cho 24 gam canxi tác dụng với H2SO4 có trong dung dịch loãng.
a) Tìm thể tích khí hiđro sinh ra (ở đktc)
b) Tìm khối lượng của H2SO4
c) Tìm khối lượng của CaSO4 tạo thành sau phản ứng.
 Xem đáp án
Xem đáp án
Lời giải:
a) Phương trình: Ca + H2SO4 → CaSO4 + H2
\[{n_{Ca}} = \frac{{24}}{{40}} = 0,6(mol)\]
Theo phương trình:
\[\begin{array}{l}{n_{{H_2}}} = {n_{Ca}} = 0,6(mol)\\ \to {V_{{H_2}}} = 0,6.22,4 = 13,44(l)\end{array}\]
b) Theo phương trình:
\[{n_{{H_2}S{O_4}}} = {n_{{H_2}}} = 0,6(mol)\]
\[ \to {m_{{H_2}S{O_4}}} = 0,6.98 = 58,8(g)\]
c. Theo phương trình:
\[{n_{CaS{O_4}}} = {n_{{H_2}}} = 0,6(mol)\]
\[ \to {m_{CaS{O_4}}} = 0,6.136 = 81,6(g)\]
Câu 59:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{{H_2}}} = \frac{{4,48}}{{22,4}} = 0,2(mol)\]
Phương trình: Fe + 2HCl → FeCl2 + H2
Theo phương trình: \[{n_{Fe}} = {n_{{H_2}}} = 0,2(mol)\]
→mFe = 0,2.56 = 11,2 (g)
→ mCu = 24 – 11,2 = 12,8 (g).
Câu 60:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{NO}} = \frac{{0,672}}{{22,4}} = 0,03(mol)\]
\[\begin{array}{l}\mathop {Zn}\limits^0 \to \mathop {Zn}\limits^{ + 2} + 2e\\\mathop {Fe}\limits^0 \to \mathop {Fe}\limits^{ + 3} + 3e\\\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} \end{array}\]
Gọi a và b là số mol của Zn và Fe
\[\begin{array}{l} \to 2{n_{Zn}} + 3{n_{Fe}} = 3{n_{NO}}\\ \to 2a + 3b = 0,09(1)\end{array}\]
Mặt khác, ta có: 65a + 56b = 25,1 (2)
Giải (1) và (2) ta có: a = 0,03 mol; b = 0,01 mol
→mFe = 0,01.56 = 0,56 (g)
\[ \to \% {m_{Fe}} = \frac{{0,56.100\% }}{{2,51}} = 22,311\% \]
→%mZn = 77,689%.
Câu 61:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{Zn}} = \frac{{26}}{{65}} = 0,4(mol)\]
Gọi số mol NO và NO2 là a và b
Ta có a + b = 0,4
Theo bảo toàn e: \[3{n_{NO}} + {n_{N{O_2}}} = 2{n_{Zn}}\](1)
→ 3a + b = 0,8 (2)
Giải (1) và (2), ta được: a = b = 0,2 mol.
Theo bảo toàn N
\[\begin{array}{l}{n_{HN{O_3}}} = 2{n_{Zn{{(N{O_3})}_2}}} + {n_{NO}} + {n_{N{O_2}}}\\ \to {n_{HN{O_3}}} = 2.0,4 + 0,2 + 0,2 = 1,2(mol)\end{array}\]
Câu 62:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
\[{n_{Mg}} = \frac{{3,6}}{{24}} = 0,15(mol)\]
\[Mg \to \mathop {Mg}\limits^{ + 2} + 2e\]
\[\mathop N\limits^{ + 5} + (5 - n)e \to \mathop N\limits^{ + n} \]
Bảo toàn electron ta có:
0,15. 2 = 0,1. (5 – n) → n = 2
Vậy khí X là NO.
Câu 63:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{C{O_2}}} = \frac{{3,36}}{{22,4}} = 0,15(mol)\]
nNaOH = 0,1. 0,4 = 0,04 (mol)
nKOH = 0,1. 0,6 = 0,06 (mol)
\[{n_{Ca{{(OH)}_2}}} = 0,1.0,4 = 0,04(mol)\]
\[{n_{O{H^ - }}} = {n_{NaOH}} + {n_{KOH}} + 2{n_{Ca{{(OH)}_2}}} = 0,04 + 0,06 + 2.0,04 = 0,18(mol)\]
Ta có: \[1 < \frac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = \frac{{0,18}}{{0,15}} < 2\]
→ Tạo 2 muối trung hoà và muối axit
\[\begin{array}{l}C{O_2} + O{H^ - } \to HCO_3^ - \\x..........x............x(mol)\end{array}\]
\[\begin{array}{l}C{O_2} + 2O{H^ - } \to CO_3^{2 - } + {H_2}O\\y..........2y.............y\end{array}\]
Ta có hệ phương trình: \[\left\{ \begin{array}{l}x + y = 0,15\\x + 2y = 0,18\end{array} \right. \to \left\{ \begin{array}{l}x = 0,12\\y = 0,03\end{array} \right.\]
mmuối = \[{m_{N{a^ + }}} + {m_{{K^ + }}} + {m_{C{a^{2 + }}}} + {m_{HCO_3^ - }} + {m_{CO_3^{2 - }}}\]
mmuối = 0,04.23 + 0,06.39 + 0,04.40 + 0,12.61 + 0,03.60 = 13,98 (g).
Câu 64:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{{H_2}}} = \frac{{1,792}}{{22,4}} = 0,08(mol)\]
Bảo toàn nguyên tố H: \[{n_{{H_2}S{O_4}}} = {n_{{H_2}}} = 0,08(mol)\]
\[ \to {n_{SO_4^{2 - }}} = {n_{{H_2}S{O_4}}} = 0,08(mol)\]
→mmuối = 3,56 + 0,08.96 = 11,24 (g).
Câu 65:
Cho 3,92 gam bột sắt vào 200 ml dung dịch CuSO4 10% (D = 1,12 g/ml)
a. Tính khối lượng kim loại mới tạo thành.
b. Tính nồng độ mol của chất có trong dung dịch sau phản ứng.
 Xem đáp án
Xem đáp án
Lời giải:
\[\begin{array}{l}{m_{{\rm{dd}}CuS{O_4}}} = 200.1,12 = 224(g)\\ \to {m_{CuS{O_4}}} = \frac{{224.10}}{{100}} = 22,4(g)\\ \to {n_{CuS{O_4}}} = \frac{{22,4}}{{160}} = 0,14(mol)\end{array}\]
\[{n_{Fe}} = \frac{{3,92}}{{56}} = 0,07(mol)\]
Phương trình: Fe + CuSO4 → FeSO4 + Cu
Lập tỉ lệ: \[\frac{{{n_{Fe}}}}{1} < \frac{{{n_{CuS{O_4}}}}}{1}\]→ Fe phản ứng hết, CuSO4 dư
nCu = nFe = 0,07 (mol) →mCu = 0,07.64 = 4,48 (g).
Sau phản ứng thu được dung dịch gồm:
FeSO4: \[{n_{FeS{O_4}}} = {n_{Fe}} = 0,07(mol)\]
CuSO4 dư: \[{n_{CuS{O_4}phanung}} = {n_{Fe}} = 0,07(mol) \to {n_{CuS{O_4}du}} = 0,14 - 0,07 = 0,07(mol)\]
\[ \to {C_{{M_{FeS{O_4}}}}} = {C_{{M_{CuS{O_4}}}}} = \frac{{0,07}}{{0,2}} = 0,35M\]
Câu 66:
 Xem đáp án
Xem đáp án
Lời giải:
Các phương trình xảy ra:
Ca(OH)2 + CO2 → CaCO3 + H2O (1)
Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2)
![]() (3)
(3)
Theo phương trình (1): \[{n_{C{O_2}}} = {n_{CaC{O_3}}} = \frac{{550}}{{100}} = 5,5(mol)\]
Theo phương trình (2), (3): \[{n_{C{O_2}}} = 2{n_{Ca{{(HC{O_3})}_2}}} = 2{n_{CaC{O_3}}} = 2.\frac{{100}}{{100}} = 2(mol)\]
\[\begin{array}{l} \to {n_{C{O_2}}} = 5,5 + 2 = 7,5(mol)\\ \to {V_{C{O_2}}} = 7,5.22,4 = 168(l)\end{array}\]
Câu 67:
 Xem đáp án
Xem đáp án
Lời giải:
![]() (1)
(1)
![]() (2)
(2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O (3)
Theo phương trình (3): \[{n_{C{O_2}}} = {n_{CaC{O_3}}} = \frac{5}{{100}} = 0,05(mol)\]
Gọi a và b lần lượt là số mol của Fe2O3 và FeO
\[\begin{array}{l}\left\{ \begin{array}{l}160a + 72b = 3,04\\3a + b = 0,05\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,01\\b = 0,02\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}{n_{F{e_2}{O_3}}} = 0,01(mol)\\{n_{FeO}} = 0,02(mol)\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{m_{F{e_2}{O_3}}} = 0,01.160 = 16(g)\\{m_{FeO}} = 0,02.72 = 1,44(g)\end{array} \right.\end{array}\]
Câu 68:
Cho 3,07 gam hỗn hợp bột kim loại X gồm Al và Fe vào 150 ml dung dịch hỗn hợp gồm Fe(NO3)3 1,0 M và AgNO3 0,5 M, khuấy đều, sau phản ứng thu được m gam kim loại và dung dịch Y (chứa ba muối). Cho từ từ dung dịch NaOH dư, lấy kết tủa nung đến khối lượng không đổi được 16,0 gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn.
a. Viết phương trình phản ứng có thể đã xảy ra.
b. Tính m và phần trăm khối lượng của Al và Fe trong X?
 Xem đáp án
Xem đáp án
Lời giải:
a. Phương trình phản ứng có thể xảy ra:
Al + Fe(NO3)3 → Al(NO3)3 + Fe
Al + 3AgNO3 → Al(NO3)3 + 3Ag
Fe + 3AgNO3 → Fe(NO3)3 + 3Ag
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
b.
\[\begin{array}{l}{n_{Fe{{(N{O_3})}_3}}} = 0,15.1 = 0,15(mol)\\{n_{AgN{O_3}}} = 0,15.0,5 = 0,075(mol)\end{array}\]
\[ \Rightarrow {n_{NO_3^ - }} = 0,15.3 + 0,075 = 0,525(mol)\]
Dung dịch Y chứa \[A{l^{3 + }}\](a mol), \[F{e^{3 + }}\](b mol), \[F{e^{2 + }}\](c mol) và \[NO_3^ - \](0,525 mol)
Bảo toàn điện tích, ta có: 3a + 3b + 2c = 0,525 (1)
Kim loại tách ra khỏi dung dịch là Ag (0,075 mol)
→mAg = 0,075.108 = 8,1 (g)
Bảo toàn kim loại, ta có:
3,07 + 0,15.56 + 0,075.108 = 27a + 56(b + c) + 0,075.108 (2)
mrắn = \[{m_{F{e_2}{O_3}}} = 160.\frac{{b + c}}{2} = 16\] (3)
Giải hệ (1), (2), (3), ta được: a = 0,01; b = 0,095; c = 0,105.
\[ \to \% {m_{Al}} = \frac{{0,01.27}}{{3,07}}.100 = 8,79\% \]
Câu 69:
Cho 3,33g một kim loại kiềm M tác dụng hoàn toàn với 100ml nước (d = 1 g/ml) thì thu được 0,48 gam khí H2 (đktc).
a) Tìm tên kim loại đó
b) Tính nồng độ % của dung dịch thu được.
 Xem đáp án
Xem đáp án
Lời giải:
\[\begin{array}{l}{m_{{H_2}O}} = V.d = 100.1 = 100(g)\\{n_{{H_2}}} = \frac{m}{M} = \frac{{0,48}}{2} = 0,24(mol)\end{array}\]
2M + 2H2O → 2MOH + H2↑
Theo phương trình: \[{n_M} = 2{n_{{H_2}}} = 2.0,24 = 0,48(mol)\]
\[ \to {M_M} = \frac{{3,33}}{{0,48}} = 6,9375 \approx 7(Li)\]
nLiOH = nLi = 0,48 (mol) →mLiOH = 0,48.24 = 11,52 (g)
mdd = 3,33 + 100 – 0,48 = 102,85 (g)
\[ \Rightarrow C{\% _{LiOH}} = \frac{{11,52.100\% }}{{102,85}} \approx 11,2\% \]
Câu 70:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{Ca{{(OH)}_2}}} = 3.0,015 = 0,045(mol)\]
\[{n_{CaC{O_3}}} = \frac{4}{{100}} = 0,04(mol) < {n_{Ca{{(OH)}_2}}}\]
Gọi chung 2 muối cacbonat của 2 kim loại kế tiếp nhau trong phân nhóm chính nhóm II là RCO3
RCO3 + 2HCl → RCl2 + CO2 + H2O
\[{n_{C{O_2}}} = {n_{RC{O_3}}} = \frac{{3,6}}{{{M_R} + 60}}(mol)\]
TH1: Dư Ca(OH)2
Ca(OH)2 + CO2 → CaCO3 + H2O
\[{n_{C{O_2}}} = {n_{CaC{O_3}}} = 0,04(mol)\]
\[ \Rightarrow \frac{{3,6}}{{{M_R} + 60}} = 0,04 \Rightarrow {M_R} = 30\]
Vậy muối cacbonat của 2 kim loại kế tiếp nhau trong phân nhóm chính nhóm II là MgCO3 ( a mol) và CaCO3 ( b mol)
\[ \Rightarrow \left\{ \begin{array}{l}84a + 100b = 3,6\\a + b = 0,04\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,025\\b = 0,015\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{m_{MgC{O_3}}} = 2,1(g)\\{m_{CaC{O_3}}} = 1,5(g)\end{array} \right.\]
TH2: Có Ca(HCO3)2
Bảo toàn Ca: 0,04 + \[{n_{Ca{{(HC{O_3})}_2}}}\]= 0,045 (mol)
→ \[{n_{Ca{{(HC{O_3})}_2}}}\]= 0,005 (mol)
→\[{n_{C{O_2}}} = {n_{CaC{O_3}}} + 2{n_{Ca{{(HC{O_3})}_2}}} = 0,04 + 2.0,005 = 0,05(mol)\]
\[ \Rightarrow \frac{{3,6}}{{{M_R} + 60}} = 0,05 \Rightarrow {M_R} = 12\]
Vậy muối cacbonat của 2 kim loại kế tiếp nhau trong phân nhóm chính nhóm II là BeCO3 ( a mol) và MgCO3 ( b mol)
\[ \Rightarrow \left\{ \begin{array}{l}69a + 84b = 3,6\\a + b = 0,05\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,04\\b = 0,01\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{m_{BeC{O_3}}} = 2,76(g)\\{m_{MgC{O_3}}} = 0,84(g)\end{array} \right.\]
Câu 71:
Cho 30,2 hỗn hợp gồm CuO, MgO và FeO cho tác dụng vừa đủ với V ml dung dịch H2SO4 1M, sau phản ứng thu được dung dịch chứa 66,2 gam muối. Gía trị của V là:
 Xem đáp án
Xem đáp án
Lời giải
Đáp án đúng là: B
\[{n_{{H_2}S{O_4}}} = \frac{V}{{1000}}.1 = 0,001V(mol)\]
Phương trình chung: MO + H2SO4 → MSO4 + H2O
\[ \to {n_{{H_2}O}} = {n_{{H_2}S{O_4}}} = 0,001V(mol)\]
Áp dụng bảo toàn khối lượng, ta có:
moxit + \[{m_{{H_2}S{O_4}}}\]= mmuối + \[{m_{{H_2}O}}\]
→30,2 + 0,001V.98 = 66,2 + 0,001.18
→V = 450 (ml)
Câu 72:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
\[2{H^ + } + CO_3^{2 - } \to C{O_2} + {H_2}O\]Bảo toàn khối lượng:\[{n_{{H_2}S{O_4}}} = {n_{C{O_2}}} = {n_{{H_2}O}} = \frac{{5,6}}{{22,4}} = 0,25(mol)\]mX = 30 + 0,25.98 – 0,25.44 = 39 gamBảo toàn khối lượng:mmuối (X) = mmuối cacbonat + \[{m_{{H_2}S{O_4}}} - {m_{C{O_2}}} - {n_{{H_2}O}}\]= 30 + 0,25.98 – 0,25.44 – 0,25.18 = 39 gam.
Câu 73:
 Xem đáp án
Xem đáp án
Lời giải:
Chất rắn B là Cu, chất rắn E gồm 2 oxit, nên:
nCuO = nCu = 0,15 (mol)
Gọi a và b lần lượt là số mol của kim loại R và FeO
mX = a.MR + 72b + 80×0,15 = 37,2 (1)
→nR = \[{n_{{H_2}}}\] + nCu → a = 0,3 + 0,15 = 0,45 (2)
E gồm RO (a mol) và Fe2O3 (b/2 mol)
\[{m_E} = a({M_R} + 16) + \frac{{160b}}{2} = 34\] (3)
Từ (1), (2) và (3)
\[ \to \left\{ \begin{array}{l}{M_R} = 24(g/mol)\\b = 0,2\end{array} \right.\]
Vậy R là magie (Mg)
Mg + 2HCl → MgCl2 + H2
FeO + 2HCl → FeCl2 + H2O
nHCl (ban đầu) = 2 (mol)
nHCl (dư) = 2 – 0,45.2 – 0,2.2 = 0,7 (mol)
\[\begin{array}{l}{n_{MgC{l_2}}} = {n_{Mg}} = 0,45(mol)\\{n_{FeC{l_2}}} = {n_{FeO}} = 0,2(mol)\\{m_{{\rm{dd}}A}} = {m_X} + {m_{{\rm{dd}}HCl}} - {m_B} - {m_{{H_2}}} = 527(g)\\ \to C{\% _{HCl(du)}} = \frac{{0,7.36,5}}{{527}}.100\% = 4,85\% \\ \to C{\% _{FeeC{l_2}}} = \frac{{0,2.127}}{{527}}.100\% = 4,82\% \\ \to C{\% _{MgC{l_2}}} = \frac{{0,45.95}}{{527}}.100\% = 8,11\% \end{array}\]
Câu 74:
Cho 38,7 gam hỗn hợp kim loại Cu, Zn tan hết trong dung dịch HNO3 loãng dư, sau phản ứng thu được 8,96 lít khí NO ở đktc (sản phẩm khử duy nhất)
a) Xác định% khối lượng mỗi kim loại trong hỗn hợp
b) Tính thể tích dung dịch HNO3 đã dùng biết dùng dư 20% số lượng cần dùng
c) Tính khối lượng muối thu được sau phản ứng.
 Xem đáp án
Xem đáp án
Lời giải:
Gọi mol Cu là a; số mol Zn là b
Theo bài 64a + 65b = 38,7 (1)
nNO = 0,4 mol
Theo BT(e) 2nCu + 2nZn = 3nNO => 2a + 2b = 0,3.4 (2)
(1,2) => a = b = 0,3 mol
a, \[\% {m_{Cu}} = \frac{{0,3.64}}{{38,7}}.100 = 49,61\% \]
%mZn = 100% − 49,61% = 50,39%
b, Theo BTNT co: \[{n_{HN{O_3}}} = 2{n_{Cu}} + 2{n_{Zn}} + {n_{NO}} = 1,6(mol)\]Vì dùng dư 20% số lượng cần dùng => \[{n_{HN{O_3}}} = 1,6.\frac{{120}}{{100}} = 1,92(mol)\]
Tính thể tích thiếu dữ kiện.
c, Khối lượng muối thu được sau phản ứng là: \[{m_{Cu{{(N{O_3})}_2}}} + {m_{Zn{{(N{O_3})}_2}}} = 113,1(g)\]
Câu 75:
Cho 39,58 gam hỗn hợp G gồm MgCl2, NaCl và NaBr tan hoàn toàn vào nước được dung dịch X. Cho dung dịch X phản ứng với 500ml dung dịch AgNO3 1,4M thu được dung dịch Z và 93,22 gam hỗn hợp kết tủa Y. Cho Mg dư vào dung dịch Z, khuấy đều thấy tạo thành chất rắn có khối lượng tăng so với kim loại Mg ban đầu là 9,6 gam. Biết các phản ứng xảy ra hoàn toàn.
a) Viết phương trình hóa học xảy ra.
b) Tính % khối lượng của các muối trong hỗn hợp G.
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{AgN{O_3}}} = 0,5.1,4 = 0,7(mol)\]
Cho Mg dư vào dung dịch Z có khối lượng tăng so với kim loại Mg ban đầu ⇒ AgNO3 dư
Gọi số mol \[\left\{ \begin{array}{l}{n_{MgC{l_2}}} = a(mol)\\{n_{NaCl}} = b(mol)\\{n_{NaBr}} = c(mol)\end{array} \right.\]
MgCl2 + 2AgNO3 → 2AgCl↓ + Mg(NO3)2
NaCl + AgNO3 → AgCl↓ + NaNO3
NaBr + AgNO3 → AgBr↓ + NaNO3
Ta có: \[{n_{MgC{l_2}}} + {n_{NaCl}} + {n_{NaBr}} = 39,85\]
→ 95a + 58,5b + 103c = 39,58 (1)
Và mAgCl + mAgBr = 93,22
→ 143,5(2a + b) + 188c = 93,22 (2)
Mg + 2AgNO3 → Mg(NO3)2 + 2Ag
nMg phản ứng = x (mol) → nAg = 2x (mol)
→mtăng = mAg – mMg
→ 9,6 = 108.2x – 24x
→ x = 0,05
\[{n_{AgN{O_3}du}} = 0,05.2 = 0,1(mol)\]
\[{n_{AgN{O_3}}}\]phản ứng với G = 0,7 – 0,1 = 0,6 (mol)
Theo phương trình phản ứng với G → 2a + b + c = 0,6 = \[{n_{AgN{O_3}}}\](3)
Giải hệ (1), (2), (3) \[\left\{ \begin{array}{l}a = 0,12\\b = 0,2\\c = 0,16\end{array} \right.\]
\[\begin{array}{l}\% {m_{MgC{l_2}}} = \frac{{0,12.95}}{{39,58}}.100 = 28,8\% \\\% {m_{NaCl}} = \frac{{0,2.58,5}}{{39,58}}.100 = 29,56\% \\\% {m_{NaBr}} = 100 - 28,8 - 29,56 = 41,64\% \end{array}\]
Câu 76:
 Xem đáp án
Xem đáp án
Lời giải:
Gọi R là kí hiệu trung bình của 2 kim loại
2R + 2H2O → 2ROH + H2
ROH + HCl → RCl + H2O
- Theo các PTHH ta có: nR = nROH = nHCl = 0,2 mol
\[{M_R} = \frac{3}{{0,2}} = 15(g/mol)\]
-Ta có: MLi =7 < MR = 15 < MNa = 23
Vậy A là liti (Li).
Câu 77:
Cho vào nước dư 3 gam oxit của 1 kim loại hoá trị 1, ta được dung dịch kiềm, chia dung dịch làm hai phần bằng nhau:
- Phần 1: Cho tác dụng hoàn toàn với 90 ml dung dịch HCl 1M, sau phản ứng dung dịch làm quỳ tím hoá xanh.
- Phần 2: Cho tác dụng với V(ml) dung dịch HCl 1M sau phản ứng dung dịch không làm đổi màu quỳ tím
a. Tìm công thức phân tử oxit
b. Tính V
 Xem đáp án
Xem đáp án
Lời giải:
a. Gọi công thức oxit kim loại hóa trị I: M2O
nHCl = 1.0,09 = 0,09mol
Phương trình phản ứng: M2O + 2HCl → 2MCl + H2O (1)
1,5/(2M + 16) 3/(2M + 16)
(1) suy ra: 3/(2M + 16) > 0,09 → M < 8,67
Suy ra: M là Li
b. \[{n_{L{i_2}O}}\] (1/2 hỗn hợp) = 1,5/30 = 0,05 mol
Phương trình phản ứng: Li2O + 2HCl → 2LiCl + H2O (2)
0,05 0,1
(2) suy ra: V = 0,1/1 = 0,1 lít = 100 ml.
Câu 78:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
PTHH: C2H4 + Br2 → C2H4Br2
Khi cho hỗn hợp khí trên qua dung dich brom thì C2H4 bị giữ lại trong bình
=> mbình tăng = \[{m_{{C_2}{H_4}}}\] = 1,4(g)
\[{V_{{C_2}{H_4}}} = 0,05.22,4 = 1,12(l)\]
\[{V_{{C_2}{H_4}}} = 0,05.22,4 = 1,12(l)\]
\[{V_{C{H_4}}} = 4,48 - 1,12 = 3,36(l)\]
\[\begin{array}{l}\% {V_{C{H_4}}} = \frac{{3,36}}{{4,48}}.100\% = 75\% \\ \Rightarrow \% {V_{{C_2}{H_4}}} = 100\% - 75\% = 25\% \end{array}\]
Câu 79:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
Giả sử ancol đơn chức, no, mạch hở là ROH
Theo tăng giảm khối lượng: \[{n_{ROH}} = \frac{{6,8 - 4,6}}{{22}} = 0,1(mol) \to {M_{ROH}} = \frac{{4,6}}{{0,1}} = 46(g/mol)\]
Vậy ancol đơn chức, no, mạch hở là: C2H5OH.
Câu 80:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{Mg}} = \frac{{4,8}}{{24}} = 0,2(mol)\]; \[{n_{NO}} = \frac{{2,24}}{{22,4}} = 0,1(mol)\]
Dung dịch X có muối NH4NO3
Xét sự thay đổi e ta có:
\[\mathop {Mg}\limits^0 \to \mathop {Mg}\limits^{ + 3} + 3e\]
\[\mathop N\limits^{ + 5} + 8e \to \mathop N\limits^{ - 3} \]
\[\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} \]
Bảo toàn e ta có:
\[\begin{array}{l}2{n_{Mg}} = 3{n_{NO}} + 8{n_{N{H_4}N{O_3}}}\\ \Rightarrow {n_{N{H_4}N{O_3}}} = \frac{{2.0,2 - 0,1.3}}{8} = 0,0125(mol)\end{array}\]
Dung dịch X gồm 2 muối NH4NO3: 0,0125 mol; Mg(NO3)2: 0,2 mol
mX = 0,0125.80 + 0,2.148 = 30,6 (g).
Câu 81:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
\[{n_{Mg}} = \frac{{4,8}}{{24}} = 0,2(mol)\]→ Số mol của Mg(NO3)2: 0,2 mol
\[\begin{array}{l} \to {m_{Mg{{(N{O_3})}_2}}} = 0,2.148 = 29,6(g)\\ \to {m_{N{H_4}N{O_3}}} = 32 - 29,6 = 2,4(g)\\ \to {n_{N{H_4}N{O_3}}} = \frac{{2,4}}{{80}} = 0,03(mol)\end{array}\]
Xét sự thay đổi e ta có:
\[\mathop {Mg}\limits^0 \to \mathop {Mg}\limits^{ + 3} + 3e\]
\[\mathop N\limits^{ + 5} + 8e \to \mathop N\limits^{ - 3} \]
\[2\mathop N\limits^{ + 5} + 8e \to 2\mathop N\limits^{ + 1} \]
Bảo toàn e ta có:
\[\begin{array}{l}2{n_{Mg}} = 8{n_{{N_2}O}} + 8{n_{N{H_4}N{O_3}}}\\ \Rightarrow {n_{{N_2}O}} = \frac{{2.0,2 - 0,03.8}}{8} = 0,02(mol)\end{array}\]
\[ \Rightarrow {V_{{N_2}O}} = 0,02.22,4 = 0,448(l)\]
Câu 82:
Cho 400 ml dung dịch KOH 0,1M vào 100 ml dung dịch H2SO4 0,1M thu được dung dịch Y.
a. Tính nồng độ mol của các ion trong Y?
b. Tính pH của dung dịch Y, xác định môi trường của dung dịch Y?
c. Tính thể tích dung dịch HCl 10% cần để trung hoà dung dịch Y biết D = 1,25 g/ml?
 Xem đáp án
Xem đáp án
Lời giải:
a. nKOH = 0,4.0,1 = 0,04 (mol)
\[{n_{{H_2}S{O_4}}} = 0,1.0,1 = 0,01(mol)\]
\[\begin{array}{l}2KOH{\rm{ }} + {\rm{ }}{H_2}S{O_4} \to {\rm{ }}{K_2}S{O_4} + {\rm{ }}{H_2}O\\0,04...........0,01\\0,02...........0,01..........0,01\\0,02............0...............0,01\end{array}\]
Vdd = 0,4 + 0,1 = 0,5 (l)
\[\begin{array}{l} \to {C_{{M_{KOHdu}}}} = \frac{{0,02}}{{0,5}} = 0,04M\\ \to {C_{{M_{{K_2}S{O_4}}}}} = \frac{{0,01}}{{0,5}} = 0,02M\end{array}\]
b. \[pH = 14 + \log \left[ {O{H^ - }} \right] = 14 + \log \left[ {0,04} \right] = 12,6\]
Vậy môi trường của dung dịch Y là bazơ.
c. Phương trình: HCl + KOH → KCl + H2O
→nHCl = nKOH dư = 0,02 (mol)
→mHCl = 0,02.36,5 = 0,73 (g)
\[\begin{array}{l} \to {m_{{\rm{dd}}HCl}} = \frac{{0,73.100}}{{10}} = 7,3(g)\\ \to {V_{{\rm{dd}}HCl}} = \frac{{7,3}}{{1,25}} = 5,84(ml)\end{array}\]
Câu 83:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
nHCl = 0,04.0,75 = 0,03 mol; \[{n_{Ba{{(OH)}_2}}} = 0,16.0,08 = 0,0128(mol)\];
nKOH = 0,16.0,04 = 0,0064 (mol)
\[ \to \sum {{n_{O{H^ - }}}} = 2.0,0128 + 0,0064 = 0,032(mol)\]
\[{H^ + } + O{H^ - } \to {H_2}O\]
Lập tỉ lệ: \[\frac{{{n_{{H^ + }}}}}{1} < \frac{{{n_{O{H^ - }}}}}{1} \to O{H^ - }\]dư
\[\begin{array}{l}{n_{O{H^ - }du}} = 0,032 - 0,03 = 0,002(mol)\\ \to \left[ {O{H^ - }} \right] = \frac{{0,002}}{{(40 + 160){{.10}^{ - 3}}}} = 0,01M\end{array}\]
\[pH = 14 + \log \left[ {O{H^ - }} \right] = 14 + \log \left[ {0,01} \right] = 12\]
Câu 84:
 Xem đáp án
Xem đáp án
Lời giải
Ta có: mNaOH = 44.10% = 4,4 (g)
\[ \to {n_{NaOH}} = \frac{{4,4}}{{40}} = 0,11(mol)\]
Ta có:
\[\begin{array}{l}{m_{{H_3}P{O_4}}} = 10.39,2\% = 3,92(g)\\ \to {n_{{H_3}P{O_4}}} = \frac{{3,92}}{{98}} = 0,04(mol)\\ \to \frac{{{n_{KOH}}}}{{{n_{{H_3}P{O_4}}}}} = \frac{{0,11}}{{0,04}} = 2,75\end{array}\]
Vậy phản ứng tạo 2 muối: Na3PO4; Na2HPO4
3NaOH + H3PO4 → Na3PO4 + 3H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
\[ \to {n_{{H_2}O}} = {n_{NaOH}} = 0,11(mol)\]
Bảo toàn khối lượng:
\[{m_{NaOH}} + {m_{{H_3}P{O_4}}} = {m_{{H_2}O}}\]+ mmuối
→mmuối = 4,4 + 3,92 – 0,11.18 = 6,34 (g).
Câu 85:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{{H_2}}} = \frac{{3,36}}{{22,4}} = 0,15(mol)\]
Phương trình: 2Al + 6HCl → 2AlCl3 + 3H2
Theo phương trình: \[{n_{Al}} = \frac{2}{3}{n_{{H_2}}} = \frac{2}{3}.0,15 = 0,1(mol)\]
mAl = 0,1.27 = 2,7 (g)
\[\% {m_{Al}} = \frac{{2,7}}{{5,9}}.100\% = 45,76\% \]
%mCu = 100% - 45,76% = 54,24%.
Câu 86:
 Xem đáp án
Xem đáp án
Lời giải:
Ta quy đổi: C4H10 = 3H2 + 2C2H2
\[{n_{C{O_2}}} = \frac{{13,44}}{{22,4}} = 0,6(mol);{n_{B{r_2}}} = 0,2.1 = 0,2(mol)\]\[{n_A} = \frac{{5,04}}{{22,4}} = 0,225(mol)\]
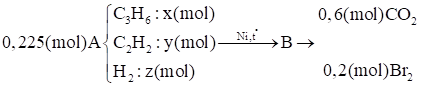
Ta có: x + y + z = 0,225 (1)
Bảo toàn nguyên tố C: 3x + 2y = 0,6 (2)
\[{n_{\pi (A)}} = x + 2y\]
\[{n_{\pi (B)}} = {n_{B{r_2}}} = 0,2(mol)\]
\[ \to {n_{\pi phanung}} = {n_{\pi (A)}} - {n_{\pi (B)}} = x + 2y - 0,2 = {n_{{H_2}}} = z\]
→ x+ 2y – z = 0,2 (3)
Từ (1) (2) (3) ta được: \[\left\{ \begin{array}{l}x + y + z = 0,225\\3x + 2y = 0,6\\x + 2y - z = 0,2\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,19\\y = 0,015\\z = 0,02\end{array} \right.\]
Nếu cho 7,56 lít (đktc) hỗn hợp A đi qua bình đựng dung dịch Br2
\[{n_A} = \frac{{7,56}}{{22,4}} = 0,3375(mol)\]
Tỉ lệ: \[\frac{{0,3375}}{{0,225}} = 1,5\]nên trong 7,56 lít (đktc) hỗn hợp A có C3H6: 0,285 mol; C2H2: 0,0225 mol; H2: 0,03 mol
Với \[\begin{array}{l}{C_4}{H_{10}} = {\rm{ }}3{H_2} + {\rm{ }}2{C_2}{H_2}\\a..............3a.........2a\end{array}\], C2H2: b mol; H2: c mol ta có hệ phương trình:
\[\left\{ \begin{array}{l}2a + b = 0,0225\\3a + c = 0,03\\a + b + c = 0,3375 - 0,285\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0\\b = 0,0225\\c = 0,03\end{array} \right.\]
\[{n_{\pi (A)}} = {n_{{C_3}{H_6}}} + 2{n_{{C_2}{H_2}}} = 0,285 + 2.0,0225 = 0,33(mol) = {n_{B{r_2}}}\]
\[ \to {m_{B{r_2}}} = 0,33.160 = 52,8(g)\]
Câu 87:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
nAl = 5,4/27 = 0,2 mol.
Phương trình hoá học:
4Al + 3O2 → 2Al2O3.
Theo phương trình hoá học có: \[{n_{{O_2}}} = \frac{3}{4}{n_{Al}} = 0,15(mol).\]
Bảo toàn khối lượng:
\[{m_{A{l_2}{O_3}}} = {m_{Al}} + {m_{{O_2}}} = 5,4 + 0,15.32 = 10,2(gam).\]
Câu 88:
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{Mg}} = \frac{{5,52}}{{24}} = 0,23(mol)\]
\[{\overline M _{hh}} = 16.2 = 32(g/mol)\]
\[{n_{hh}} = \frac{{0,896}}{{22,4}} = 0,04(mol)\]
\[{n_{{N_2}}} = x;{n_{{N_2}O}} = y(mol;x,y > 0)\]
\[\left\{ \begin{array}{l}\frac{{28x + 44y}}{{(x + y)}} = 32\\x + y = 0,04\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,03\\y = 0,01\end{array} \right.\]
Dung dịch thu được có thể chứa NH4NO3: a (mol)
Quá trình nhường e
\[\begin{array}{l}Mg \to \mathop {Mg}\limits^{ + 2} + 2e\\0,23.............0,46(mol)\end{array}\]
Quá trình nhận e
\[2\mathop N\limits^{ + 5} + 10e \to \mathop {{N_2}}\limits^0 \]
\[2\mathop N\limits^{ + 5} + 8e \to 2\mathop N\limits^{ + 1} \]
\[\mathop N\limits^{ + 5} + 8e \to \mathop N\limits^{ - 3} \]
ne nhận = \[10{n_{{N_2}}} + 8{n_{{N_2}O}} + 8{n_{N{H_4}N{O_3}}} = 10.0,03 + 8.0,01 + 8a = 0,38 + 8a(mol)\]
Bảo toàn e ta có:
0,46 = 0,38 = 8a
→ a = 0,01 (mol)
→ \[{n_{N{H_4}N{O_3}}}\]= 0,01 (mol)
Vậy dung dịch thu được gồm: Mg(NO3)2: 0,23 (mol) và NH4NO3: 0,01 (mol)
Cô cạn thu được mrắn = \[{m_{Mg{{(N{O_3})}_2}}} + {m_{N{H_4}N{O_3}}}\] = 0,23.148 + 0,01.80 = 34,84 (g)
Câu 89:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
\[{n_{Fe}} = \frac{{5,6}}{{56}} = 0,1(mol)\]
Vì Fe tác dụng với lượng dư dung dịch AgNO3 nên chỉ xảy ra phản ứng sau:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Theo phương trình: nAg = 2nFe = 2.0,1 = 0,2 (mol)
→mAg = 0,2.108 = 21,6 (g).
Câu 90:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Gọi kim loại cần tìm là A, oxit của kim loại A, hoá trị II là AO
Phương trình: AO + 2HCl → ACl2 + H2O
Ta có:
\[\begin{array}{l}{n_{AO}} = \frac{{5,6}}{{{M_A} + 16}}(mol)\\{n_{AC{l_2}}} = \frac{{11,1}}{{{M_A} + 71}}(mol)\end{array}\]
Theo phương trình: \[{n_{AO}} = {n_{AC{l_2}}}\]
\[ \to \frac{{5,6}}{{{M_A} + 16}} = \frac{{11,1}}{{{M_A} + 71}} \to {M_A} = 40(g/mol)\]
Vậy A là canxi (Ca).
Câu 91:
 Xem đáp án
Xem đáp án
Lời giải
Do M thuộc nhóm IA nên M có hóa trị I
PTHH: 2M + 2HCl → 2MCl + H2
\[{n_{{H_2}}} = \frac{{2,8}}{{22,4}} = 0,125(mol)\]
\[ \Rightarrow {n_M} = 2{n_{{H_2}}} = 2.0,125 = 0,25(mol)\]
\[ \to {M_M} = \frac{{5,75}}{{0,25}} = 23(g/mol)\]
Vậy M là Na (Sodium).
Câu 92:
 Xem đáp án
Xem đáp án
Lời giải
\[{n_{B{r_2}}} = 0,05.1 = 0,05(mol)\]
Phương trình: SO2 + Br2 + 2H2O → 2HBr + H2SO4
Theo phương trình: \[{n_{S{O_2}}} = {n_{B{r_2}}} = 0,05(mol)\]
Khi cho Cu và Al tác dụng với H2SO4 đặc nguội thì chỉ có Cu phản ứng:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Theo phương trình trên: \[{n_{Cu}} = {n_{S{O_2}}} = 0,05(mol)\]
→mCu = 0,05.64 = 3,2 (g)
→mAl = 5,9 – 3,2 = 2,7 (g)
\[ \to {n_{Al}} = \frac{{2,7}}{{27}} = 0,1(mol)\]
Tổng số mol của hỗn hợp 2 kim loại trên là 0,05 + 0,1 = 0,15 (mol).
Câu 93:
Cho 5,6 gam Fe tác dụng với 500 ml dung dịch HNO3 0,8M. Sau phản ứng thu được V lít hỗn hợp khí A gồm N2O và NO2 có tỉ khối so với H2 là 22,25 và dung dịch B.
a. Tính V (đktc)
b. Tính CM các chất trong dung dịch B.
 Xem đáp án
Xem đáp án
Lời giải:
\[{n_{Fe}} = \frac{{5,6}}{{56}} = 0,1(mol)\]
\[{n_{HN{O_3}}} = 0,5.0,8 = 0,4(mol)\]
a. Đặt x, y lần lượt là số mol của N2O và NO2.
PTHH xảy ra:
8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O (1)
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O (2)
Theo PTHH (1), (2), \[{n_{Fe}} = \frac{8}{3}{n_{{N_2}O}} + \frac{1}{3}{n_{N{O_2}}} = \frac{8}{3}x + \frac{1}{3}y = 0,1(*)\]
Tỉ lệ thể tích các khí trên là:
Gọi a là thành phần % theo thể tích của khí N2O
Vậy (1 – a) là thành phần % của khí NO2
Ta có: 44a + 46(1 – a) = 22,25.2 = 44,5
→ a = 0,75 hay % của khí N2O là 75% và của khí NO2 là 25%
Tỉ lệ về thể tích cũng là tỉ lệ về số mol nên x = 3y (**)
Giải (*), (**) ta được x = 0,036, y = 0,012
Vậy thể tích của các khí thu được là:
V = ( 0,012 + 0,036).22,4 = 1,08 (l)
b.
\[\begin{array}{l}{n_{HN{O_3}phanung}} = 10{n_{{N_2}O}} + 2{n_{N{O_2}}} = 10.0,036 + 2.0,012 = 0,384(mol)\\ \to {n_{HN{O_3}du}} = 0,4 - 0,384 = 0,016(mol)\end{array}\]
\[{n_{Fe{{(N{O_3})}_3}}} = {n_{Fe}} = 0,1(mol)\]
Vậy nồng độ các chất trong dung dịch là:
\[\begin{array}{l}{C_M}_{Fe{{(N{O_3})}_3}} = \frac{{0,1}}{{0,5}} = 0,2M\\{C_{MHN{O_3}}} = \frac{{0,016}}{{0,5}} = 0,032M\end{array}\]
Câu 94:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
\[{n_{{H_2}}} = \frac{{0,48}}{2} = 0,24(mol)\]
Gọi hoá trị của kim loại M là n (\[1 \le n \le 3\])
PTHH: 2M + 2nHCl → 2MCln + nH2
Theo phương trình: \[{n_M} = \frac{2}{n}{n_{{H_2}}} = \frac{{0,48}}{n}(mol)\]
\[ \to {n_M} = \frac{{5,76}}{{{M_M}}} = \frac{{0,48}}{n}(mol)\]
\[{M_M} = \frac{{5,76}}{{0,48}}n = 12n(g/mol)\]
Với n = 2 thì MM = 24 (g/mol)
Vậy M là magie (Mg).
Câu 95:
 Xem đáp án
Xem đáp án
Lời giải:
Sau phản ứng, hỗn hợp khí gồm O2 (dư) và N2
Gọi \[{n_{{O_2}d{\rm{u}}}} = a(mol);{n_{{N_2}}} = b(mol)\]
Ta có :
nkhí = a + b = \[\frac{{6,72}}{{22,4}}\] = 0,3 (mol)
mkhí = 32a + 28b = 0,3.15.2 = 9(gam)
⇒ a = 0,15; b = 0,15
Gọi \[{n_{{O_2}bandau}} = a(mol)\]
Ta có :
mkhí = \[{m_{{O_2}}} + {m_{{N_2}}}\]
⇒ 32a + 0,15.28 = (a + 0,15).15,6.2
⇒ a = 0,6
⇒\[{n_{{O_2}phanung}}\]= a − 0,15 = 0,6 − 0,15 = 0,45(mol)
Gọi hóa trị của Y là n
4Y + nO2 2Y2On
Theo phương trình, ta có :
\[{n_Y} = \frac{4}{n}{n_{{O_2}}} = \frac{4}{n}.0,45 = \frac{{1,8}}{n}(mol)\]
\[\begin{array}{l} \Rightarrow {m_Y} = \frac{{1,8}}{n}.{M_Y} = 58,5\\ \Rightarrow {M_Y} = \frac{{65}}{2}n\end{array}\]
Với n =1thì MY = 32,5 (loại)
Với n = 2 thì MY = 65 (Zn)
Với n = 3 thì MY = 97,5 (loại)
Vậy Y là kim loại Zn (kẽm).
Câu 96:
Cho 6,2 gam hỗn hợp 2 kim loại kiềm thuộc 2 chu kì liên tiếp tác dụng với H2O thu được 2,24 lít khí (đktc).
a. Xác định 2 kim loại kiềm
b. Tính khối lượng 2 hiđroxit thu được
c. Tính V dung dịch H2SO4 1M cần trung hòa hết 2 hiđroxit này.
 Xem đáp án
Xem đáp án
Lời giải:
a) 2M + 2H2O → 2MOH + H2
\[{n_{{H_2}}} = \frac{{2,24}}{{22,4}} = 0,1(mol)\]
\[{n_M} = 2{n_{{H_2}}} = 0,2(mol)\]
\[{M_M} = \frac{{6,2}}{{0,2}} = 31(g/mol)\]
MA < MM < MB
→ A: Natri (Na), B: Kali (K)
b) Hỗn hợp: Na (a mol), K (b mol)
\[ \to \left\{ \begin{array}{l}23a + 39b = 6,2\\\frac{a}{2} + \frac{b}{2} = 0,1\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,1\\b = 0,1\end{array} \right.\]
nNaOH = nNa = 0,1 (mol)
mNaOH = 0,1.40 = 4 (g)
nKOH = nK = 0,1 (mol)
mKOH = 0,1.56 = 5,6 (g)
c. 2NaOH + H2SO4 → Na2SO4 + 2H2O
2KOH + H2SO4 → K2SO4 + 2H2O
\[{n_{{H_2}S{O_4}}} = \frac{{{n_{NaOH}} + {n_{KOH}}}}{2} = 0,1(mol)\]
\[{V_{{H_2}S{O_4}}} = \frac{{0,1}}{1} = 0,1(l) = 100(ml)\]
Câu 97:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
Bảo toàn nguyên tố C, ta có:
\[\begin{array}{l}{n_{C{O_2}}} = {n_{{K_2}C{O_3}}} + {n_{KHC{O_3}}} = 0,075(mol)\\ \Rightarrow \% {n_{C{O_2}}} = \frac{{0,075.22,4}}{6}.100\% = 28\% \end{array}\]
Câu 98:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
nCu = 0,1 mol; \[\sum {{n_{{H^ + }}}} \] = 0,24 mol; \[{n_{NO_3^ - }}\] = 0,12 mol.
\[3Cu{\rm{ }} + {\rm{ }}8{H^ + }\; + {\rm{ }}2NO_3^ - \; \to {\rm{ }}3C{u^{2 + }}\; + {\rm{ }}2NO{\rm{ }} + {\rm{ }}4{H_2}O\]
⇒ H+ hết ⇒ nNO = 0,06 mol ⇒ V = 1,344 lít.
Câu 99:
Cho 60 gam hỗn hợp gồm Cu và CuO tác dụng hết với 3 lít dd HNO3 1M thu được 13,44 lít NO (đkc).
Tính khối lượng CuO trong hỗn hợp ban đầu ?
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
nNO = 0,6 (mol)
→ ne nhận = 3nNO = 1,8 (mol)
→ nCu = ne nhận : 2 = 0,9 (mol)
→ mCu = 0,9.64 = 57,6 (g) → mCuO = 60 – 57,6 = 2,4 (g).
Câu 100:
Cho 60 gam hỗn hợp gồm Cu và CuO tác dụng hết với 3 lít dd HNO3 1M thu được 13,44 lít NO (đkc).
Tính nồng độ mol các chất trong dd sau phản ứng ? Biết thể tích dung dịch không thay đổi.
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
nCuO = 0,03 (mol)
\[\begin{array}{l} \to {n_{Cu{{(N{O_3})}_2}}} = {n_{Cu}} + {n_{CuO}} = 0,93(mol)\\ \to {C_M}_{Cu{{(N{O_3})}_2}} = \frac{{0,93}}{3} = 0,31M\end{array}\]
\[{n_{HN{O_3}}}\]= ne nhận + nNO + 2nCuO = 1,8 + 0,6 + 2.0,03 = 2,46 (mol)
→\[{n_{HN{O_3}}}\]dư = 3 – 2,46 = 0,54 (mol)
\[{C_M}_{HN{O_3}} = \frac{{0,54}}{3} = 0,18M\]
Câu 101:
 Xem đáp án
Xem đáp án
Lời giải:
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
Fe + 2HCl → FeCl2 + H2↑
ZnS + 2HCl → ZnCl2 + H2S↑
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
CaSO3 + 2HCl → CaCl2 + SO2↑ + H2O
9Fe(NO3)2 + 12HCl → 5Fe(NO3)3 + 4FeCl3 + 3NO↑+ 6H2O
CaC2 + 2HCl → CaCl2 + CH≡CH↑
Al4C3 + 12HCl → 4AlCl3 + 3CH4↑
Na2O2 + 2HCl → 2NaCl + H2O + ½ O2↑
Câu 102:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Hỗn hợp rắn X gồm P2O5 (x mol) và P2O3 (y mol);
\[\left\{ \begin{array}{l}2x + 2y = 0,25\\142x + 110y = 16,15\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,075\\y = 0,05\end{array} \right.\]
\[{m_{{P_2}{O_5}}}\] = 0,075.142 = 10,65 gam.
Câu 103:
Cho 7,8 gam hỗn hợp hai kim loại Al và Mg vào dung dịch HCl dư thu được 8,96 lít khí H2
a) Viết các phương trình phản ứng xảy ra
b) Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp ban đầu
c) Tính khối lượng muối thu được sau phản ứng.
 Xem đáp án
Xem đáp án
Lời giải:
1,
\[\begin{array}{l}2Al + 6HCl \to 2AlC{l_3} + 3{H_2}\\a......................................1,5a(mol)\end{array}\]
\[\begin{array}{l}Mg + 2HCl \to MgC{l_2} + {H_2}\\b.......................................b(mol)\end{array}\]
2, Đặt a = nAl, b = nMg
\[{n_{{H_2}}} = 0,4(mol)\]
Ta có:
\[\left\{ \begin{array}{l}27a + 24b = 7,8\\1,5a + b = 0,4\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,2\\b = 0,1\end{array} \right.\]
→ nAl = 0,2 mol → mAl = 5,4 (g)
→ %Al = 69,23%, %Mg= 30, 76%
3, mmuối = \[{m_{AlC{l_3}}} + {m_{MgC{l_2}}}\] = 0,2.133,5 + 0,1. 95 = 36,2 (g).
Câu 104:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
Nhận xét: Kim loại + HCl → muối + H2
Ta có: mdung dịch tắng = mkim loại – mkhí thoát ra
\[ \to {m_{{H_2}}}\]= 7,8 – 7 = 0,8 (gam) \[ \to {n_{{H_2}}} = 0,4(mol)\]
Áp dụng bảo toàn nguyên tố H: \[{n_{HCl}} = 2{n_{{H_2}}} = 0,8(mol)\]Câu 105:
 Xem đáp án
Xem đáp án
Lời giải:
2A + Cl2 → 2ACl ( vì A hóa trị I → ACl)
2 1 2 ( mol)
Ta có: nA = nACl
\[ \to \frac{{78}}{{{M_A}}} = \frac{{149}}{{{M_A} + 35,5}}\]
→ MA = 39 (g/mol)
Vậy A là kali (K).
