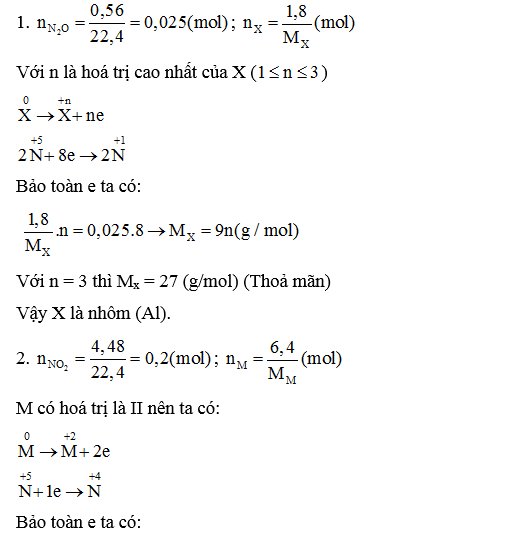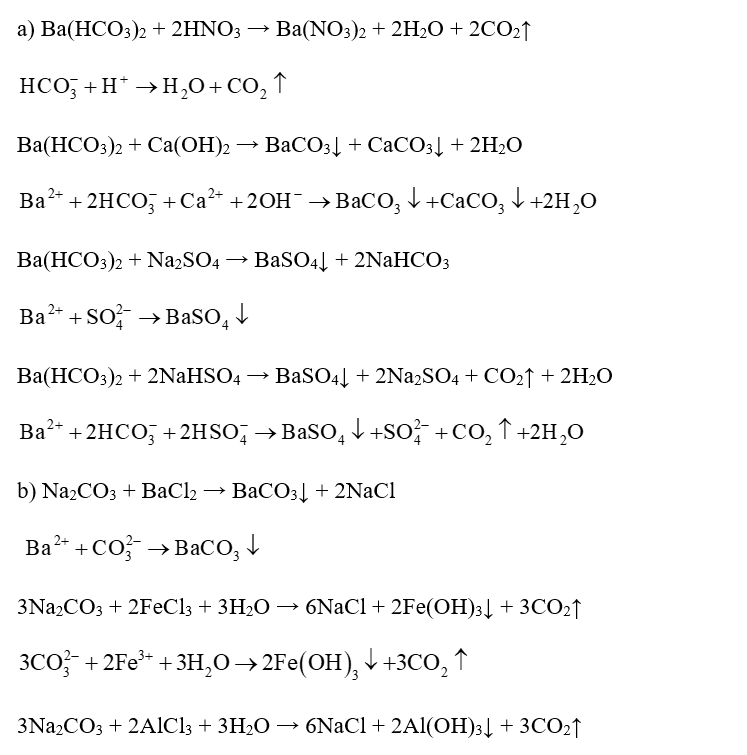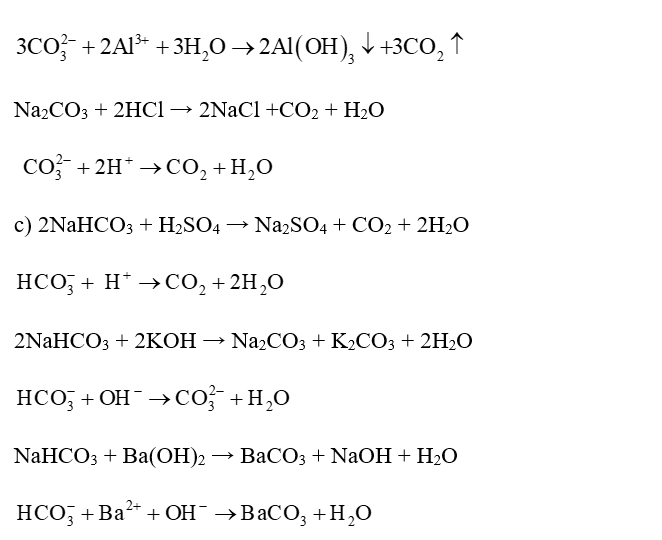Trắc nghiệm tổng hợp Hóa học năm 2023 có đáp án (Phần 7)
-
1810 lượt thi
-
50 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Sb chứa 2 đồng vị chính 121Sb và 123Sb, khối lượng nguyên tử trung bình của Sb là 121,75. Thành phần % khối lượng của đồng vị 121Sb trong Sb2O3 là?
Câu 2:
Một loại quặng boxit chứa 48,5% Al2O3. Từ 1 tấn quặng boxit nói trên có thể điều chế được bao nhiêu kilôgam nhôm ? (Biết hiệu suất của quá trình điều chế là 90%).
 Xem đáp án
Xem đáp án
1 tấn = 1000 kg = 1 000 000 gam
→mAl thực tế = 256,5. 90% = 230,85 (kg).
Câu 3:
Viết phương trình phân tử và phương trình ion thu gọn khi trộn lẫn các dung dịch sau (nếu có):
a. CH3COOH và NaOH;
b. H2S và Pb(NO3)2;
c. H2SO4 và BaCl2;
d. NaHCO3 và HCl;
e. NaHCO3 và NaOH;
f. NaCl và KCl;
g. (NH4)2CO3 và HCl;
h. CaCO3 và HCl.
 Xem đáp án
Xem đáp án
a. CH3COOH + NaOH → CH3COONa + H2O
b. H2S + Pb(NO3)2 → PbS↓ + 2HNO3
c. H2SO4 + BaCl2 → BaSO4 + 2HCl
d. NaHCO3 + HCl → NaCl + H2O + CO2↑
e. NaHCO3 + NaOH → Na2CO3 + H2O
f. Không xảy ra phản ứng;
g. (NH4)2CO3 + 2HCl → 2NH4Cl + H2O + CO2↑
h. CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Câu 4:
NH4)2SO4 làm quỳ tím hoá thành màu gì?
 Xem đáp án
Xem đáp án
(NH4)2SO4 làm quỳ tím hoá thành màu đỏ vì (NH4)2SO4 có tính axit.
Câu 5:
 Xem đáp án
Xem đáp án
VHCl = 224 ml = 0,224 lít
Câu 6:
0,5 mol CuO tác dụng vừa đủ với:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phương trình: CuO + H2SO4 → CuSO4 + H2O
Theo phương trình:
Câu 7:
Xà phòng hoá hoàn toàn 14,8 gam một chất hữu cơ X có công thức phân tử C3H6O2 bằng 300 ml dung dịch NaOH 1M. Cô cạn dung dịch sau phản ứng, thu được 17,6 gam chất rắn khan. Công thức của X là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
nNaOH = 0,3. 1 = 0,3 (mol)
Vì X phản ứng với NaOH theo tỉ lệ 1: 1 nên nNaOH phản ứng = nX = 0,2 (mol)
→nNaOH dư = 0,3 – 0,2 = 0,1 (mol) →mNaOH dư = 0,1. 40 = 4(g)
Nên khi cô cạn dung dịch sau phản ứng, thu được 17,6 gam chất rắn khan gồm NaOH dư và muối → mMuối = 17,6 – 4 = 13,6 (g)
→MMuối = → Công thức của muối là HCOONa
→ Với X có công thức phân tử C3H6O2 thì công thức của X là HCOOCH2CH3.
Câu 9:
Hoà tan 3,06 gam oxit MxOy bằng dung dich HNO3 dư sau đó cô cạn thì thu được 5,22 gam muối khan. Hãy xác định kim loại M biết nó chỉ có một hoá trị duy nhất.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phương trình:
Theo phương trình:
→ y = 2; x = 2 (Thoả mãn) nên MM = 137 (g/mol)
Vậy M là bari (Ba).
Câu 10:
Este E (no, mạch hở), phân tử có chứa 3 liên kết π. Công thức phân tử của E có dạng là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Vì este E no nên không có liên kết π ở gốc hiđrocacbon.
Mà phân tử có 3 liên kết π nên E sẽ có 3 chức este COO.
Vậy E no, ba chức.
Cách 1: E no, ba chức nên độ bất bão hoà k = 3. Vậy este: CnH2n-4O6.
Cách 2: Khái quát hoá:
(HCOO)3C3H5 → C6H8O6 → CnH2n-4O6.
Câu 11:
Tính số mol của:
a) 142 gam Cl2;
b) 41,1 gam H2SO4;
c) 9.1023 phân tử Na2CO3;
d) 16,8 lít khí CO2 (đktc).
 Xem đáp án
Xem đáp án
a)
b)
c)
d)
Câu 12:
Cho 16,8 lít khí SO2 ở đktc. Tính:
a) số mol SO2
b) khối lượng SO2
c) số phân tử SO2
d) số nguyên tử oxi trong hợp chất SO2
 Xem đáp án
Xem đáp án
c) Số phân tử SO2 = 0,75. 6.1023 = 4,5.1023 phân tử
d) Số nguyên tử O trong hợp chất SO2 = 2. Số phân tử SO2 = 9.1023 nguyên tử.
Câu 13:
Hai nguyên tố X, Y thuộc 2 ô liên tiếp trong bảng tuần hoàn. Tổng số hạt mang điện trong cả 2 nguyên tử X và Y là 66 (biết ZX < ZY). Hai nguyên tố X và Y lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Do X và Y liên tiếp trong bảng tuần hoàn → pY – pX = 1 (1)
Mà: (pX + eX ) + (pY + eY) = 66 → pX + pY = 33 (2)
Giải (1) và (2) ta được: pX = 16 (S); pY = 17 (Cl)
Vậy hai nguyên tố X và Y lần lượt là S và Cl.
Câu 14:
200 ml dung dịch HCl có nồng độ 3,5M hoà tan vừa hết 20 gam hỗn hợp hai oxit CuO và Fe2O3.
a. Viết các phương trình hóa học.
b. Tính khối lượng của mỗi oxit có trong hỗn hợp ban đầu.
 Xem đáp án
Xem đáp án
) Phương trình hoá học:
CuO + 2HCl → CuCl2 + H2O
Fe2O3 + 6HCl → FeCl3 + 3H2O
b)
Gọi
Ta có:
Câu 15:
Viết các công thức cấu tạo và gọi tên các hợp chất mạch hở có công thức phân tử: C3H5Cl?
 Xem đáp án
Xem đáp án
CH3 – CH = CH – Cl: 1 – cloprop – 1 – en
CH3 – CCl = CH2: 2 – cloprop – 1 – en
CH2Cl – CH = CH2: 3 – cloprop – 1 – en.
Câu 16:
Hỗn hợp X gồm 3-cloprop-1-en và vinylclorua. Khi đốt cháy hoàn toàn hỗn hợp X thu được CO2 và HCl với tỉ lệ số mol tương ứng là 5/2. % số mol của vinylclorua trong X là:
A. 50,00%;
B. 55,04%;
C. 44,96%;
D. 20,00%.
 Xem đáp án
Xem đáp án
CH2Cl – CH = CH2: 3 – cloprop – 1 – en: x (mol; x > 0)
CH2 = CHCl: Vinylclorua: y (mol; y > 0)
Khi đốt cháy hoàn toàn hỗn hợp X thu được CO2 và HCl với tỉ lệ số mol tương ứng là 5/2 nên:
Vậy % số mol của vinylclorua trong X là:
Câu 17:
Có hỗn hợp gồm kim loại Cu và Al. Bằng phương pháp hoá học hãy tách riêng bột Cu ra khỏi hỗn hợp?
 Xem đáp án
Xem đáp án
Cho hỗn hợp vào dung dịch H2SO4 đặc nguội thì ta tách được nhôm vì Al bị thụ động bởi axit sunfuric đặc nguội, còn Cu bị hoà tan.
PTHH:
- Cho Mg vào dung dịch CuSO4 để thu được Cu.
PTHH: Mg + CuSO4 → MgSO4 + Cu.
Câu 18:
Viết công thức cấu tạo các chất có tên gọi sau:
a) 3 – etyl - 2,3 - đimetylpentan
b) 2,2,3,4 - tetrametyl heptan
c) 2,2,3 - trimetyl hexan.
 Xem đáp án
Xem đáp án
a) CH3 – CH(CH3) – (CH3)C(C2H5) – CH2 – CH3
b) CH3 – C(CH3)2 – CH(CH3) – CH(CH3) – CH2 – CH2 – CH3
c) CH3 – C(CH3)2 – CH(CH3) – CH2 – CH2 – CH3.
Câu 19:
Trong các công thức sau đây, chọn công thức đúng của magie photphua:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Công thức đúng của magie photphua là Mg3P2.
Câu 20:
Một hiđrocacbon A ở thể tích 4,48 lít (đktc) tác dụng vừa đủ với 4 lít dung dịch Br2 0,1M thu được chất B chứa 85,562% Br. Tìm công thức phân tử.
 Xem đáp án
Xem đáp án
Có: → A là ankin (CnH2n-2, )
→ MB = 14n – 2 + 320 = 374 → n = 4 (Thoả mãn)
Vậy A có công thức phân tử là C4H6.
Câu 22:
Cho 250 ml dung dịch NaOH 1M tác dụng với 100 ml dung dịch H3PO4 1M, sau phản ứng thu được m gam muối khan. Tính m?
 Xem đáp án
Xem đáp án
Xét
→ Sinh ra 2 muối
Bảo toàn Na: 2a + 3b = nNaOH = 0,25 (1)
Bảo toàn P:
Giải (1), (2), ta được: a = b = 0,05
Câu 23:
6,72 khí CO2 (đktc) tác dụng vừa hết với 600 ml dung dịch Ba(OH)2, sản phẩm tạo thành là BaCO3 và nước. Tính khối lượng kết tủa tạo thành và nồng độ dung dịch Ba(OH)2?
 Xem đáp án
Xem đáp án
PTHH:
Câu 24:
A, B là 2 nguyên tố thuộc cùng 1 phân nhóm và thuộc 2 chu kì liên tiếp nhau trong bảng tuần hoàn. Biết tổng số p trong hạt nhân nguyên tử A, B là 32. Viết cấu hình của A, B và xác định vị trí của chúng trong bảng tuần hoàn?
 Xem đáp án
Xem đáp án
Theo bài ra, tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32 nên ZA + ZB = 32.
Trường hợp 1: ZB - ZA = 8. Ta tìm được ZA = 12; ZB = 20.
Cấu hình electron:
A : 1s22s22p63s2 (chu kỳ 3, nhóm IIA).
và B: 1s22s22p63s23p64s2 (chu kỳ 4, nhóm IIA).
Ion A2+: 1s22s22p6 và B2+: 1s22s22p63s23p6.
Trường hợp 2: ZB - ZA = 18. Ta tìm được ZA = 7; ZB = 25.
Cấu hình electron:
A: 1s22s22p3 (chu kỳ 2, nhóm VA).
và B: 1s22s22p63s23p63d54s2 (chu kỳ 4, nhóm VIIB).
Trường hợp này A, B không cùng nhóm nên không thỏa mãn.
Câu 25:
A và B là 2 nguyên tố liên tiếp nhau trong cùng một chu kì. Tổng số proton trong hạt nhân 2 nguyên tử A và B bằng 49. Viết cấu hình electron cho 2 nguyên tử A, B và xác định vị trí của chúng trong bảng tuần hoàn?
 Xem đáp án
Xem đáp án
- Tổng số proton trong hạt nhân 2 nguyên tử A và B bằng 49
nên ZA + ZB = 49 (1)
- A và B là 2 nguyên tố liên tiếp nhau trong cùng một chu kì
nên ZB – ZA = 1 (2)
Giải (1), (2) ta được: ZA = 24; ZB = 25
Cấu hình electron của nguyên tử A là: 1s22s22p63s23p63d54s1
→ A thuộc chu kì 4, nhóm VIB
Cấu hình electron của nguyên tử B là: 1s22s22p63s23p63d54s2
→ B thuộc chu kì 4, nhóm VIIB.
Câu 27:
Tổng số hạt trong nguyên tử nguyên tố X là 82. Trong hạt nhân, số hạt mang điện ít hơn số hạt không mang điện là 4. Kí hiệu nguyên tử X là:
(Cho số hiệu nguyên tử của Cr = 24; Mn = 25; Fe = 26; Zn = 30)
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Gọi số hạt proton, neutron, electron trong một nguyên tử X lần lượt là P, N, E.
Ta có: P = E
Tổng số hạt trong nguyên tử X là: P + N + E = 2P + N = 82 (1)
Số hạt mang điện trong hạt nhân nguyên tử là: P
Số hạt không mang điện trong hạt nhân nguyên tử là: N
Trong hạt nhân, số hạt mang điện ít hơn số hạt không mang điện là 4
nên N – P = 4 (2)
Từ (1) và (2) ta có hệ phương trình:
Giải hệ phương trình ta được P = 26; N = 30
Vì số hiệu nguyên tử Z = số p ⇒ Z = 26
⇒ X có kí hiệu hóa học là Fe.
Số khối: A = P + N = 26 + 30 = 56
Kí hiệu nguyên tử của X là .
Câu 28:
Viết các phản ứng cho quá trình oxi hóa, quá trình khử và cân bằng các phản ứng sau:
a) Ag+ + Fe2+ → Ag + Fe3+
b) Cr3+ + Zn → Cr + Zn2+
c) CH4 + O2 → CO2 + H2O
d) MnO2 + Al → Mn + Al2O3
 Xem đáp án
Xem đáp án
a)
Quá trình oxi hóa:
Quá trình khử:
Phương trình hóa học: Ag+ + Fe2+ → Ag + Fe3+
b)
Quá trình oxi hóa:
Quá trình khử:
Phương trình hóa học: 2Cr3+ + 3Zn → 2Cr + 3Zn2+
c)
Quá trình oxi hóa:
Quá trình khử:
Phương trình hóa học: CH4 + 2O2 CO2 + 2H2O
d)
Quá trình oxi hóa:
Quá trình khử:
Phương trình hóa học: 3MnO2 + 4Al 3Mn + 2Al2O3
Câu 30:
AgNO3 có đổi màu quỳ tím không?
 Xem đáp án
Xem đáp án
AgNO3 có đổi màu quỳ tím sang màu đỏ vì AgNO3 được tạo thành kim loại yếu và gốc axit mạnh.
Câu 31:
AgNO3 tác dụng H2SO4 có hiện tượng gì?
 Xem đáp án
Xem đáp án
AgNO3 tác dụng H2SO4 có hiện tượng: Xuất hiện kết tủa màu trắng.
2AgNO3 + H2SO4 → Ag2SO4↓ + 2HNO3
Câu 32:
NaNO3 có tác dụng với AgNO3 không?
 Xem đáp án
Xem đáp án
NaNO3 không tác dụng với AgNO3 vì để phản ứng xảy ra trong dung dịch, sản phẩm cần thỏa mãn ít nhất một điều kiện sau:
- Có chất kết tủa.
- Có chất khí.
- Nước.
Câu 33:
Cân bằng phương trình hóa học của các phản ứng oxi hóa khử sau bằng phương pháp thăng bằng electron và cho biết chất khử, chất oxi hóa trong mỗi phản ứng đó.
1. Al + Fe2O3 → Al2O3 + Fe
2. NH3 + O2 → NO + H2O
 Xem đáp án
Xem đáp án
1. Chất khử: Al; chất oxi hoá: Fe2O3
Sự oxi hoá:
Sự khử:
2. Chất khử: NH3; chất oxi hoá: O2
Sự oxi hoá:
Sự khử:
Câu 34:
Phản ứng: Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O. Tổng hệ số các chất (là số nguyên tối giản) sau khi phản ứng được cân bằng?
 Xem đáp án
Xem đáp án
8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Tổng hệ số các chất (là số nguyên tối giản) sau khi phản ứng được cân bằng là 58.
Chọn A
Câu 35:
Nhôm hiđroxit Al(OH)3 không bị hòa tan trong dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Nhôm hiđroxit Al(OH)3 không bị hòa tan trong dung dịch NH3.
Al(OH)3 bị hòa tan trong dung dịch HCl, NaOH và NaHSO4 theo phương trình:
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → NaAlO2 + 2H2O
2Al(OH)3+ 6NaHSO4 → Al2(SO4)3 + 3Na2SO4 + 6H2O
Câu 36:
Hoàn thành chuỗi phản ứng sau:
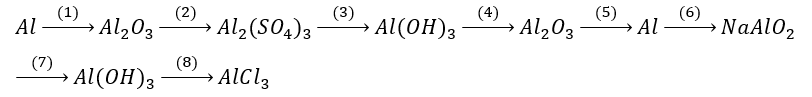
 Xem đáp án
Xem đáp án
(1)
(2) Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
(3) Al2(SO4)3 + 6NaOH → 2Al(OH)3↓ + 3Na2SO4
(4)
(5)
(6) 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
(7) NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
(8) Al(OH)3 + 3HCl → AlCl3 + 3H2O
Câu 37:
Viết phương trình phản ứng dưới dạng ion, phân tử, ion thu gọn:
Al(OH)3 + NaOH →?
 Xem đáp án
Xem đáp án
Phương trình phân tử: Al(OH)3 + NaOH → NaAlO2 + 2H2O
Phương trình dưới dạng ion:
Phương trình ion thu gọn:
Câu 38:
 Xem đáp án
Xem đáp án
- Al2O3 là một oxit lưỡng tính nên vừa tác dụng với axit, vừa tác dụng với bazơ.
- Al2O3 không tan trong nước.
Câu 39:
Hòa tan hoàn toàn 11,6 gam hỗn hợp X gồm Al2O3 và Zn vào dung dịch HCl 20% (vừa đủ). Sau khi phản ứng kết thúc thu được 2,24 lít khí H2 (đktc).
a) Tính khối lượng dung dịch HCl đã dùng.
b) Cho 11,6 gam hỗn hợp X trên vào dung dịch CuSO4 dư. Tính khối lượng chất rắn thu được sau khi phản ứng kết thúc.
 Xem đáp án
Xem đáp án
a)
Phương trình:
Theo phương trình (2):
Theo phương trình (1), (2), ta có:
b) Cho 11,6 gam hỗn hợp X trên vào dung dịch CuSO4 dư thì chỉ xảy ra phương trình: Zn + CuSO4 → ZnSO4 + Cu (3)
Vậy chất rắn thu được gồm Cu và Al2O3.
Theo phương trình (3): nCu = nZn = 0,1 (mol)
→mchất rắn = mCu + = 0,1. 64 + 5,1 = 11,5 (g)
Vậy khối lượng chất rắn thu được sau khi phản ứng kết thúc là 11,5 gam.
Câu 40:
Theo thuyết axit – bazơ của Bronstet, ion Al3+ trong nước có tính chất:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nên Al3+ có tính axit.
Câu 41:
Trong phòng thí nghiệm có 8 lọ hóa chất mất nhãn đựng riêng biệt các dung dịch sau: NaCl, NaNO3, MgCl2, Mg(NO3)2, AlCl3, Al(NO3)3, CuCl2, Cu(NO3)2. Bằng phương pháp hóa học hãy nhận biết mỗi dung dịch? Viết phương trình phản ứng xẩy ra và ghi rõ điều kiện của phản ứng (nếu có).
 Xem đáp án
Xem đáp án
Cho NaOH dư vào:
+ Các chất không có hiện tượng là: NaCl, NaNO3 (1)
+ Các chất xuất hiện kết tủa trắng là: MgCl2, Mg(NO3)2 (2)
+ Các chất xuất hiện kết tủa keo trắng, sau đó tan dần đến hết là: Al(NO3)3, AlCl3 (3)
+ Các chất xuất hiện kết tủa xanh lam là: Cu(NO3)2, CuCl2 (4)
Cho nhóm (1) vào dd AgNO3:
+ Xuất hiện kết tủa trắng là NaCl (nhận ra)
+ Không hiện tượng NaNO3 (nhận ra)
Cho nhóm (2) vào dd AgNO3:
+ Xuất hiện kết tủa trắng là MgCl2 (nhận ra)
+ Không hiện tượng Mg(NO3)2 (nhận ra)
Cho nhóm (3) vào dd AgNO3:
+ Xuất hiện kết tủa trắng là AlCl3 (nhận ra)
+ Không hiện tượng Al(NO3)3 (nhận ra)
Cho nhóm (4) vào dd AgNO3:
+ Xuất hiện kết tủa trắng là CuCl2 (nhận ra)
+ Không hiện tượng Cu(NO3)2 (nhận ra).
Câu 42:
Tại sao Al(NO3)3 không tác dụng với HCl?
 Xem đáp án
Xem đáp án
Al(NO3)3 không tác dụng với HCl vì không thoả mãn điều kiện xảy ra phản ứng trao đổi là có chất khí, chất kết tủa, nước hay chất điện li yếu tạo thành.
Câu 43:
Axit clohiđric trong dạ dày có vài trò rất quan trọng đối với quá trình trao đổi chất ở cơ thể người. Nhưng đôi khi ta có cảm giác đầy hơi và ợ chua (nhất là sau khi ăn) là do một trong các nguyên nhân là axit ở dạ dày đã tác dụng ngược lên vùng thực quản. Uống thuốc kháng axit có thể làm giảm cảm giác này. Một trong các thành phần thuốc kháng axit là Mg(OH)2. Em hãy cho biết tác dụng của thuốc kháng axit và viết phương trình hoá học minh họa?
 Xem đáp án
Xem đáp án
Mg(OH)2 là bazơ nên trung hoà axit clohidric trong dạ dày
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Câu 44:
Axit H2SO4 loãng có thể tác dụng với dãy các chất nào sau đây:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Đáp án A sai vì có Cu không tác dụng với H2SO4 loãng
Đáp án B sai vì có SO2 không tác dụng với H2SO4 loãng
Đáp án D sai vì có Ag không tác dụng với H2SO4 loãng
Axit H2SO4 loãng có thể tác dụng với dãy các chất CaO, Zn, NaOH, ZnO, Fe, KOH, Fe(OH)3, K, FeO,…
Câu 45:
Axit H3PO4 và HNO3 cùng có phản ứng với nhóm các chất nào dưới đây ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Loại A, B, C vì 2 axit trên không tác dụng với CuSO4, CuCl2, NaCl.
Câu 46:
HCl không tác dụng với cặp chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các phương trình hoá học:
Mg + 2HCl → MgCl2 + H2↑
2Al + 6HCl → 2AlCl3 + 3H2↑
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 2H2O
NaOH + HCl → NaCl + H2O
AgNO3 + HCl → AgCl↓ + HNO3
NaNO3 + HCl → Không xảy ra
Cu + HCl → Không xảy ra.
Câu 48:
Ba3(PO4)2 kết tủa màu trắng hay vàng?
 Xem đáp án
Xem đáp án
Ba3(PO4)2 kết tủa màu trắng, được tạo ra theo phương trình sau:
Câu 49:
 Xem đáp án
Xem đáp án
Điều kiện của phản ứng giữa muối với muối là: Các chất tham gia phản ứng phải tan. Sản phẩm tạo thành phải có ít nhất 1 chất kết tủa.
KHCO3 và BaCl2 là những chất tan. Đây là điều kiện cần để phản ứng giữa muối với muối xảy ra. Tiếp theo ta xét chất sản phẩm đó là Ba(HCO3)2 và KCl, 2 chất này đều tan. Việc này không thỏa mãn điều kiện của phản ứng giữa muối với muối nên xem như phản ứng của KHCO3 vs BaCl2 không xảy ra.
Câu 50:
 Xem đáp án
Xem đáp án
BaCl2 không tác dụng với HCl do sản phẩm tạo ra không thoả mãn điều kiện của phản ứng trao đổi.
Điều kiện xảy ra phản ứng trao đổi:
- Tạo kết tủa hoặc chất bay hơi
- Tạo chất điện li yếu (nước, axit yếu).