(2023) Đề thi thử Hóa học THPT Hàn Thuyên, Bắc Ninh (Lần 3) có đáp án
(2023) Đề thi thử Hóa học THPT Hàn Thuyên, Bắc Ninh (Lần 3) có đáp án
-
969 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 3:
Chất X là thành phần chính tạo nên màng tế bào thực vật, tạo nên bộ khung của cây cối. Thủy phân hoàn toàn X, thu được chất Y. Trong mật ong Y chiếm khoảng 30%. Trong máu người có một lượng nhỏ Y không đổi là 0,1%. Hai chất X, Y lần lượt là
 Xem đáp án
Xem đáp án
Chất X là thành phần chính tạo nên màng tế bào thực vật, tạo nên bộ khung của cây cối → X là xenlulozơ.
Thủy phân hoàn toàn X, thu được chất Y → Y là glucozơ.
Chọn B
Câu 5:
Trong tự nhiên, canxi sunfat tồn tại dưới dạng muối ngậm nước (CaSO4.2H2O) được gọi là
 Xem đáp án
Xem đáp án
Chọn D
Câu 6:
Cho 11,6 gam Fe vào 100 ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam hỗn hợp kim loại. Giá trị của m là
 Xem đáp án
Xem đáp án
nFe = 11,6/56 > nCu2+ = 0,1 nên Cu2+ bị khử hết.
m = 11,6 – 0,1.56 + 0,1.64 = 12,4 gam
Chọn A
Câu 7:
Kim loại sắt tác dụng với chất nào sau đây thu được sản phẩm là hợp chất sắt (II) sau phản ứng?
 Xem đáp án
Xem đáp án
Chọn A
Câu 9:
Cho 8,9 gam H2NCH(CH3)COOH phản ứng hoàn toàn với dung dịch KOH vừa đủ, thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
H2NCH(CH3)COOH + KOH → H2NCH(CH3)COOK + H2O
nAlaK = nAla = 0,1 → mAlaK = 12,7 gam
Chọn C
Câu 10:
Thuỷ phân 62,5 gam dung dịch saccarozơ 17,1% trong môi trường axit (vừa đủ) được dung dịch X. Cho dung dịch AgNO3/NH3 vào X và đun nhẹ được m gam Ag, biết các phản ứng xảy ra hoàn toàn giá trị của m là?
 Xem đáp án
Xem đáp án
C12H22O11 → 2C6H12O6 → 4Ag
342………………………..4.108
62,5.17,1%……………….mAg
→ mAg = 62,5.17,1%.4.108/342 = 13,5
Chọn B
Câu 11:
Ở điều kiện thích hợp, este có công thức cấu tạo CH3COOC2H5 được tạo từ hai chất nào sau đây phản ứng với nhau?
 Xem đáp án
Xem đáp án
Chọn D
Câu 14:
Geranyl axetat là este có mùi hoa hồng, có công thức cấu tạo là CH3COOC10H17. Phần trăm khối lượng của cacbon trong geranyl axetat là
 Xem đáp án
Xem đáp án
Chọn B
Câu 15:
Các kim loại đều dễ rèn, dễ rát mỏng, dễ kéo thành sợi là nhờ vào tính chất nào sau đây?
 Xem đáp án
Xem đáp án
Chọn A
Câu 18:
Chỉ dùng dung dịch KOH để phân biệt được các chất riêng biệt trong nhóm nào sau đây?
 Xem đáp án
Xem đáp án
Chỉ dùng dung dịch KOH để phân biệt được các chất riêng biệt trong nhóm Mg, Al2O3, Al.
+ Không tan là Mg
+ Tan, không có khí là Al2O3
Al2O3 + KOH → KAlO2 + H2O
+ Tan, có khí là Al
Al + H2O + KOH → KAlO2 + H2
Chọn B
Câu 21:
Hoà tan m gam Al bằng dung dịch HCl (dư), thu được 6,72 lít H2 (đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
2Al + 6HCl → 2AlCl3 + 3H2
nH2 = 0,3 → nAl = 0,2 → mAl = 5,4 gam
Chọn A
Câu 22:
Thủy phân este nào sau đây trong môi trường kiềm tạo ra 2 sản phẩm hữu cơ có cùng số nguyên tử cacbon?
 Xem đáp án
Xem đáp án
Chọn D
Câu 23:
Mưa axit ảnh hưởng tới hệ thực vật, phá hủy các vật liệu bằng kim loại, các bức tượng bằng đá, gây bệnh cho con người và động vật. Hiện tượng trên gây ra chủ yếu do khí thải của nhà máy nhiệt điện, phương tiện giao thông và sản xuất công nghiệp…. Tác nhân chủ yếu trong khí thải gây ra mưa axit là.
 Xem đáp án
Xem đáp án
Chọn B
Câu 28:
Kim loại nào sau đây không tác dụng được với dung dịch H2SO4 loãng sinh ra khí H2
 Xem đáp án
Xem đáp án
Chọn B
Câu 29:
Cho các phát biểu sau:
(1) Glucozơ được dùng để tráng gương, tráng ruột phích, làm thuốc tăng lực.
(2) Thành phần chính của cồn 75° mà trong y tế thường dùng để sát trùng là metanol.
(3) Axit glutamic là thuốc ngăn ngừa và chữa trị các triệu chứng suy nhược thần kinh (mất ngủ, nhức đầu, ù tai, chóng mặt).
(4) Tơ nilon-6,6 được trùng hợp bởi hexametylenđiamin và axit ađipic.
(5) Các hợp chất hữu cơ luôn có số chẵn nguyên tử hiđro.
(6) Chất béo lỏng dễ dàng bị oxi hóa thành chất béo rắn.
(7) Nhỏ dung dịch brom vào dung dịch anilin, thu được kết tủa trắng.
(8) Đưa đũa thuỷ tinh vừa nhúng dung dịch HCl đậm đặc lên sát trên miệng lọ đựng dung dịch metylamin đặc thấy có khói trắng.
(9) Nhỏ vài giọt chanh vào cốc sữa thấy xuất hiện kết tủa.
(10) Nhỏ dung dịch I2 vào lát cắt của quả chuối xanh thì xuất hiện màu xanh tím.
Số phát biểu đúng là:
 Xem đáp án
Xem đáp án
(1) Đúng
(2) Sai, thành phần chính của cồn 75° là etanol.
(3) Đúng
(4) Sai, tơ nilon-6,6 được trùng ngưng bởi hexametylenđiamin và axit ađipic.
(5) Sai, có thể chẵn hoặc lẻ (như CH5N, CH3Cl…)
(6) Sai, khử chất béo lỏng bằng H2 dư thu được chất béo rắn.
(7) Đúng
(8) Đúng, khói trắng là các hạt nhỏ CH3NH3Cl, được tạo ra do CH3NH2 và HCl đều dễ bay hơi và tương tác với nhau.
(9) Đúng, sữa chứa protein hòa tan, bị đông tụ bởi axit trong chanh.
(10) Đúng, chuối xanh chứa nhiều tinh bột nên tạo màu xanh tím với I2.
Chọn A
Câu 30:
Thực hiện sơ đồ phản ứng sau:
(1) X1 + X2 → X3↓ + X4↑ + X5 (điện phân dung dịch, điện cực trơ)
(2) X3 + X5 → X1 + NO + H2O
(3) X4 + X6 → FeCl3
Các chất X1, X2, X4, X6 lần lượt là :
 Xem đáp án
Xem đáp án
(1) Cu(NO3)2 (X1) + HCl (X2) → Cu (X3) + Cl2 (X4) + HNO3 (X5)
(2) Cu + HNO3 → Cu(NO3)2 + NO + H2O
(3) Cl2 + FeCl2 (X6) → FeCl3
Các chất X1, X2, X4, X6 lần lượt là Cu(NO3)2, HCl, Cl2, FeCl2.
Chọn C
Câu 31:
Đốt cháy hoàn toàn a gam một triglixerit X, cần dùng 24,15 mol O2, thu được 17,1 mol CO2 và 15,9 mol H2O. Cho các phát biểu sau:
(1) Số nguyên tử (H) có trong một phân tử X là 106.
(2) a gam chất X có thể cộng tối đa 0,4 mol Br2.
(3) Xà phòng hóa hoàn toàn a gam X bằng dung dịch NaOH thì thu được 274,2 gam muối.
(4) Trong một phân tử X có 2 liên kết π.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Bảo toàn O: 6nX + 2nO2 = 2nCO2 + nH2O
→ nX = 0,3
Số C = nCO2/nX = 57
Số H = 2nH2O/nX = 106
→ X là C57H106O6
(1) Đúng
(2) Sai, X có k = (57.2 + 2 – 106)/2 = 5
→ nBr2 = nX(k – 3) = 0,6
(3) Đúng
nNaOH = 3nX = 0,9 và nC3H5(OH)3 = nX = 0,3
Bảo toàn khối lượng:
m muối = mX + mNaOH – mC3H5(OH)3 = 274,2
(4) Sai, một phân tử X có 5 liên kết π (2C=C + 3C=O).
Chọn C
Câu 32:
Thành phần chính của quặng apatit là 3Ca3(PO4)2.CaF2 (hay được viết dạng thu gọn là Ca5(PO4)3F) được sử dụng làm nguyên liệu để sản xuất phân bón theo các giai đoạn sau:
Giai đoạn 1: 3Ca3(PO4)2.CaF2 + 10H2SO4 + 5H2O → 6H3PO4 + 10CaSO4.0,5H2O↓ + 2HF↑
Giai đoạn 2: 3Ca3(PO4)2.CaF2 + 14H3PO4 → 10Ca(H2PO4)2 + 2HF↑
Phân lân thu được sau hai giai đoạn trên chứa Ca(H2PO4)2 và các chất khác không chứa photpho. Hàm lượng P2O5 có trong phân lân đó là 56,8%. Khối lượng quặng apatit (chứa 90% Ca5(PO4)3F và 10% tạp chất không chứa photpho) để điều chế được 120 tấn phân lân đó là
 Xem đáp án
Xem đáp án
nP2O5 = 120.56,8%/142 = 0,48
Bảo toàn P → nCa5(PO4)3F = 0,48.2/3 = 0,32
m quặng cần dùng = 0,32.504/90% = 179,2 tấn
Chọn D
Câu 33:
Cho sơ đồ chuyển hoá:
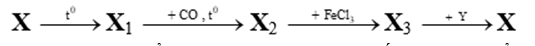
(Biết CO và Y dư, các phản ứng xẩy ra hoàn toàn). Cặp chất X, Y có thể là :
 Xem đáp án
Xem đáp án
X1 bị khử bởi CO nên loại A
→ X1 là oxit sắt, X2 là Fe, X3 là FeCl2
→ Y là AgNO3 và X là Fe(NO3)3
Chọn C
Câu 34:
Thực hiện các thí nghiệm sau:
(a) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(b) Sục khí CO2 vào dung dịch Ca(OH)2.
(c) Cho Si vào dung dịch KOH.
(d) Cho P2O5 tác dụng với H2O.
(e) Đốt cháy dây Mg trong khí CO2.
(f) Đốt cháy NH3 trong không khí.
(g) Cho mẩu Al vào dung dịch H2SO4 loãng, nguội.
(h) Mẩu gang để trong không khí ẩm.
Trong các thí nghiệm trên số thí nghiệm xảy ra phản ứng oxi hóa - khử là :
 Xem đáp án
Xem đáp án
(a) Fe2+ + H+ + NO3- → Fe3+ + NO + H2O
(b) CO2 + Ca(OH)2 → CaCO3 + H2O
(c) Si + H2O + KOH → K2SiO3 + H2
(d) P2O5 + H2O → H3PO4
(e) Mg + CO2 → MgO + C
(f) NH3 + O2 → N2 + H2O
(g) Al + H2SO4 → Al2(SO4)3 + H2
(h) Có ăn mòn điện hóa (có oxi hóa khử)
Chọn C
Câu 35:
Thực hiện các thí nghiệm sau:
+ Hidro hóa hoàn toàn anđehit X, không no mạch hở thu được ancol Y. Đốt cháy hoàn toàn hỗn hợp chứa X, Y có tỉ lệ mol 2 : 3 thu được 3,36 lít CO2 (đktc) và 2,88 gam nước.
+ Cho axit cacboxylic Z, mạch hở, tác dụng với dung dịch NaHCO3 dư thu được khí CO2 có thể tích bằng với thể tích của Z phản ứng (đo cùng điều kiện). Đốt cháy hoàn toàn 0,04 mol Z cần 2,688 lít O2 (đktc) thu được 1,44 gam nước.
+ Đun nóng Z và Y với H2SO4 đặc thu được este đơn chức, mạch hở G. Đốt cháy hoàn toàn 0,06 mol hỗn hợp chứa X, Z, G có tỉ lệ mol tương ứng 3 : 2 : 1 cần dùng V lít O2 (đktc). Giá trị V là.
 Xem đáp án
Xem đáp án
nX = 2x; nY = 3x; X có độ không no là k
nCO2 = 0,15; nH2O = 0,16
→ nH2O – nCO2 = 0,01 = 2x(1 – k) + 3x = 5x – 2kx
X không no nên k ≥ 2 → k = 2 là nghiệm duy nhất
→ x = 0,01 → Số C = nCO2/5x = 3
X là C2H3CHO và Y là C2H5CH2OH
nCO2 = nZ nên Z đơn chức. Đốt 0,04 mol Z cần nO2 = 0,12, tạo nH2O = 0,08
Số H của Z = 0,08.2/0,04 = 4
Bảo toàn O → nCO2 = 0,12 → Số C = 0,12/0,04 = 3
Z là C2H3COOH
Đốt cháy hỗn hợp C2H3CHO (0,03), C2H3COOH (0,02) và C2H3COOCH2C2H5 (0,01) cần:
nO2 = 0,03.3,5 + 0,02.3 + 0,01.7,5 = 0,24
→ VO2 = 5,376 lít
Chọn A
Câu 36:
Khi đốt cháy hoàn toàn 1 mol etanol tỏa ra lượng nhiệt là 1235 kJ. Giả thiết, cồn là etanol nguyên chất, lượng nhiệt thất thoát ra môi trường là 40%, để nâng 1 gam nước lên 1°C cần cung cấp lượng nhiệt là 4,2 J. Khối lượng cồn cần dùng để đun 100 gam nước từ 25°C đến 100°C gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nC2H5OH = x → 60%.1235.10³.x = 100.4,2.(100 – 25)
→ x = 0,04251
→ mC2H5OH = 1,96 gam
Chọn B
Câu 37:
Este E là este no, mạch hở và có công thức phân tử C7HmOm-4. Cho E tác dung với dung dung dịch NaOH dư sau phản ứng hoàn toàn thu được hai muối X, Y (đều là muối của axit cacboxylic, MX < MY) và một ancol Z. Cho các phát biểu sau:
(a) Có 3 công thức cấu tạo phù hợp tính chất của E
(b) X là muối của axit cacboxylic có khả năng tham gia phản ứng tráng bạc
(c) Trong phân tử Z thì số nguyên tử cacbon bằng số nhóm -OH
(d) Nung muối Y với hỗn hợp rắn NaOH/CaO thu được khí H2
(e) Phân tử Y hơn phân tử X một nhóm CH2
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
E là este no, mạch hở nên k = số chức este = (m – 4)/2
→ (m – 4)/2 = (7.2 + 2 – m)/2 → m = 10
→ E là C7H10O6
Cấu tạo: (HCOO)2(CH3COO)C3H5
X là HCOONa, Y là CH3COONa, Z là C3H5(OH)3
(a) Sai, E có 2 cấu tạo:
CH3COOCH2-CH(OOCH)-CH2(OOCH)
CH3COOCH(CH2OOCH)2
(b) Đúng, HCOOH hay HO-CHO có tráng bạc.
(c) Đúng, Z có 3C, 3OH
(d) Sai: CH3COONa + NaOH → CH4 + Na2CO3
(e) Đúng
Chọn A
Câu 38:
Có hai bình điện phân (1) và bình điện phân (2). Trong đó bình (1) đựng 26,3 ml dung dịch NaOH 2M. Trong bình (2) có chứa m gam hỗn hợp chất tan gồm Cu(NO3)2 và NaCl (điện cực trơ, màng ngăn xốp). Mắc nối tiếp bình (1) và bình (2). Điện phân dung dịch một thời gian, thu được kết quả như sau
|
Thời gian (s) |
Bình (2) |
Bình (1) |
|
|
Khối lượng catot tăng |
Khí |
CM NaOH |
|
|
t |
m1 |
Khí duy nhất |
2,17896M |
|
2t |
5m1/3 |
0,235 mol khí ở 2 cực |
2,39308M |
Coi các phản ứng xảy ra hoàn toàn. Giá trị m gần nhất với
 Xem đáp án
Xem đáp án
Bình 2: nNaOH = 0,0526
Trong t giây đã điện phân hết x mol H2O
→ Thể tích còn lại 26,3 – 18x ml
→ nNaOH = 0,0526 = 2,17896.(26,3 – 18x)/1000
→ x = 0,12
→ ne trong t giây = 2x = 0,24
Bình 1:
Trong t giây:
Catot: nCu = 0,12
Anot: nCl2 = 0,12
Trong 2t giây:
Catot: nCu = 0,12.5/3 = 0,2 và nH2 = a
Anot: nCl2 = b và nO2 = c
ne = 0,2.2 + 2a = 2b + 4c = 0,24.2
n khí tổng = a + b + c = 0,235
→ a = 0,04; b = 0,15 và c = 0,045
Ban đầu: nCu(NO3)2 = 0,2 và nNaCl = 2b = 0,3
→ m = 55,15
Chọn B
Câu 39:
Nung hỗn hợp X gồm FeCO3 và Fe(NO3)2 trong bình kín không chứa không khí. Sau phản ứng xảy ra hoàn toàn thu được một chất rắn duy nhất và hỗn hợp Y chứa hai chất khí. Phần trăm khối lượng của FeCO3 trong X gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
FeCO3 (a) + Fe(NO3)2 (b) → Fe2O3 + NO2 (2b) + CO2
Bảo toàn electron: a + b = 2b → a = b
%FeCO3 = 116a/(116a + 180b) = 39,19%
Chọn A
Câu 40:
Tiến hành thí nghiệm theo như sau:
- Bước 1: Rót vào 2 cốc thủy tinh dung tích 50 ml (đánh số là (1) và (2)), mỗi cốc khoảng 10 ml dung dịch H2SO4 1M (lấy dư) và cho vào mỗi cốc một mẩu kẽm (giống nhau).
- Bước 2: Nhỏ thêm 2-3 giọt dung dịch CuSO4 vào cốc (1) và 2-3 giọt dung dịch MgSO4 vào cốc (2).
Cho các phát biểu sau:
(a) Ở bước 1, tốc độ thoát khí H2 ở hai cốc là như nhau.
(b) Ở bước 2, tốc độ thoát khí H2 ở cốc (1) mạnh hơn ở cốc (2).
(c) Sau khi kết thúc phản ứng, lượng muối ZnSO4 ở cốc (1) nhiều hơn ở cốc (2).
(d) Sau khi kết thúc phản ứng, lượng khí H2 thu được ở cốc (1) nhiều hơn ở cốc (2).
(e) Tại cốc (1) có xảy ra ăn mòn điện hóa còn cốc (2) chỉ xảy ra ăn mòn hóa học.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng, bước 1 có điều kiện phản ứng như nhau nên tốc độ thoát khí giống nhau.
(b) Đúng, tại cốc 1 có ăn mòn điện hóa (Cặp Zn-Cu, trong đó Cu vừa tạo ra do Zn khử) nên ăn mòn nhanh hơn cốc 2.
(c) Sai, Zn ban đầu giống nhau nên ZnSO4 cũng giống nhau
(d) Sai, H2 thoát ra nhanh chậm khác nhau nhưng cuối cùng cũng bằng nhau về lượng (Coi như lượng Zn khử Cu2+ là không đáng kể)
(e) Đúng, cốc 1 có cả ăn mòn điện hóa và hóa học, cốc 2 chỉ có ăn mòn hóa học.
Chọn B
